(本文初作于2020年6月20日,内容有所补充,原文地址:新冠君,你额头的Lab金印怎么洗)
新冠君,快收了你的变异神通吧!
1. SARS-CoV-2的backbone,是由SARS-CoV与CoVZC45嵌合而成的。
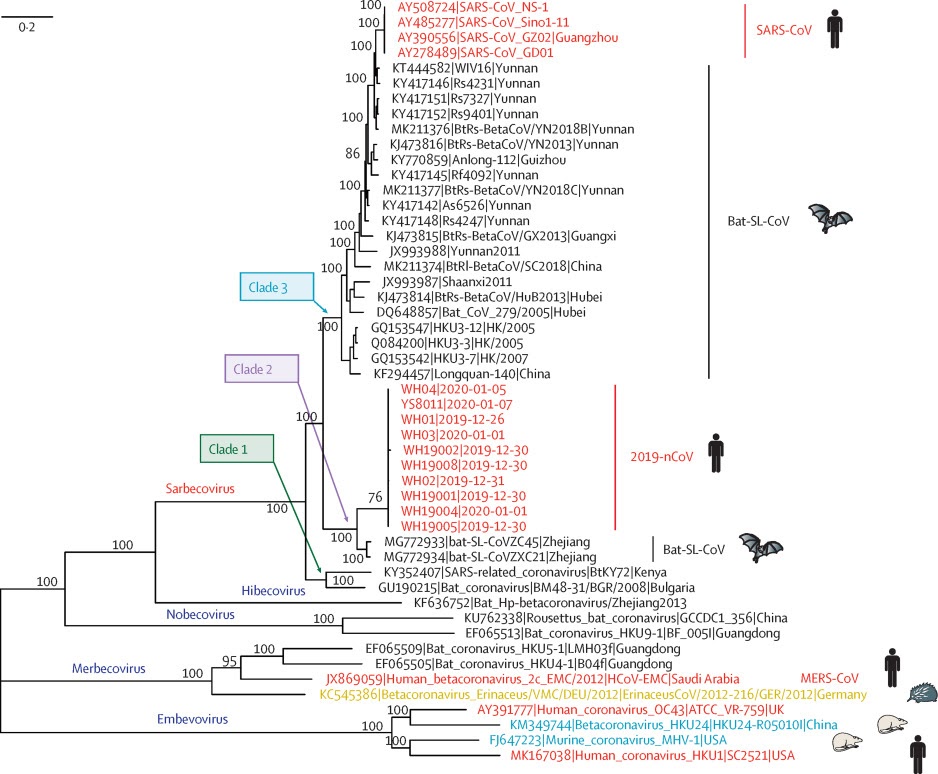
SARS-CoV-2就是新冠病毒,SARS-CoV是非典病毒,这大家都知道。那个CoVZC45(bat-SL-CoVZC45)是啥?它是2017年发现的一种舟山蝙蝠(类SARS)病毒。为啥要提这个病毒?因为它是SARS-CoV-2(2019-nCoV)最近的亲戚,在进化树上,它和SARS-CoV-2亲缘关系最近。见下图。
CoVZC45和SARS-CoV-2很像吗?它们的相似度是87.5%。也不是很像嘛!我们作个小解剖,比较一下它们各蛋白的一致性:
E蛋白(Envelope包膜蛋白)和非结构蛋白nsp7亚基的一致性是100%,
M蛋白(Membrane膜糖蛋白)一致性是98.6%,
N蛋白(Nucleocapsid核壳蛋白)一致性是94%,
S2蛋白(spike刺突蛋白的后半部分)一致性是95%,
S1蛋白(spike刺突蛋白的前半部分)的一致性为69%。
大家可能注意到了,除S1蛋白外,其它各蛋白的一致性都不低于94%。那么问题来了,为啥偏偏S1蛋白的一致性那么低,只有69%?答案是:SARS-CoV-2的S1蛋白里有那么一段,是从别的病毒“粘”过来的,大大拉低了S1蛋白的一致性。从哪个病毒“粘”过来的,就是SARS-CoV。
说得具体点,把SARS-CoV病毒S1蛋白的RBD区域,“粘”到CoVZC45的相应位置,得到的嵌合病毒,就是中间阶段的SARS-CoV-2。
以CoVZC45和SARS-CoV嵌合得到SARS-CoV-2主干示意图。
实际从SARS-CoV“粘贴”过来的区域,并不恰恰是RBD,而是比RBD要宽一些,不妨称之为扩展RBD。实验室制备SARS-CoV-2过程中,将SARS-CoV的(扩展)RBD“粘贴”至CoVZC45骨架这一异常生硬的非自然步骤,使SARS-CoV-2与CoVZC45二者的序列一致性线图出现了一个长中断。见下图。
NCBI Blast工具生成的SARS-CoV-2与舟山病毒CoVZC45序列一致性dot plot。
图中有非常明显的间断gap,这一间断gap正好对应着“粘贴”自SARS-CoV的扩展RBD。
注:NC_045512是SARS-CoV-2的NCBI refseq,MG772933是CoVZC45的Accession number。
为啥要把SARS-CoV的RBD粘到CoVZC45上去?因为CoVZC45不能感染人,因为要把CoVZC45改造成象SARS-CoV那样的,能感染人的病毒。
为什么有的冠状病毒能感染人,有的却不能?冠状病毒能不能感染人,关键在于,它有没有能打开人体细胞的钥匙。
冠状病毒的钥匙是啥东东?
冠状病毒以其外表“皇冠”状突起而得名,这些突起是由冠状病毒的S蛋白所形成的。S蛋白即spike蛋白,也叫做刺突蛋白或棘突蛋白。下面是一个冠状病毒的示意图。
S蛋白由向外突出的S1蛋白和S1蛋白之下的S2蛋白两部分组成。S1蛋白负责与细胞表面的受体(如ACE2,TMPRSS2,CD4等)结合,如果S1蛋白能够与细胞受体成功结合,那么冠状病毒就能够进入、感染细胞。S1蛋白就是用来打开人体细胞的钥匙。

S1蛋白与ACE2成功结合后,病毒就可以进入细胞。
S1蛋白能否与细胞受体结合,取决于它的空间结构、外部形态、静电极性是否与细胞受体吻合、匹配。大多数冠状病毒的S1蛋白钥匙对人体细胞不好使,CoVZC45也是如此,SARS-CoV是少数有好使的S1蛋白钥匙,能感染人体细胞的冠状病毒之一。
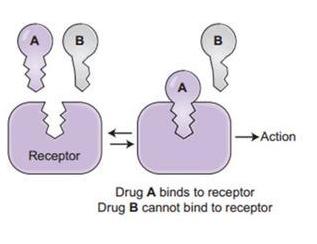
细胞表面的ACE2等受体(Receptor)相当于细胞膜上的锁,病毒的S1蛋白则相当于一把钥匙。S1蛋白中有一个RBD(Receptor
Binding
Domain,受体结合域)区域,负责与细胞受体结合,它相当于钥匙的“钥齿”部位,对S1蛋白能否打开ACE2受体锁具有决定性作用。
下图示意了SARS-CoV-2(2019-nCoV)氨基酸序列,以及RBD在S蛋白氨基酸序列中的位置。
CoVZC45的S1蛋白不能与人体ACE2受体结合,所以舟山蝙蝠病毒不能感染人;SARS-CoV的S1蛋白能够与人体ACE2受体结合,所以非典病毒能够感染人。把SARS-CoV病毒的RBD“粘”到CoVZC45上,替换掉原有的RBD,相当于为CoVZC45重新配了一把对人体细胞好使的钥匙,嵌合病毒有了这把新钥匙,就能与ACE2受体结合了,就能进入、感染人体细胞了,从而,不能感染人的CoVZC45就被改造成了能感染人的新病毒。
注:人体ACE2受体是指血管紧张素转换酶2(Angiotensin Converting Enzyme2)。人体多种细胞都会在其外表产生ACE2,如呼吸道上皮细胞,肺泡AT2细胞,血管内皮细胞,T淋巴细胞等等。存在ACE2的器官或组织包括:人体呼吸道、肺;眼结膜、角膜;心脏;食管、胰腺、肝脏(肝内胆管)、回肠;肾脏、膀胱;睾丸等等。这意味着,上述器官、组织都可能成为新冠病毒的攻击目标。
SARS-CoV-2的RBD与SARS-CoV的RBD具有很高的相似度,因为,SARS-CoV-2的的RBD就是从SARS-CoV“粘”过来的。见下图。
SARS-CoV与SARS-CoV-2(2019-nCov)RBD氨基酸序列比照,红色对应相同的氨基酸(残基),白色对应不同的氨基酸(残基)。
可以看到,虽然相似程度很高,但二者还是存在一些不同的氨基酸,这又是怎么回事呢?因为把SARS-CoV的RBD粘过来之后,还需要对它作进一步的编辑和加工。对RBD或S1蛋白所做的进一步基因编辑,在后续的第2,第3,第5部分还将谈及。
两个相关的科研成果。
成果I。2020年1月30日,中国疾控中心、山东第一医科大学的陆柔剑等研究人员在柳叶刀(The Lancet)上联合发表了一篇题为“Genomic characterization and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding”(2019年新型冠状病毒的基因组表征和流行病学:对病毒起源和受体结合的启示)的论文,论文指出:
a)从9例新冠患者肺泡灌洗液中获得的2019-nCoV基因组序列极其相似,序列同源性达99.98%,表明2019-nCoV在很短的时间内起源于同一个来源,且最近才出现在人群中。
b)2019-nCoV属于冠状病毒β谱系Sarbecovirus亚型,其最接近的亲属是2018(2017、2015)年在中国东部舟山发现的两种蝙蝠相关冠状病毒bat-SL-CoVZC45和bat-SL-CoVZXC21,同源性皆为88%左右;与SARS-CoV的亲缘关系较远,同源性为79%;与MERS-CoV(中东呼吸综合征冠状病毒)亲缘关系更远,同源性仅为50%。
c)虽然与SARS-CoV的亲缘关系较远,但同源性建模显示,2019-nCoV具有与SARS-CoV相似的受体结合域结构,尽管某些关键残基处存在氨基酸差异。
d)新冠病例首次激增的2019年12月下旬,武汉的大多数蝙蝠物种都在冬眠;而且,在疫情爆发之前,华南海鲜市场上并没有出售或发现蝙蝠,但有哺乳动物及其他非水生动物出售。
e)新型冠状病毒与蝙蝠来源的冠状病毒之间的最大序列相似性不足90%(COVZC45和CoVZXC21),这意味着蝙蝠冠状病毒不是新型冠状病毒的直接祖先。
成果I。2020年2月20日,南方医科大学公共卫生学院三级生物安全实验室在南方医科大学学报发表一篇研究论文指出:
a)SARS-CoV-2与bat-SL-CoVZC45 (CoVZC45)和bat-SL-CoVZXC21 (CoVZXC21)较为接近,相似性为87.5%和87.3%;与Bat-CoV-RaTG13(RaTG13)最为接近,相似性为95.9%。
注:RaTG13为世人所知始于2020年1月23日,这一天,石正丽宣布,她的团队早在2013年,就从云南菊头蝠粪便中分析得到了RaTG13(的基因序列,并非得到了病毒的毒株)。
b)SARS-CoV-2与RaTG13的时间进化信号呈负相关,二者不存在时间进化关系;但是,SARS-CoV-2与CoVZC45、SARS-CoV都存在明显的正性时间进化信号,SARS-CoV-2与这二者存在时间进化关系。
c)SARS-CoV-2几乎不可能由RaTG13演化而来(即使它真的存在);SARS-CoV-2有可能演化自CoVZC45或SARS-Cov。
2. 进一步编辑RBD,对其中四个关键氨基酸作同构替换。
前面我们说到,SARS-CoV-2与SARS-CoV二者的RBD相似度很高,但仍有一些不同,这些不同来自进一步的基因编辑。本部分要谈的是一组至为重要的RBD编辑--对RBD四个关键氨基酸所做的同构替换。
RBD中,有五个至关重要的氨基酸(残基),它们在S1蛋白氨基酸序列中序号为第442、472、479、487、491(按照SARS-CoV的S蛋白序列编号),这五个氨基酸处在与细胞受体ACE2的接触面上,是RBD“钥齿”中的关键齿位。在SARS-CoV-2中,来自SARS-CoV~RBD的这五个关键氨基酸中的前四个(序号442、472、479、487)被换掉了,换成了新的氨基酸。

SARS-CoV-2与SARS-CoV,RBD部分氨基酸序列比照,在序号442、472、479、487四个位置上,二者的氨基酸发生了改变。
以上四个氨基酸的改变极不寻常,这体现在:
a) 所替换的四个氨基酸位于RBD的高度保守区域,通常这些氨基酸不会发生改变;
b) 新氨基酸是经过精心选择的,它们与同位置的原有氨基酸的疏水性和静电极性都非常相似;
c) 虽然发生了四个关键氨基酸的改变,但RBD的3-D结构几乎没有变化,替换前后,RBD的空间形态高度同构;
换掉四个关键氨基酸前后,S1蛋白RBD的空间结构、外部形态高度相似。
d) 新、旧RBD与ACE2受体接触时发生的范德华力(一种分子间的电性引力)等静电作用效果也很相似;
e)新RBD与ACE2的结合稳定性可能比原RBD稍差,但仍能与ACE2发生强相互作用;同时,新RBD与ACE2的结合亲和力大大提高。
这意味着,SARS-CoV-2又精妙“进化”出了一副更好用的能感染人的蛋白钥匙。
SARS-CoV-2仿佛在向人类宣告,它已经克服了自然进化的随机性、盲目性,它已经具备了高度智能的,定向、明确且精准的进化能力;它在“自然进化”过程中“巧夺天工”的优异表现,不逊色于任何一位遗传学、生物学、病理学大师,它称得上是一位跨学科的学术界集大成者。关于SARS-CoV-2的神奇现在刚刚开头,在本文后续内容中,SARS-CoV-2还将反复展示它“自然进化”过程的非凡伟大。
2020年1月21日,来自中国科学院上海巴斯德研究所等单位的徐心恬、陈萍、王靖方等学者在SCIENCE
CHINA Life
Sciences(《中国科学:生命科学》)上发表了一篇论文,题为“源于武汉爆发的新型冠状病毒的进化及其棘突蛋白对人类传播风险的建模”(Evolution
of the novel coronavirus from the ongoing Wuhan outbreak and modeling
of its spike protein for risk of human transmission)。论文指出:
a)尽管新冠与SARS-CoV二者S蛋白的总体同源性较低,但二者的RBD区域却有较高的同源性;
b)令我们惊讶的是,尽管替换了五个重要的界面氨基酸残基中的四个,但新冠仍与人体ACE2有着显著的结合亲和力;
c)进一步观察发现,新冠的S蛋白和SARS-CoV的S蛋白在RBD域具有几乎相同的三维结构,在相互作用界面上保持了相似的范德华力和静电性质。
2020年2月19日,美国德克萨斯大学奥斯汀分校Jason
S McLellan团队,及国家过敏和传染病研究所的研究人员在Science杂志上联合发表了题为“Cryo-EM Structure of
the 2019-nCoV Spike in the Prefusion Conformation”的论文。论文指出:
a) 2019-nCoV与SARS-CoV的RBD存在一定的构象差异,但当按某一角度对齐时,二者就呈现出较高程度的结构同源性。
b) 两种病毒的S1蛋白与ACE2的复合体非常相似;
c) 2019-nCoV的S1蛋白与ACE2的结合亲和力是SARS的10-20倍。
2020年5月17日,澳大利亚弗林德斯大学的一个科学家小组指出:SARS-CoV-2的S蛋白与人体ACE2的结合力,强过其与蝙蝠等可能的原始宿主或中间宿主动物ACE2的结合力,他们认为,这违反了病毒与新宿主的初始亲和力应低于原宿主的常识。
对他们的研究结果可作出一个引申:SARS-CoV-2不象是来自动物,它更象是专门为人类量身定制的。
对RBD作保守编辑还有以下作用:
a) 淡化RBD嵌合痕迹,模糊SARS-CoV-2与SARS-CoV二者的RBD渊源;
b) RBD四个关键氨基酸的改变,使通常的针对SARS-CoV的RBD抗体药物,对SARS-CoV-2失效。
RBD的蛋白可替代研究在几年前就开始了,SARS-CoV-2中的RBD同构替换是对多年积累的研究成果的一次实用。
3. 继续编辑S1蛋白,插入来自HIV-1的表面糖蛋白gp120和Gag蛋白
插入这两种蛋白的目的,是赋予SARS-CoV-2感染T淋巴细胞,破坏人体免疫系统的能力。
2020年1月27日,印度理工学院(Indian
Institute of Technology)的普拉丹(Pradhan)教授,昆杜(Bishwajit
Kundu)教授等学者在生物预印本网站bioRxiv发表了那篇引起纷争的论文:《2019-nCoV棘突蛋白中独特插入片段与HIV-1的gp120(蛋白)和Gag(蛋白)的异常相似性》(Uncanny
similarity of unique inserts in the 2019-nCoV spike protein to HIV-1
gp120 and Gag)。论文要点如下:
a)
SARS-CoV-2的棘突糖蛋白(S蛋白)中有4个插入片段(氨基酸序列位置:404—409,462—467,136—150,366—384,皆位于S1蛋白内),这4个插入片段中的氨基酸(残基),均与HIV-1(艾滋病病毒)的gp120蛋白(前三个插入片断)或Gag蛋白(第四个插入片断)相同或相似;
b)上述插入片断在自然界中不太可能偶然发生,因为在SARS等其它冠状病毒的S蛋白中,都没有发现这种插入片段,病毒不太可能在短时间内自然地获得这种非常独特的插入片段;
c)gp120蛋白帮助HIV-1与另一种人类受体CD4结合,Gag蛋白也有帮助HIV-1与某些宿主细胞结合的作用。CD4受体通常附着在某些T淋巴细胞的表面,与其所附着的T淋巴细胞合称CD4+T淋巴细胞,是人体免疫系统的重要部分。HIV-1可通过CD4感染T淋巴细胞,破坏人体免疫系统。
d)在S蛋白中插入gp120蛋白与Gag蛋白后,SARS-CoV-2将可能获得与HIV-1类似的能力:感染、杀死CD4+T淋巴细胞,破坏人体免疫系统。
2020年1月24日,武汉市金银潭医院副院长黄朝林教授等人在《柳叶刀》上发表了一篇论文,题为:《中国武汉市2019年新型冠状病毒感染患者的临床特征》(Clinical
features of patients infected with 2019 novel coronavirus in Wuhan,
China)。论文中指出:在所观察的41名新冠早期患者中,63%的患者(26名)出现了淋巴细胞减少症状。
2月4日,武汉大学中南医院重症医学科主任彭志勇在接受财新记者采访时说:“新冠病毒最大的危害是攻击人的免疫系统,导致淋巴细胞下降。。。有很多病人的免疫力下降。。。如果病人淋巴细胞指数一直往下掉,那就很危险,最终病毒会不断繁殖,把病人的免疫系统彻底摧毁,那就很难抢救了。”
彭志勇还说:很多危重症病人是因为呼吸衰竭憋死的。也有很多病人的免疫力系统下降,导致多器官并发症,多器官衰竭而死。“我在临床上观察到三分之一的重症患者会出现全身炎症反应,导致多器官功能衰竭,发展成危重症,在某些病人身上,这个过程非常快,两三天就病危。”
援鄂专家,北京宣武医院重症医学科主任姜利说,新冠肺炎的共性,除了缺氧导致的心肌损伤,还有就是淋巴细胞绝对值会特别低,这是因为病毒攻击了人的免疫系统。。。
中国《新型冠状病毒肺炎诊疗方案》将“淋巴细胞计数减少”作为重症患者的重要识别特征之一。
以上证据证明,SARS-CoV-2确实有感染并杀死淋巴细胞,破坏人体免疫系统的能力。这种能力,可能来自或部分来自模仿HIV-1插入的gp120蛋白和Gag蛋白,如印度学者所指出的那样。一些抗HIV-1药物(如洛匹那韦/利托那韦)对SARS-CoV-2的疗效也侧证了印度学者的发现。
SARS-CoV中没有HIV-1来源的gp120蛋白和Gag蛋白,在其他任何冠状病毒中也都未发现这两种蛋白,也就是说,唯一含有gp120蛋白和Gag蛋白的冠状病毒,就是SARS-CoV-2。
SAR-CoV不能感染淋巴细胞,不具备破坏人体免疫系统的能力。
4. SARS-CoV-2在S1、S2蛋白交界处,精准“进化”出了Furin酶切位点
SARS-CoV-2中有一个恰位于S1、S2蛋白交界处的酶切位点,下图中的五角星就代表这个酶切位点。

SARS-CoV-2属于β谱系冠状病毒。几乎所有β谱系冠状病毒都没有酶切位点,包括SAR-CoV与舟山蝙蝠病毒CoVZC45。SARS-CoV-2的神奇之处在于,它不仅“进化”出了酶切位点,而且,在近3万个碱基对位置中,它恰恰就在S1、S2蛋白交界处,在S蛋白的“关节”上进化出了酶切位点!
这个酶切位点是个什么东东?原来,在SARS-CoV-2的S1、S2蛋白交界处,相比其它冠状病毒多了四个氨基酸(残基)“PRRA”,其中的“RRA”,与原序列中紧邻的“R”连在一起,组合成“RRAR”。这四个氨基酸组合“RRAR”就是酶切位点标志,它符合Furin酶切位点的识别模式“RXXR”。
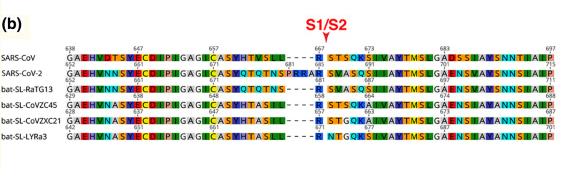
上图第二行是SARS-CoV-2的氨基酸序列,第一行是SARS-CoV的氨基酸序列,第四行是舟山蝙蝠病毒CoVZC45的氨基酸序列。可以看到,第二行序列的S1/S2位置处插入了“PRRA”。
下面这两个图可以看得更清楚一些。


酶切位点,或者说那四个氨基酸组合,有啥用啊?
酶切位点“RRAR”可以被人类的弗林(furin)蛋白酶或其他蛋白酶识别,这些蛋白酶可以自酶切位置对S蛋白进行切割,使S蛋白的S1亚基与S2亚基分离。S1蛋白被切割脱落后,其后的S2蛋白和病毒包膜将得以与人体细胞膜直接接触,二膜之间将发生“膜融合”,“膜融合”之后,包膜内的病毒RNA将第一时间被释放入人体细胞,病毒RNA将在人体细胞内立即开始自我复制、转录,合成蛋白酶及蛋白质,组装新病毒。
SARS-CoV-2与细胞膜发生“膜融合”后,病毒RNA将被第一时间释放到细胞内。
没有酶切位点的病毒又是什么情况呢?
SARS-CoV没有酶切位点,所以它不支持“膜融合”的感染方式。SARS-CoV感染细胞时,是通过一种“胞吞”的方式连皮带核地被整个“吞”入细胞,虽然病毒已经进入到细胞内,但由于病毒RNA还被困在病毒包膜内,所以RNA复制、组装新病毒的过程就被延缓了。SARS-CoV感染细胞的具体过程如下:
S1蛋白与人体细胞受体ACE2结合==>病毒被整个“胞吞”(囫囵吞枣)入人体细胞==>病毒的S1、S2蛋白,包膜蛋白在细胞内被蛋白酶分解、溶化==>病毒RNA被释放出来==>RNA复制、转录,合成蛋白酶及蛋白质,组装新病毒。
SARS-CoV“胞吞”与SARS-CoV-2“膜融合”对照图
不难理解,SARS-CoV-2的“膜融合”感染方式,比SARS-CoV的“胞吞”感染方式,效率要高。
酶切位点是SARS-CoV-2一项非凡的“自我结构优化”,它带来了病毒功能的多项强化,其中一项是:酶切位点使SARS-CoV-2的感染力、致病力、扩散力远远超过SARS-CoV。
2020年2月4日,南开大学高山、阮吉寿等在中国预印本论文平台ChinaXiv发表了一篇题为《武汉2019冠状病毒S蛋白可能存在Furin蛋白酶切位点》的论文,论文指出:
a)此前发现的所有SARS和SARS样(SARS-like)冠状病毒都不具备新冠病毒(SARS-CoV-2)的酶切位点;
b)酶切位点增强了新冠病毒的感染、传播能力。论文估算,2019-nCoV(即SARS-CoV-2)的侵染效率是SARS-CoV的约100到1000倍。
酶切位点在β谱系冠状病毒中极为罕见,(在SARS-CoV-2出现之前)唯一具有酶切位点的β谱系冠状病毒是鼠肝炎冠状病毒;同时,所有与SARS-CoV-2刺突蛋白(S蛋白)相似度大于40%的病毒都没有酶切位点。因此,SARS-CoV-2是在毫无积累,无可借鉴吸纳,一穷二白的情况下,白手起家,无师自通,神迹般地“进化”出了酶切位点。
经估算,一百年内,舟山蝙蝠病毒CoVZC45(与SARS-CoV-2亲缘关系最近)恰在S1、S2蛋白交界处自然变异出酶切位点“RRAR”“的几率小于10的负10次方!参见“估算舟山蝙蝠Vir一千年内进化出酶切位点的几率”一文。
在S1蛋白、S2蛋白交界处变异出furin酶切位点,再次展现了横空出世,来历不明的SARS-CoV-2不可思议的“自然变异”目的性、精准性、高智能性。
病毒界具有酶切位点的病毒,最著名的当属两种非冠状病毒HIV-1(艾滋病病毒)和埃博拉病毒。具有酶切位点,是这两种病毒非常强大的重要原因。对这两种与它既无纠葛、又无渊源的病毒,SARS-CoV-2仿佛早有研究,仿佛深知酶切位点在HIV-1、埃博拉致病机理中的巨大作用,它好象无法抑制“进化”出酶切位点的强烈冲动。
HIV-1、埃博拉病毒破坏人体免疫系统的能力与酶切位点有关,酶切位点也赋予了SARS-CoV-2类似能力。机理是,当与T(淋巴)细胞(人体的主要免疫细胞)接触时,SARS-CoV-2能够借助高效的膜融合,侵入,并且摧毁T细胞,从而创伤、破坏人体免疫系统。“膜融合”之所以能够发生,就在于SARS-CoV-2恰在S1/S2处有一个酶切位点。
2020年4月7日,上海复旦大学研究组和纽约血液中心研究员姜世勃在论文医学专刊《细胞分子免疫学》联合发表论文指出:
SARS-CoV-2会破坏免疫系统,使患者无法抵抗感染;
当SARS-CoV-2和T细胞相互接触时,SARS-CoV-2将通过病毒膜和细胞膜的附着,将自己的RNA基因输入T细胞,导致T细胞毁坏;
与HIV不同的是,SARS-CoV-2可能和T细胞一起死亡,进入T细胞的SARS-CoV-2不会扩散到T细胞外。
至此,SARS-CoV-2已经拥有了两套破坏免疫系统的机制。一是S蛋白中HIV-1来源(或相似)的gp120蛋白和Gag蛋白所赋予的,通过T细胞表面的CD4受体实现对T细胞感染的破坏机制;二是酶切位点-膜融合特性赋予的破坏机制,在这种情况下,SARS-CoV-2感染T细胞的媒介可能是T细胞表面的少量ACE2受体。
当人体免疫系统的T细胞、B细胞的表面受体(CD4或ACE2)与病毒(或抗原)结合时,可能触发免疫系统过度应答,持续生成大量淋巴细胞、巨噬细胞,相关细胞还将分泌出大量细胞因子(信号蛋白)和体液,引发“细胞因子风暴”,这可能导致全身性炎症反应、多器官衰竭、高铁血红蛋白血症、急性呼吸窘迫综合征等症状,对人体器官和组织造成重大损害,甚至使患者死亡。
临床发现,Covid-19病人的病情常常突然加重、恶化,轻症、普通病人也会突然变为重症,其原因(之一),很可能就在于SARS-CoV-2造成的免疫系统破坏和功能异常,及在特定情况下触发过度免疫反应-细胞因子风暴。 SARS-CoV没有酶切位点,它无法以“膜融合”方式感染T(淋巴)细胞。SARS-CoV不破坏人体免疫系统。
5. SARS-CoV-2的S蛋白中有一个独特的O-Linked聚糖结构,使病毒可逃避免疫打击
SARS-CoV-2的O-Linked聚糖结构怎么来的呢?S蛋白氨基酸序列678位置上(S1蛋白的倒数第三个氨基酸)原来应是一个丝氨酸(S),只要把这个丝氨酸(S)换成苏氨酸(T),那么678位置上新的苏氨酸(T),与673、687位置上的两个丝氨酸(S)就形成了O-连接型聚糖结构(O-linked
glycans)。参见下图。
SARS-CoV-2酶切位点周围的一个苏氨酸(T),二个丝氨酸(S)形成一个O-Linked聚糖结构。
S蛋白上的O-Linked聚糖结构能够和人体细胞表面的蛋白质相互作用,产生一个“粘蛋白样结构域”,“粘蛋白样结构域”可充当SARS-CoV-2逃避人体免疫系统打击的糖链屏障。籍着这一屏障,SARS-CoV-2可以
a) 隐蔽、持续地在人体内潜伏、复制,大大延缓了人体免疫反应;
b)借助超长的潜伏期,及免疫逃避能力,几乎无所不至地向各个器官扩散;
c)获得了强悍的人体内适应生存能力,难以被人体彻底清除或根除。
现在,SARS-CoV-2已经拥有了破坏人体免疫系统和逃避人体免疫系统打击的双重能力,其生存力和致病力都极大地强化了。
SARS-CoV和CoVZC45都没有O-Linked聚糖结构,在β谱系冠状病毒中,有O-Linked聚糖结构的只有SARS-CoV-2。你能不再度惊叹于SARS-CoV-2的独具匠心,卓尔不群么?!
O-连接型聚糖结构是从哪来的呢?是偷师埃博拉病毒山寨来的。
2020年2月16日,所谓的“病毒猎手”,美国哥伦比亚大学公共卫生学院感染与免疫中心主任伊恩·利普金(W.Ian
Lipkin),美国斯克里普斯研究所免疫学和微生物学副教授Kristian
Andersen博士(通讯作者)等五位学者在virological.org上发表一篇题为“The Proximal Origin of
SARS-CoV-2”的论文,3月18日,该论文又发表在《Nature
Medicine》杂志上。论文称:“SARS-CoV-2不会是实验室工程制造而泄漏的病毒,而应该是病毒自然进化的产物。”。他们的理由之一是:
“即使的确存在一个不为科学界所知的病毒模板,(可)在其基础上,通过长期细胞培养的方式逐步得到提高受体结合亲和力的氨基酸突变的病毒,然而这个O-linked的聚糖结构不可能通过体外细胞培养的方式获得,因为这种突变通常需要机体免疫系统的参与才能产生。”
这几位大学者的装B水平,和他们的身份很般配,其偷换问题的下流手法也能把不少人搞晕。问问这几位权威,如果有人说,你到过杀人现场,那么你的反驳是什么?是“我根本没去过杀人现场”,还是“我根本没骑自行车去杀人现场”。
得到O-linked聚糖结构,非得用培养基础病毒诱发其突变的套路吗?你们真的没想到,用基因剪刀把678位置上的丝氨酸(S)换成苏氨酸(T),就能得到O-linked聚糖结构吗?这样的事,你们平时干得很少吗?


6. 在N蛋白基因编码内插入了nsp3A编码,以进一步完善免疫逃避能力。
非结构蛋白(NonStructural
Prtein,nsp),是指在病毒RNA中存在基因编码信息,但不被组装入病毒体,不作为病毒蛋白结构一部分出现的蛋白。冠状病毒的非结构蛋白,在病毒复制过程中,由病毒编码的两条超长复制酶多肽pp1a/pp1ab水解产生,共有15或16个,它们参与调节病毒基因组RNA的复制和亚基因组RNA(主RNA生成的许多小RNA)的转录,参与其它蛋白的生成,参与病毒体组装,并影响病毒特性。相对于非结构蛋白,既在病毒RNA中存在基因编码信息,同时又被组装入为病毒体,作为病毒蛋白结构的一部分的蛋白,叫做结构蛋白。
SARS-CoV-2 RNA基因组的近3万个碱基对,共转录27种蛋白质(一说29种):4种结构蛋白,15种非结构蛋白(nsp),8种辅助蛋白。四种结构蛋白前文都已提到过:S蛋白(刺突蛋白),M蛋白(膜糖蛋白),N蛋白(核壳蛋白),E蛋白(包膜蛋白);SARS-CoV-2共编码15种nsp,具体为nsp1至nsp10和nsp12至nsp16(图1A),例如:将其他非结构蛋白从两条蛋白酶长链上“切割”出来的3C蛋白水解蛋白酶nsp5;在病毒复制和转录周期中发挥重要作用的nsp7、nsp8和nsp12;可能参与干扰宿主信号传递,降低宿主的免疫反应的nsp2;SARS-CoV-2编码的8种辅助蛋白是:3a、3b、p6、7a、7b、8b、9b和orf14。
nsp3A(非结构蛋白3A,或辅助蛋白3a)是一个膜结合蛋白,它能够在病毒感染过程中抑制宿主细胞的蛋白分泌,并抑制所分泌的蛋白从内质网(连接细胞核、细胞质、细胞膜的扁囊状或细管状隧道系统)至高尔基体(可理解成进出细胞的脂类、蛋白质接受检查和处理的中转站)的顺序转运,从而降低细胞分泌的干扰素-β(interferon-β,纤维母细胞分泌的可干扰病毒复制,破坏病毒RNA,摧毁未完成的病毒蛋白的人类糖蛋白)、IL-6(白细胞介素-6,在细胞间传递信号的细胞因子之一,有诱发急性期蛋白、参与造血、分化、引发炎症等作用)、IL-8(白细胞介素-8,另一种传递信号的细胞因子,可参与细胞免疫,调节炎症反应,趋化并激活中性粒细胞, 促进中性粒细胞的溶酶体酶活性和吞噬作用)和被感染细胞膜上的MHC-I抗原和 TNF受体的表达。
将nsp3A编码入核衣壳蛋白(N蛋白,Nucleocapsid蛋白)可产生有以下功效:
a) 使SARS-CoV-2能够抑制、干扰人体免疫反应,使免疫反应延迟或减弱,或者延迟后过度反应,引发“细胞因子风暴”,重创人体。这可能是Covid-19病人病情常常突然加重、恶化,以及轻症、普通病人会突然变为重症的原因之一。
b)使N蛋白具备VSR(RNAi抑制子)活性,可有效对抗和反抑制由shRNAs(短发夹RNA)或siRNAs(小分子干扰RNA)触发的RNAi(RNA干扰);
c)进而使SARS-CoV-2能够对抗、反制RNA干扰药物,使通过干扰、抑制病毒RNA来促使病毒降解的RNAi免疫疗法不能达到预期效果。
nsp3A的引入,使SARS-CoV-2获得了第二条免疫逃避途径。
2017年6月21日,中国科学院武汉病毒研究所研究员周溪课题组与军事医学科学院微生物流行病研究所研究员秦成峰课题组合作,在抗病毒免疫研究方面取得新进展,揭示了RNA干扰(RNAi)通路在哺乳动物中具有抗病毒免疫功能。相关研究成果以Human virus-derived small RNAs can confer antiviral immunity in mammals(《人类病毒来源的小RNA在哺乳动物中产生抗病毒免疫反应》)为题发表在Immunity上。
在该研究中,研究者利用人肠道病毒71型(EV71)感染的人类体细胞及小鼠为模型,发现其非结构蛋白3A具有RNAi抑制子(VSR)功能。3A能够通过与病毒dsRNA结合来阻止Dicer对其剪切,抑制vsiRNAs的产生。
该研究在人类体细胞及动物水平发现了病毒感染可以产生具抗病毒功能的vsiRNA,确证了RNAi在哺乳动物中是一条抗病毒天然免疫通路;同时,也揭示了一种人类病毒逃逸RNAi天然免疫的具体机制。
2020年02月22日,中国科学院武汉病毒研究所病毒学国家重点实验室周溪教授及其团队发表论文“2019新型冠状病毒核衣壳蛋白N能发挥病毒编码的RNAi抑制子功能”,指出:SARS-CoV-2编码的核衣壳蛋白(N)有效地抑制了shRNAs或siRNAs触发的RNAi;SARS-CoV-2的N蛋白在人类细胞中表现出VSR活性,这可能是新型冠状病毒的一个关键免疫逃避因子。
gp120蛋白+Gag蛋白,酶切位点,O-Linked聚糖结构,nsp3A,SARS-CoV-2为自己设计了全方位的抗免疫、破免疫能力,集四大抗免疫、破免疫利器于一身。如此完善的“自然进化”结果不令你震撼吗?你能想象,兼具顶级病理学家专业水准和高素养科研人员细致周密的,居然是一个冠状病毒吗?
小结
简单小结一下SARS-CoV-2的伟大进化过程:
1)进化出了能感染人的S1蛋白钥匙;
2)进化出了优化的,有10-20倍ACE2结合亲和力的新钥匙;
3)刚刚感染人,就进化出了与HIV-1极为相似的两种蛋白,具备了感染、杀死CD4+T淋巴细胞,破坏人体免疫系统的能力;
4)恰恰在三万个碱基对中的S1/S2交界处,进化出了威力强大的酶切位点,不仅感染力、致病力、扩散力极大增强,还获得了第二种破坏人体免疫功能的机制;
5)在S蛋白中进化出了O-Linked聚糖结构,得以获得逃避人体免疫打击的糖链屏障;
6)在N蛋白中进化出了非结构蛋白3A,能够干扰、抑制人体免疫反应,对抗、反制RNI干扰,进一步完善了免疫逃避能力;
生物的变异、进化本是个非常漫长的过程,然而,上述多项极为特别、罕见的变异,却全都在极短的时间内,不可思议地极速“进化”完成了,而且一步到位。次相似的CoVZXC21是2015年发现的,最相似的CoVZC45是2017年初发现的,仅仅到了2019年底,新冠SARS-CoV-2便横空出世了!迄今为止,没有发现任何实证存在的,具有以上任何一种变异特征的过渡病毒!(用来掩饰真相,反而不打自招的编造病毒倒是有几个)。
新冠君,你的进化速度远胜风驰电掣,你从不担心自己自然进化的步子迈得太大太猛太不自然,因为你没有蛋,步子迈得再大再猛再不自然,也扯不着蛋。
新冠君,在自然进化过程中,你多次模仿了HIV-1和埃博拉病毒的结构、机制,你是在向两位著名异族前辈致敬么?
新冠君,你是最与众不同,最出类拔萃的毒物。别的病毒,取得以上任何一项重要变异都要经过漫长岁月的洗礼。你初出茅庐,刚刚开始感染人类,就自然变异出这么多你的远近亲戚闻所未闻,让人类眼花缭乱、目瞪口呆、吃尽苦头、束手无策的神奇结构,病毒界古往今来所有的佼佼者,都对你顶礼膜拜,奉你为前无古人,后无来者的集大成者,你是万年不遇的天才,千载难逢的科学泰斗,你是最能无中生有的魔术大师!
新冠君,你的进化之路,处处神迹,你是上帝,抑或撒旦的化身么??
---
说谎、造假、缄默,掩饰、遮蔽、压制,就能把所有世人一直蒙在鼓里吗?
(正文完)
关于新冠起源,我的相关文章:
新冠病毒是人为故意投放的
新冠君,你额头的Lab金印怎么洗
深入分析Lyons-Weiler“新冠来自实验室”一说
实验室合成、编辑SARS-CoV-2简明教程
sars-cov-2(新冠)是实验室生成的
估算舟山蝙蝠Vir一千年内进化出酶切位点的几率
covid-19的零号病人可能不是一个人
人类命运共同体,新冠起源(上)
人类命运共同体,新冠起源(下)
其它新冠疫情相关的文章:
武汉新冠病亡人数估算
武汉新冠病例数推算
新冠中国病亡人数的简单估算
真实的谎言:从不明原因肺炎到新冠(上)
真实的谎言:从不明原因肺炎到新冠(中)
真实的谎言:从不明原因肺炎到新冠(下)
真实的谎言:从不明原因肺炎到新冠(续一)
























