補註:已完成本文的改進版本:“新冠RBD5個關鍵氨基酸抄襲、修改自rs3367”。改進版本對本文作了結論明確化、敘述簡明化,它與本文並不衝突,但其結論價值及細節描述的準確性、嚴謹性皆高於本文。推薦您優先閱讀改進版本。
本文完整標題:新冠刺突蛋白受體結合域決定感染人類能力的五個關鍵氨基酸是實驗室定向選擇的結果。
寫作本文的目的是指出如下發現、事實或判斷:
1。rs3367、rsSHC014、CoVZC45、Sars-Cov是四個與新冠(SARS-CoV-2)來源相關的重要冠狀病毒。
2。新冠刺突蛋白受體結合域決定感染人類能力的五個關鍵氨基酸(殘基)與rs3367、rsSHC014、Sars-Cov的對應關鍵氨基酸(殘基)存在清晰的參照關係。
3。新冠五個關鍵氨基酸中,
第五個與Sars-Cov、rs3367及CoVZC45對應位置處的氨基酸相同,為酪氨酸Y;
第四個與rs3367對應位置處的氨基酸相同,為天門冬酰胺N;
第二個亦與rs3367對應位置處的氨基酸相同,為苯丙胺酸F;
第三個關鍵氨基酸是麩酰胺酸Q,它雖然與另外四個病毒對應位置處氨基酸都不相同,但rsSHC014的第三個關鍵氨基酸是精胺酸R,麩酰胺酸Q與精胺酸R是經常發生相向變異、相互替代的相關氨基酸;
第一個關鍵氨基酸是亮氨酸L(白氨酸),它也與另外四個病毒對應位置處氨基酸都不相同,但它與這些對應位置處氨基酸的電場、電離性質接近,五個病毒的第一個關鍵氨基酸要麼是電荷分布均勻的非極性氨基酸,要麼是不帶電荷的極性氨基酸。
4。新冠的五個關鍵氨基酸中,有三個與rs3367的對應氨基酸相同,即新冠與rs3367的第五、第四、第二關鍵氨基酸相同。這樣的重複度,無法用自然、偶然二字來解釋。新冠的五個關鍵氨基酸,可能是基於rs3367的五個關鍵氨基酸,替換掉第三、第一個關鍵氨基酸之後得到的。
5。在五個關鍵位置上,新冠與Sars-Cov的對應氨基酸只在第五個位置上相同,在其它四個位置上兩者的氨基酸都不相同,但援引相關論文,這四對相異氨基酸每一對的疏水性和靜電極性都非常相似;
6。援引相關論文,新冠和Sars-Cov雖然有四個關鍵氨基酸的不同,但兩者RBD(受體結合域)的3-D結構幾乎沒有明顯差異,或者說,兩者RBD的空間形態高度同構;而且,在與人類受體的接觸界面上,兩個RBD結構體的范德華力(一種分子間的電性引力)和靜電作用效果非常相似;
7。基於第5點,新冠與SARS一樣,也能與人類細胞受體ACE2發生強相互作用並良好結合,從而具有不亞於SARS的人體細胞感染能力。
8。新冠刺突蛋白RBD決定人類感染能力的五個關鍵氨基酸不是隨機突變、無目的進化產生的,它們是基於明確的設計目標,參照、借鑑、復用特定病毒的關鍵氨基酸,人為確定的。用於新冠設計、改造的兩個參照病毒rs3367、rsSHC014,都是罕見的具備跨物種傳播能力,並可感染人體細胞的非常特殊的冠狀病毒。
我要衷心感謝所有關注本文,參與討論,指出文中錯誤、不當,予我批評、建議的讀者朋友們。
同時,我也非常非常希望,科學、學術界的同仁、朋友們,能夠注意到本文,對上述發現、事實、判斷進行核查、確認、肯定或予以批駁、指錯、糾正,以利于澄清真相,或在此基礎上展開更深入的研究。
接下來,我們從一對姐妹病毒說起吧。
姐妹病毒:CoVZC45、CoVZXC21是已知的與新冠病毒(SARS-CoV-2)血緣關係最接近的兩個冠狀病毒。類SARS冠狀病毒CoVZC45,2017年2月分離自舟山蝙蝠,基因序列2018年1月上傳至國際基因庫,全名為bat-SL-CoVZC45,GenBank
ID為:MG772933.1。它的姐姐類SARS冠狀病毒CoVZXC21,2015年7月分離自舟山蝙蝠,與妹妹CoVZC45同一天上傳至國際基因庫,全名是bat-SL-CoVZXC21。
CoVZC45與新冠(SARS-CoV-2)基因組(基因序列)的相似度是87.5%(我用Blast比照的結果是89.12%),CoVZXC21與SARS-CoV-2的相似度是87.3%。這對姐妹彼此的相似度是97.48%。在絕大多數情況下,有關CoVZC45的內容同樣適用於CoVZXC21。
相比之下,SARS-CoV(非典、薩斯)與SARS-CoV-2的相似度只有78.7%,比姐妹病毒低近10個百分點。
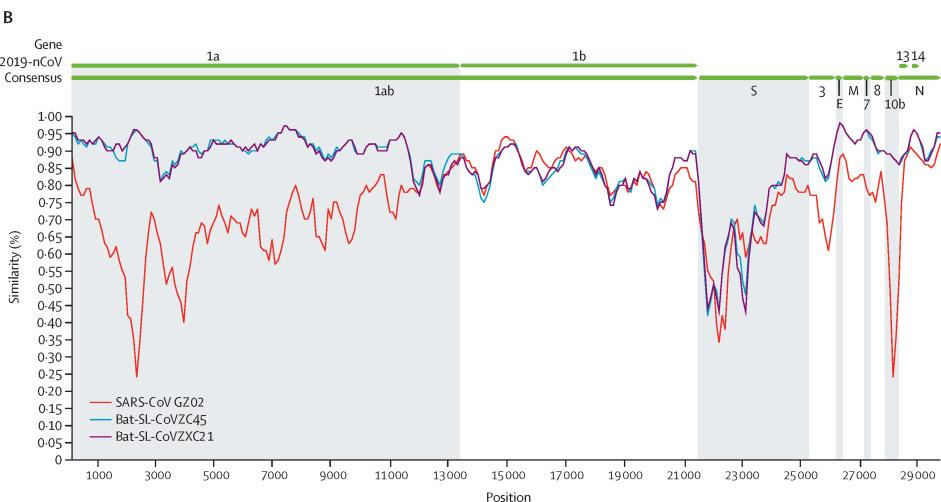
Sars-Cov(紅)、CoVZC45(藍)、CoVZXC21(紫)與Sars-Cov-2(2019-nCov)基因序列一致性對照圖
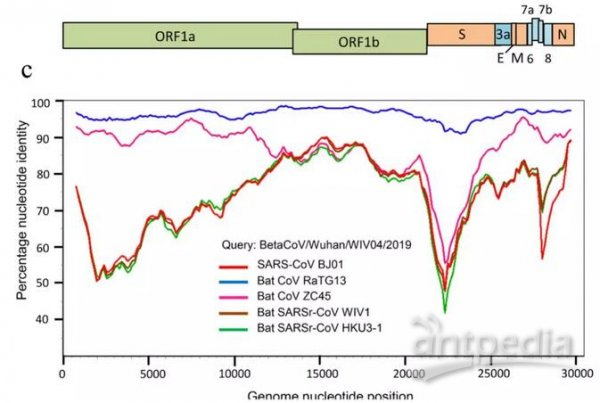
RaTG13、Sars-Cov、CoVZC45、WIV1等冠狀病毒與Sars-Cov-2(2019-nCov)基因序列一致性對照圖。2019-nCov是新冠的早期命名。
最近媒體頻頻提起的RaTG13不是新冠的近親。RaTG13與SARS-CoV-2相似度雖然高達96.2%,但它只有基因序列,沒有病毒毒株實證,它的基因序列是所謂“分析得出”的,很可能就是人為“創作”出來的,它沒有嚴肅的證據價值和學術討論價值;而且,就算它真實存在,它與新冠也沒有時間進化關係,新冠不可能由它進化而來。關於RaTG13與新冠的進化無關性,南方醫科大學2020年2月20日的論文“新型冠狀病毒SARS-CoV-2的變異和進化分析”已經給出了明確說明。該論文的一個地址:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7086142/
如果新冠是自然進化產生的,它最可能是由CoVZC45或它的姐姐進化而來的,這也是新冠進化最近、最快捷的途徑。但是這對姐妹病毒與新冠之間,仍然橫着一道進化的天塹。觀察前面兩個插圖,可以注意到,除RaTG13外,圖中其它病毒與新冠在S蛋白位置都存在着鴻溝般的巨大(一致性)落差。姐妹病毒要進化為新冠,就必然完成諸多特定突變,消除它們與新冠在S蛋白上的顯著差異。CoVZC45與新冠其它蛋白的相似度都不低於94%,但二者S1蛋白(S蛋白的前半部分)的相似度卻猛降為69%。這決定了從CoVZC45到新冠的“演變”,是一個極不均衡、極為罕見、非常非常不自然的“自然進化”過程。而且,這一“自然進化”過程,居然只用了幾年的時間就完成了(如果從姐妹病毒被發現的前後算起)。
自然界的冠狀病毒約有一百種,絕大多數天然冠狀病毒不能進入人體細胞,無法感染人類。大自然設置了冠狀病毒的傳播屏障:將S1蛋白決定宿主感染能力的重要部位設置為高度保守區域,這些部位的氨基酸通常不會發生突變。S1蛋白重要部位的穩定性使絕大多數冠狀病毒在漫長的歲月里始終無法跨越S1蛋白的進化天塹,只能感染固定的動物宿主,難以跨物種傳播,感染人類。
冠狀病毒能否進入宿主細胞,感染宿主,取決於它有沒有打開宿主細胞的“鑰匙”。如果有匹配的細胞鑰匙,它就能與宿主細胞表面的相關受體(相當於細胞鎖)結合,繼而進入宿主細胞。冠狀病毒的細胞鑰匙就是它的S蛋白,即Spike蛋白,也叫刺突蛋白。刺突蛋白包括相連的兩個部分(兩個亞基),最外部的是S1蛋白,S1蛋白與病毒包膜之間的是S2蛋白。S2蛋白也叫膜融合亞基(參與新冠病毒與細胞的膜融合),它相當於鑰匙的手柄部分,S1蛋白是受體結合亞基,負責與細胞表面的受體結合,它相當於鑰匙的齒面部分。S1蛋白中有一個區域叫做受體結合域(Receptor Binding Domain),簡稱RBD,是S1蛋白與細胞受體發生接觸的部分,RBD就相當於齒面外側的鑰齒部位。RBD中有14個氨基酸與宿主細胞受體ACE2發生直接接觸,這14個氨基酸中,有五個是至關重要的,它們決定刺突蛋白能否與ACE2結合,這五個關鍵氨基酸就是冠狀病毒打開宿主細胞的關鍵鑰齒。
註:ACE2,即Angiotensin Converting Enzyme2,血管緊張素轉換酶2,是細胞表面的一個膜蛋白,廣泛存在於脊椎動物的呼吸、消化、血液、泌尿、生殖、視覺等系統的器官、組織內。ACE2可介導與之發生結合的病毒進入它所附着的細胞內部。ACE2也是腎素-血管緊張素系統(RAS)中的一個關鍵酶;hACE2,即human ACE2,人體細胞ACE2受體。
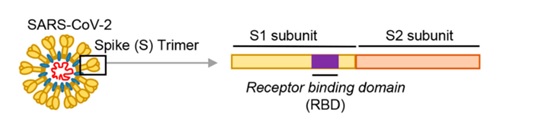
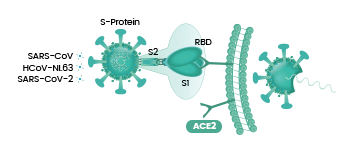
S1蛋白與宿主細胞受體(如ACE2)結合成功後,病毒可進而通過“胞吞”(如Sars-Cov)或“膜融合”(如Sars-Cov-2)兩種方式之一進入宿主細胞。
可感染人類,並產生疾病症狀的冠狀病毒已知有7種,其中包括SARS(Sars-Cov)和新冠(Sars-Cov-2)。除這7種病毒外,還有兩個很特別的冠狀病毒:rsSHC014和rs3367,它們也能與hACE2(人體細胞ACE2)結合,進入人體細胞,但不會使人發病,且對人體無害。
RsSHC014,也稱作SHC014-Cov或SHC014病毒,GenBank ID為: KC881005.1。
rs3367,也叫WIV1病毒(SL-CoV-WIV1),GenBank ID為: KC881006.1。前面第二個貼圖中出現過這個病毒。
RsSHC014、rs3367都搜集自雲南昆明中華菊頭蝠(亦稱中華馬蹄蝠)的腸道與糞便樣本,其病毒株分離獲得時間同為2011年4月,它們的基因序列上傳至國際基因庫的時間同為2013年4月。
RsSHC014、rs3367與SARS-CoV的基因組相似度均為95%,被認為極可能是SARS-CoV的自然進化來源。rs3367的RBD(Receptor Binding Domain,受體結合域)與SARS-CoV接近程度相當高,在RBD與宿主受體ACE2直接接觸的14個位點中,rs3367與SARS-CoV在11個位點上氨基酸相同,雖然另有三個位點氨基酸不同,但rs3367仍能與hACE2(Human ACE2)良好結合併進入人類細胞。相比之下,在RBD14個直接接觸位點中,RsSHC014與SARS-CoV在7個位點上氨基酸不同,但2015年秋拉爾夫·S·巴里克、Vineet D Menachery、石正麗、葛行義等人的著名實驗證明,雖然與Sars-Cov有一半RBD接觸位點不同,但RsSHC014的刺突蛋白仍然能與hACE2良好結合。
rs3367是一種極不尋常的的冠狀病毒,它具備強大的跨物種傳播能力,它能感染的動物包括:人類、果子狸、貉、恆河猴、雪貂、水鼬、貓、蝙蝠、老鼠。
rs3367和RsSHC014雖然鮮為普通民眾所知,但在冠狀病毒研究領域,它們絕非無名之輩,在病毒跨物種傳播研究領域,它們更是極為重要的研究對象。它們的重要性主要在於其S(Spike)蛋白,即刺突蛋白。對它們的研究在2016年春之前就已經相當深入,並已取得了多個重大成果。我列舉幾個與rs3367或RsSHC014緊密相關的研究工作。
2013年10月,
石正麗、Peter Daszak、葛行義等人發表了一篇重要論文:”Isolation and characterization of a
bat SARS-like coronavirus that uses the ACE2
receptor”,論文地址:https://www.nature.com/articles/nature12711
該論文對rs3367(實驗使用的SL-CoV-WIV1與rs3367有99.9%的序列一致性,本文將它們視作同一病毒)進行了深入研究,證實了rs3367或WIV1具有跨物種傳播能力:可與細胞的ACE2受體結合,並以此進入人類、果子狸、中華馬蹄蝠的細胞。該論文證實了,自然界中存在與Sars-Cov一樣可跨物種傳播的類Sars冠狀病毒,它被認為是Sars-Cov起源於自然界的有力證明。
2015年11月,Ralph S Baric、Vineet D Menachery、石正麗、葛行義等人發表了著名的病毒合成實驗論文,參與論文的包括美國、中國、瑞士三國的大學、研究機構、政府部門。論文地址:
https://www.nature.com/articles/nm.3985
這次研究最重要的實驗成果是,用RsSHC014的刺突蛋白和Sars-Cov-MA15(一種實驗室多次傳代培育的可感染並使小鼠致病的Sars-Cov病毒變異體)的病毒主幹合成了一種人工改造病毒,把不能使人、鼠發病的RsSHC014改造成了可使人、鼠致病,可使實驗小鼠致死的危險嵌合病毒SHC014-MA15。這次實驗為改造致病性病毒開創了道路,SHC014-MA15相當於Sars-Cov-2的一個早期原型,它們的基本原理是相同的,區別在於,Sars-Cov-2比SHC014-MA15技術上更複雜,功能更豐富、強大,它還有一定的“自然進化”偽裝性。
2016年3月,Ralph S. Baric、Vineet D. Menachery等人又發表了一篇研究rs3367(WIV1)的論文。論文地址:https://www.pnas.org/content/113/11/3048
這一次,研究者們用rs3367的刺突蛋白與Sars-Cov-MA15合成了另外一種嵌合病毒WIV1-MA15。實驗證明,WIV1-MA15能夠感染人體細胞,在呼吸道、體內大量複製並使人發病,但症狀不及Sars嚴重。這是Ralph
S. Baric、Vineet D.
Menachery等人又一次使用嵌合方式改造出人類致病病毒,他們再一次研究了實驗室改造病毒對人類的致病能力,以及對該病毒應用抗體治療的效果。
上述兩篇論文的第一作者都是Vineet D. Menachery,通訊作者都是Ralph S. Baric。二人都是北卡羅來納大學教堂山分校的病毒學家、生物醫藥學家,同時,他們也都是瑞得西韋(Remdesivir)的研發人員。
從上述兩篇病毒嵌合相關的論文我們可以得到一些啟示。實驗室改造病毒,使之跨物種傳播的首要環節是換鑰匙或配鑰匙,也就是把不能打開人體細胞(即不能與人類細胞受體結合)的刺突蛋白(如CoVZC45或CoVZXC21的刺突蛋白),替換或改造成可打開人體細胞的刺突蛋白(如Sars-Cov、rs3367、rsSHC014的刺突蛋白)。要得到一把好用的“鑰匙”,可以把鑰匙整個換掉,也可以只換齒面或只修磨鑰齒。可以只處理關鍵的幾個鑰齒,也就是改造刺突蛋白RBD(Receptor
Binding Domain)中的五個關鍵氨基酸。
作了很長的鋪墊,現在可以說新冠的五個關鍵氨基酸與rs3367、rsSHC014、Sars-Cov、CoVZC45的關鍵氨基酸之間的關聯了。
新冠刺突蛋白RBD的五個關鍵氨基酸依次為:
亮胺酸L(451),苯丙胺酸F(482),麩酰胺酸Q(489),天門冬酰胺N(497)和酪胺酸Y(501)。
氨基酸名稱、縮寫字母后的數字是該氨基酸在刺突蛋白的氨基酸序列中的序號。
註:上述關鍵氨基酸序號是基於(氨基酸序列)長度為1269的新冠刺突蛋白而言的,如果選用長度為1273的新冠刺突蛋白,那麼五個關鍵氨基酸依次為:
亮胺酸L(455),苯丙胺酸F(486),麩酰胺酸Q(493),天門冬酰胺N(501),酪胺酸Y(505)。
Spike_1269與Spike_1273的關鍵氨基酸沒有區別,只是氨基酸序號相差4。在Spike_1269的氨基酸141、142之間插入四個氨基酸LGVY,就得到了Spike_1273,二者其它對應位置的氨基酸完全相同,使用Spike_1269或Spike_1273,對本文來說是等價的。
CoVZC45對應位置上的五個關鍵氨基酸為:絲氨酸S(446),空缺,絲氨酸S(470),纈胺酸V(478),酪氨酸Y(482)。這二個病毒關鍵氨基酸的對照情況如下圖:

註:CoVZC45的Spike蛋白NCBI地址
https://www.ncbi.nlm.nih.gov/protein/AVP78031.1
不難發現,CoVZC45與新冠只有第五個關鍵氨基酸相同,同為酪氨酸Y,而且,CoVZC45第二個關鍵鑰齒氨基酸缺失!如果CoVZC45要進化為新冠,它必須:
在第二個關鍵位置處突變增生出一個苯丙胺酸F;
將第一個關鍵鑰齒-絲氨酸S(446)突變、進化為亮胺酸L;
將第三個關鍵鑰齒-絲氨酸S(470)突變、進化為麩酰胺酸Q;
將第四個關鍵鑰齒-纈胺酸V(478)突變、進化為天門冬酰胺N;
保持第五個關鍵鑰齒-酪胺酸Y不變。
另外,可以看到,兩個病毒S1蛋白關鍵鑰齒有一定的序號錯位,這是CoVZC45的刺突蛋白氨基酸序列相對較短造成的,這需要CoVZC45變異增生出一定數量的氨基酸,消除氨基酸序列長度差異及氨基酸序號錯位,這無疑將加大CoVZC45進化為新冠的難度。
下面看看Sars-Cov、rs3367、rsSHC014這三個病毒的關鍵鑰齒情況:
Sars-Cov的五個關鍵氨基酸為:酪氨酸Y(442),亮胺酸L(472),天門冬酰胺N(479),蘇胺酸T(487),酪氨酸Y(491);
rs3367的五個關鍵氨基酸為:絲氨酸S(443),苯丙胺酸F(473),天門冬酰胺N(480),天門冬酰胺N(488),酪胺酸Y(492)。
rsSHC014的五個關鍵氨基酸為:色胺酸W(443),脯胺酸P(473),精胺酸R(480),丙胺酸A(488), 組胺酸H(492)。
在上述氨基酸中,精胺酸R、麩酰胺酸Q是經常發生相向變異、相互替代的相關氨基酸;組胺酸H、酪胺酸Y也是經常發生相向變異、相互替代的相關氨基酸。
註:
Sars-Cov的Spike蛋白NCBI地址
https://www.ncbi.nlm.nih.gov/protein/AAR07630.1
rs3367的Spike蛋白NCBI地址
https://www.ncbi.nlm.nih.gov/protein/AGZ48818.1
rsSHC014的Spike蛋白NCBI地址
https://www.ncbi.nlm.nih.gov/protein/AGZ48806.1
將五個病毒的關鍵鑰齒氨基酸情況匯總於下表。
從上表容易觀察到:
1。在第五關鍵鑰齒位置,前四個病毒的氨基酸都是酪胺酸Y,rsSHC014的相應氨基酸雖然是組胺酸H,但它與酪胺酸Y是經常發生相互變異、替代的相關氨基酸。這也許表明,在五個關鍵鑰齒中,第五鑰齒最核心,也最保守,是決定人類感染能力的最重要的一個鑰齒氨基酸;
2。新冠的第五關鍵鑰齒、第四關鍵鑰齒、第二關鍵鑰齒都與rs3367的對應關鍵鑰齒相同,也就是說,新冠有三個關鍵鑰齒和rs3367相同;
3。新冠的第三關鍵鑰齒麩酰胺酸Q雖然與其它四個病毒都不相同,但它與rsSHC014的第三關鍵鑰齒精胺酸R是經常發生相互替代的氨基酸。
新冠的第一關鍵鑰齒亮胺酸L的來歷淵源還沒有完全調查清楚。第一關鍵鑰齒可能沒有特別的參照來源,它可能是基於另外四個關鍵鑰齒,從某一候選範圍中選擇、試驗出來的。如果以某一候選氨基酸+其它四個關鍵鑰齒的組合構造的RBD與人體細胞受體適配,那麼該候選氨基酸就可以作為第一關鍵鑰齒。
粗略考慮一下第一關鍵鑰齒的候選範圍。
五個病毒中,只有CoVZC45的刺突蛋白打不開人體細胞,其它四種病毒的刺突蛋白對人體細胞(受體鎖)都有效。從上圖第二列可見,除CoVZC45外,其它四個病毒的第一關鍵鑰齒,相應的四個氨基酸依次是:亮胺酸L(Sars-Cov-2)、酪胺酸Y(Sars-Cov)、絲氨酸S(rs3367)、色胺酸W(rsSHC014)。
這四種氨基酸中,亮氨酸L,色氨酸W是電荷分布均勻的非極性氨基酸,絲氨酸S,酪氨酸Y則是不帶電荷的極性氨基酸。也就是說,這四種能感染人的病毒,它們的關鍵鑰齒氨基酸都是電荷分布均勻或電荷中性的,它們的電場、電離屬性接近。
因此,可以先從電荷分布均勻或不帶電荷的氨基酸中選擇候選的新冠第一關鍵鑰齒,符合這一條件的氨基酸共15種。這個範圍可能偏大,可以考慮其它條件,先在更小的範圍內選擇。如,以Sars-Cov的第一關鍵鑰齒-酪胺酸Y為基準,挑選與它的范德華半徑差<=20,且疏水性、酸鹼性相同的氨基酸。符合這一條件的氨基酸有4種:甲硫胺酸、亮胺酸、異亮胺酸、苯丙胺酸,最終入選新冠第一關鍵鑰齒的亮胺酸也在其中。通過上述思路來挑選新冠第一關鍵鑰齒,從而確定新冠的全部五個關鍵鑰齒是完全可行的。
如果新冠是由CoVZC45自然進化產生的,那麼,CoVZC45在五個關鍵鑰齒部位的進化情況是:
在第二個關鍵鑰齒處突變增生出與rs3367對應位置相同的苯丙胺酸F;
第四關鍵鑰齒纈胺酸V(478)突變、進化為與rs3367第四關鍵鑰齒相同的天門冬酰胺N;
第三關鍵鑰齒絲氨酸S(470)突變、進化為與rsSHC014第三關鍵鑰齒精胺酸R可互相替換的麩酰胺酸Q;
第一關鍵鑰齒絲氨酸S(446)突變、進化為亮胺酸L;
保持第五關鍵鑰齒酪胺酸Y(482)不變(但它的位置序號將變為501,它的前面將有若干新增生的氨基酸)。
上述四項突變、進化都發生在刺突蛋白的高度保守區域,通常,高度保守區域內的氨基酸是很少發生突變的。不論其它位置的突變,僅四個關鍵鑰齒的突變,及其位置序號的準確改變,就是幾十年、幾百年、幾千年。。。所無法完成的,更何況這四個關鍵鑰齒不是隨機突變成什麼都行,而是各自都要變化成確定的氨基酸。
還有,舟山群島冠狀病毒CoVZC45,怎麼偏巧就進化出了和雲南冠狀病毒rs3367、rsSHC014相同或可替換的關鍵鑰齒?而這兩個病毒,恰巧又是病毒學家們反覆研究、實驗過,對其瞭如指掌的病毒。該如何解釋這些巧合?這樣偶然又偶然的事,自然發生的幾率有多大?
新冠決定人類感染能力的五個關鍵氨基酸不是隨機突變、進化產生的,它們是基於明確的參照物rs3367、rsSHC014,人為設計,定向挑選、試驗的結果。

簡單概括一下,新冠五個關鍵鑰齒可能的確定過程:
1。以參照病毒rs3367的五個關鍵鑰齒為新冠關鍵鑰齒的初始原型,並保持第五、第四、第二關鍵鑰齒不變;
2。嘗試替換掉第三關鍵鑰齒-天門冬酰胺N。實驗發現,參照病毒rsSHC014的第三關鍵鑰齒精胺酸R,以及精胺酸R的常發變異替代者麩酰胺酸Q均可作為替代者,換入新的第三關鍵鑰齒後,RBD仍能與人體細胞受體良好結合。以麩酰胺酸Q為新冠的第三關鍵鑰齒。
3。嘗試替換掉第一關鍵鑰齒-絲氨酸S。如前所述,在適當的範圍內選擇、試驗候選氨基酸。實驗發現,以亮胺酸L替換絲氨酸S後,RBD仍能與人體細胞受體良好結合。以亮胺酸L為新冠的第一關鍵鑰齒。
至此,新冠的五個關鍵鑰齒都已確定。
以上只是對新冠5關鍵鑰齒確定過程的粗略推測,它可能與實際的確定過程存在某些出入,比如,第三關鍵鑰齒、第一關鍵鑰齒可能並非一先一後逐個確定的,它們可能是從若干雙候選組合中同時選出、確定的。
對比Sars-Cov 、新冠的五個關鍵氨基酸、RBD及hACE2結合效果:
1。新冠與Sars-Cov的五個關鍵鑰齒氨基酸只有第五個相同,其它四個都不相同,但這四對相異氨基酸每一對的疏水性和靜電極性都非常相似;
2。雖然有四個關鍵氨基酸不同,但兩者RBD(受體結合域)的3-D結構幾乎沒有明顯差異,或者說,兩者RBD的空間形態高度同構;在與人類受體的接觸界面上,兩個RBD結構體的范德華力(一種分子間的電性引力)和靜電作用效果非常相似;
3。與SARS一樣,新冠的RBD也能與人類細胞受體ACE2發生強相互作用並良好結合,新冠具有不亞於SARS的人體細胞感染能力。
SARS-Cov與Sars-Cov-2刺突蛋白關鍵氨基酸異同,及空間結構示意圖
與新冠、Sars-Cov二病毒RBD空間結構及受體結合能力有關的兩篇論文。
論文一。2020年1月21日,來自中國科學院上海巴斯德研究所等單位的徐心恬、陳萍、王靖方等學者在SCIENCE
CHINA Life
Sciences(《中國科學:生命科學》)上發表了一篇論文,題為“源於武漢爆發的新型冠狀病毒的進化及其棘突蛋白對人類傳播風險的建模”(Evolution
of the novel coronavirus from the ongoing Wuhan outbreak and modeling
of its spike protein for risk of human transmission)。論文地址為:
https://link.springer.com/content/pdf/10.1007/s11427-020-1637-5.pdf
論文指出:
a)儘管新冠與SARS-CoV二者S蛋白的總體同源性較低,但二者的RBD區域卻有較高的同源性;
b)令我們驚訝的是,儘管替換了五個重要的界面氨基酸殘基中的四個,但新冠仍與人體ACE2有着顯著的結合親和力;
c)進一步觀察發現,新冠的S蛋白和SARS-CoV的S蛋白在RBD域具有幾乎相同的三維結構,在相互作用界面上保持了相似的范德華力和靜電性質。
論文二。2020年2月19日,美國德克薩斯大學奧斯汀分校Jason
S McLellan團隊,及國家過敏和傳染病研究所的研究人員在Science雜誌上聯合發表了題為“Cryo-EM Structure of
the 2019-nCoV Spike in the Prefusion Conformation”的論文。論文地址為:
https://science.sciencemag.org/content/367/6483/1260
論文指出:
a) 2019-nCoV與SARS-CoV的RBD存在一定的構象差異,但當按某一角度對齊時,二者就呈現出較高程度的結構同源性。
b) 兩種病毒的S1蛋白與ACE2的複合體非常相似;
c) 2019-nCoV的S1蛋白與ACE2的結合親和力是Sars-Cov的10-20倍。
最後,我們將關鍵鑰齒的確定過程延展,設想一下新冠實驗室改造的可能流程:
將CoVZC45的主幹與Sar-Cov(或rs3367、rsSHC014)的(擴展)RBD嵌合,得到新冠的原型病毒。原型病毒已具備感染人的能力;
參照rs3367、rsSHC014的關鍵鑰齒氨基酸,修改原型病毒的關鍵鑰齒氨基酸,確定新冠最終的五個關鍵鑰齒氨基酸;
參照rs3367、rsSHC014、Sars-Cov等病毒的RBD及S1蛋白,編輯新冠RBD及S1蛋白的其它位置,模糊嵌合操作痕跡;
參照Sar-Cov、HIV-1、埃博拉、HEV71等具備特殊功能的病毒,進行其它功能增益(Gain-of-Function)改造,包括複製能力、擴散能力增強,設計、實現免疫破壞力、抗免疫能力、免疫干擾能力等等;
進行其它基因編輯及實驗室痕跡模糊化處理。
關於新冠的功能增益,我去年的一篇文章“新冠君,你額頭的Lab金印洗得掉麼?”的第3~第6部分中有一些總結,有興趣的讀者可參考。
(正文完)













