接續:誰設計、製造了新冠病毒(二 下)
誰設計、製造了新冠病毒?
新冠病毒為什麼偏偏出現在武漢?是武漢病毒研究所泄漏了新冠病毒,還是有人在蓄意製造武漢病毒研究所泄漏新冠病毒的假象?
新冠病毒來自實驗室,新冠病毒不可能來自動物,這其實早已鐵證如山;新冠疫情發生的來龍去脈,其實同樣不難疏理清楚。溯源工作之所以停滯不前,新冠病毒的來源真相、新冠疫情的發源真相之所以至今懸而未決,不是因為缺乏證據、線索,而是因為有極為強大的勢力一直在裝聾作啞、壓制言論,隱匿證據、捂蓋線索、迴避基本事實,一再炮製、散布謊言,製造假象,轉移視線、混水摸魚。如果新冠病毒源自中國,不放過任何打擊中國機會的美國及其盟友,在溯源問題上,為什麼只能不斷炮製謊言、捕風捉影、含沙射影?為什麼始終拿不出一件貨真價實的證據?新冠病毒到底出自哪個國家的病毒學家、實驗室之手?哪個國家在新冠疫情發生前兩年(2017年12月19日)全面重啟了危險病毒體功能增益研究,重新以聯邦資金資助本國功能增益研究,疫情發生後對此一直諱莫如深、百般迴避?哪個國家操縱着國際組織,領導、操縱着科學界,操縱着全球話語權?到底是哪個國家最不甘讓病毒、疫情的源起真相大白於天下,決心在欺騙世人、愚弄世人的道路上繼續裸奔下去?
新冠病毒來自實驗室,新冠病毒出自長期從事冠狀病毒功能增益改造研究的病毒學家、實驗室之手。
新冠病毒是廣為借鑑、人為精心設計的跨科屬病毒集大成者,新冠病毒有多項結構、特性借鑑自各種冠狀病毒和非冠狀病毒,這些結構、特性根本不可能自然演化(自然變異或自然重組)產生。我舉六個例子。
借鑑示例一:新冠病毒刺突蛋白S1/S2處(S1亞基、S2亞基交界處)的“RRAR”furin酶切位點借鑑自小鼠肝炎病毒MHV-JHM株系、MHV-3株系,及貓傳染性腹膜炎病毒(FIPV)某些毒株S1/S2處的“RRARR”酶切位點。這些毒性、致死能力極強的冠狀病毒與新冠病毒差異巨大,根本不存在自然進化關係;
借鑑示例二:新冠病毒“RRAR”酶切位點附近的O-Linked聚糖結構借鑑自HIV-1、埃博拉、丙型肝炎等病毒,該結構有屏蔽、逃避宿主免疫系統打擊的作用。HIV-1是逆轉錄科病毒,埃博拉是絲狀病毒科病毒,丙型肝炎病毒是黃病毒科病毒,它們都不是冠狀病毒;O-Linked聚糖結構未在其它冠狀病毒中發現、報告過。
借鑑示例三:新冠病毒刺突蛋白的RBD關鍵氨基酸借鑑自蝙蝠冠狀病毒Rs3367(WIV1),這一借鑑設計賦予了新冠刺突蛋白極強的人類ACE2結合能力,賦予了新冠病毒極強的人體細胞感染能力、極強的跨物種感染能力,它也是新冠病毒泛器官、泛組織感染、侵犯能力的兩大來源之一。新冠與Rs3367(WIV1)總體差異很大,進化距離極為遙遠。
借鑑示例四:新冠病毒刺突蛋白S1亞基中的gp120蛋白和Gag蛋白借鑑自艾滋病病毒HIV-1,gp120蛋白可賦予病毒感染、殺死CD4+T淋巴細胞,損害人體免疫系統的能力,這是新冠重症患者淋巴細胞計數顯著減少的原因之一(新冠病毒還因具有“RRAR”furin酶切位點而可通過高效的膜融合感染、殺死T淋巴細胞)。這兩種蛋白也未在其它冠狀病毒中發現、報告過。
借鑑示例五:新冠病毒N蛋白(Nucleocapsid,核衣殼蛋白)中的nsp3A編碼借鑑自HEV71病毒(71型人腸道病毒,嬰幼兒手足口病的主要病原體),nsp3A編碼有抑制、干擾宿主免疫反應的作用。HEV71也不是冠狀病毒,它是微小RNA病毒科病毒。沒有在其它冠狀病毒中發現、報告過nsp3A編碼,而且,冠狀病毒的N蛋白高度保守,極少發生自然變異。
借鑑示例六:新冠病毒具有“逆轉錄自身RNA為cDNA(RNA的互補DNA),並將其整合到人體被感染細胞DNA中”的特性,它使新冠患者在康復後體內仍存在新冠病毒的RNA片斷,使許多康復患者的PCR檢測結果仍為陽性。這一“逆轉錄RNA-人體DNA整合”特性借鑑自逆轉錄科病毒,沒有在其它冠狀病毒中發現、報告過這一特性。
上述六項借鑑情況都有可靠的論文依據或其它依據(如基因序列依據),但難以得到廣泛宣傳(我的溯源文章證據詳實充分可靠,寫作慎重仔細,內容清晰準確,錯誤極少,有一說一、實事求是,挖真相、講真話,不撒謊、不欺騙,我個人認為這些文章非常優秀、非常難得、獨一無二,但它們一直被冷處理,既得不到廣泛宣傳,也得不到廣泛討論),也難有人把他們串聯起來深入思考。六項借鑑示例的依據我在以前的文章中都提供過;部分借鑑示例我還詳細展開介紹過,比如,
“RRAR”furin酶切位點相關的借鑑可參閱:
新冠furin酶切位點探源,病毒學界的集體捂瞞
逆轉錄-人體DNA整合相關的借鑑可參閱:
新冠病毒與拉爾夫·巴里克的不解之緣(一)
gp120蛋白、Gag蛋白相關的借鑑可參閱:
誰設計、製造了新冠病毒(二 上)
一文中的有關內容(可在文中搜“gp120”)。
為什麼沒有科學權威站出來對世人點明上述情況?要麼是我撒謊造謠、無中生有,要麼是科學權威們在迴避、隱匿這些事實。哪個國家有能力操縱科學界、科學權威、科學刊物?哪個國家最需要裝聾作啞,隱匿、捂蓋上述指示新冠病毒來源的重大證據、線索?
本文及本文續篇將再次展開討論RBD關鍵氨基酸相關的借鑑情況(我去年已寫過三篇相關文章)。
新冠與rs3367(WIV1)RBD關鍵氨基酸的關聯
冠狀病毒刺突蛋白RBD中有五個重要位點,這五個位點上的氨基酸殘基決定刺突蛋白的ACE2結合能力,進而決定冠狀病毒通過結合ACE2受體進入、感染細胞的能力,它們被稱為(ACE2相關的)RBD關鍵氨基酸殘基,簡稱RBD關鍵氨基酸或RBD關鍵殘基。
RBD即受體結合域(Receptor Binding Domain),它是冠狀病毒刺突蛋白(spike protein,簡稱S蛋白)S1亞基的一部分。
蝙蝠冠狀病毒被認為是新冠病毒的近親,但大多數蝙蝠冠狀病毒都不以ACE2為感染蝙蝠或其它動物的受體,或者說,大多數蝙蝠冠狀病毒都不能結合ACE2,都不能通過結合ACE2來感染動物細胞,感染人類;只有約7種蝙蝠冠狀病毒象新冠和SARS那樣,能夠通過結合ACE2來感染宿主細胞。
刺突蛋白是新冠病毒與蝙蝠冠狀病毒差異最大的蛋白,除RaTG13外的蝙蝠冠狀病毒與新冠病毒都有巨大的刺突蛋白差異,下圖是有關對照示例,注意圖中S蛋白處的“深谷”。
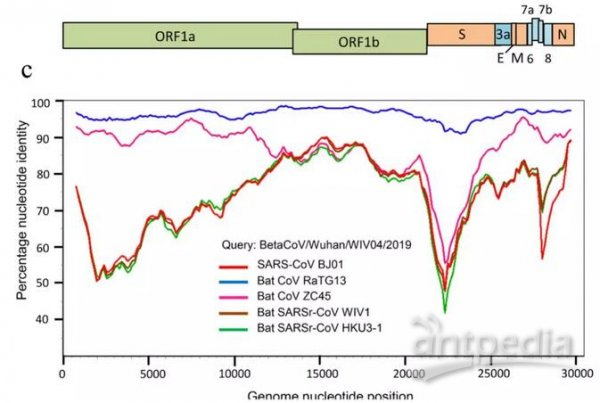
SARS及4種蝙蝠冠狀病毒與新冠病毒基因序列一致度的線性變化
新冠病毒與蝙蝠冠狀病毒RBD關鍵氨基酸的差異也很大,絕大多數蝙蝠冠狀病毒與新冠病毒至多只有一對RBD關鍵氨基酸相同,下面是一個對照示例表,表中與新冠(SARS-CoV-2)作RBD關鍵氨基酸對照的是SARS和三種蝙蝠冠狀病毒RaTG13、CoVZC45、rsSHC014。
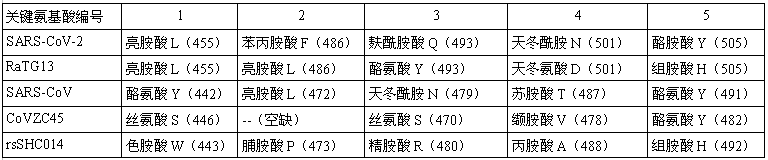
新冠與幾種同支系(β譜系B支系)病毒的RBD關鍵氨基酸對照表
表中關鍵氨基酸的表達格式為:氨基酸名稱-縮寫代號-(氨基酸序號)。以表中第二行第二列的“亮胺酸L(455)”為例,它表示新冠病毒的第一個關鍵氨基酸是一個亮胺酸,其單字母縮寫為L(氨基酸還有三字母縮寫),它是新冠病毒刺突蛋白氨基酸序列中的第455個氨基酸(殘基)。
新冠病毒在進化樹中的“第一近親”是(真實性可疑的)蝙蝠冠狀病毒RaTG13。RaTG13與新冠全基因組序列一致度(相似度)為96.2%,二者刺突蛋白aa(amino acid,氨基酸)序列的一致度約為97.4%。然而,由上表可見,新冠、RaTG13這兩個“最親的親戚”,它們的五個RBD關鍵氨基酸僅有第一對相同(天冬酰胺與天冬氨酸是兩種不同的氨基酸)。
RBD關鍵氨基酸與新冠最接近的蝙蝠冠狀病毒是一對“孿生”病毒 rs3367和WIV1,它們和新冠有三對RBD關鍵氨基酸相同,見下表:
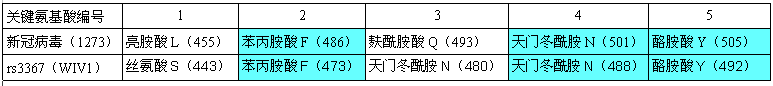
新冠、rs3367(WIV1)RBD關鍵氨基酸對照表
rs3367、WIV1這對“孿生”蝙蝠冠狀病毒發現於雲南同一山洞,二者全基因組序列一致度為99.92%,在決定物種感染能力及宿主範圍的S蛋白S1亞基部分,二者的aa序列(氨基酸序列)完全相同(從而二者的5個RBD關鍵氨基酸也完全相同)。
由上表可見,新冠、rs3367(WIV1)的5個RBD關鍵氨基酸有三對是相同的:它們的第五、第四、第二關鍵氨基酸同為酪氨酸Y、天冬酰胺(亦稱天門冬酰胺)N、苯丙氨酸F。
此外,它們的第三RBD關鍵氨基酸雖然不同,但卻有重大潛在關聯。新冠的第三關鍵氨基酸是麩酰胺酸Q,rs3367(WIV1)的第三關鍵氨基酸是天冬酰胺N,我們比較一下二者的理化屬性。
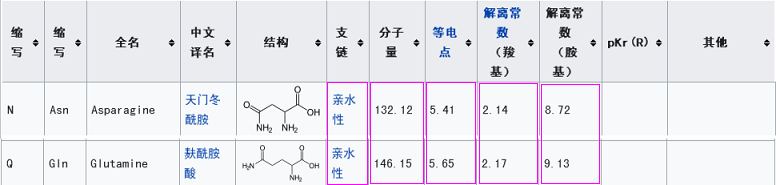
由上表可見,二者的五項理化屬性或者相同,或者非常相似、接近(在20種常見氨基酸中,理化屬性如此接近的氨基酸恐怕不容易找到第二對),這五項理化屬性是分子間相互作用(吸引或排斥,作用力的方向、強弱)的重要決定因素或影響因素,理化屬性的高度相似意味着,在刺突蛋白與ACE2相互作用時,這兩個氨基酸殘基所起的作用很可能是非常相似、非常接近的。
至此可知,新冠的5個關鍵氨基酸,與rs3367(WIV1)的5個RBD關鍵氨基酸高度關聯,其中三對相同,還有一對理化屬性高度相似。
以下論文可以幫助我們進一步認識新冠與rs3367(WIV1)RBD關鍵氨基酸的關聯關係。
2020年9月8日,蘇格蘭Dundee大學生命科學學院的David Booth和Conchita Fraguas Bringas在Microbiology上發表了如下論文:
Identification
of a SARS-like bat coronavirus that shares structural features with the
spike glycoprotein receptor-binding domain of SARS-CoV-2
一種與SARS-CoV-2刺突糖蛋白受體結合域具有相同結構特徵的SARS樣蝙蝠冠狀病毒的鑑定
https://www.microbiologyresearch.org/content/journal/acmi/10.1099/acmi.0.000166
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7717483/
論文要點如下:
1、論文指出,SARS-CoV-2與類SARS蝙蝠冠狀病毒Rs3367,儘管二者刺突蛋白的序列一致度僅為77.70 %,但它們ACE2結合相關的RBD關鍵氨基酸殘基卻高度保守(保守即指變化、差異小),SARS-CoV-2決定ACE2結合強度和宿主範圍的重要RBD氨基酸殘基Phe486(苯丙氨酸F486)、Thr500(蘇氨酸T500)、Asn501(天冬酰胺N501)、Tyr505(酪氨酸Y505),與Rs3367的對應RBD殘基相同。
作點解釋,論文認同ACE2相關的RBD關鍵(key)氨基酸殘基為5個,這一段內容除指出新冠、Rs3367的第二、第四、第五RBD關鍵氨基酸相同(參見前面的“新冠、rs3367(WIV1)RBD關鍵氨基酸對照表”)外,還指出了二者另一對相同的氨基酸殘基,(新冠的Thr500和Rs3367的Thr487),又並稱其為RBD重要(important)殘基。
另外,論文中使用的氨基酸三字母縮寫與本文使用的單字母縮寫是一致的,例如,三字母縮寫Phe和單字母縮寫F都代表苯丙氨酸;
2、論文指出,SARS-CoV-2與Rs3367之外的其它已研究的α譜系冠狀病毒、β譜系冠狀病毒RBD關鍵氨基酸的一致度都很低(新冠、SARS、Rs3367、WIV1都屬於β譜系)。
再補充說明一下,β譜系B支系還有一對“孿生”蝙蝠冠狀病毒Rs4874和WIV16(Rs4874、WIV16二者的全基因組序列一致度為99.93%),它們與rs3367、WIV1 也高度相似,WIV1與WIV16的全基因組序列一致度為97.54%。這二對四個病毒的5個RBD關鍵氨基酸完全相同,它們都發現於雲南同一山洞,
據我所知,除上述二對“孿生”病毒外,其它蝙蝠冠狀病毒至多只有一對RBD關鍵氨基酸與新冠病毒相同。
以上四個蝙蝠冠狀病毒雖然都是武漢病毒研究所發現的,但它們的基因序列(核酸序列、蛋白aa序列)很早就國際共享了,其中,2013年4月8日,武漢病毒研究所將rs3367的全基因組序列、WIV1的spike蛋白序列上傳至了NCBI(National Center for Biotechnology Information,美國國家生物技術信息中心)GenBank生物信息數據庫,2013年7月8日,武漢所又將WIV1的全基因組序列上傳至GenBank。請注意,美國病毒學家拉爾夫·巴里克(Ralph S. Baric)等人2000年就已發明了基於基因序列合成冠狀病毒,收穫活性毒株的反向遺傳技術,美國可以輕鬆合成、復活所有基因序列國際共享的蝙蝠冠狀病毒,美國資助武漢病毒研究所的最重要目的之一就是利用武漢所搜集特殊蝙蝠冠狀病毒。
3、利用分子生物學相關軟件構建了Rs3367的RBD模型,發現它與SARS-CoV-2的RBD模型有非常相似的三維結構;
4、將Rs3367的RBD模型疊加到SARS-CoV-2的RBD與ACE2相互作用的複合體上,獲得了Rs3367的RBD與ACE2相互作用的複合體模型,研究發現,儘管兩個複合體模型有所不同,但它們的空間構象也非常相似,而且,SARS-CoV-2對應的複合體中的關鍵接觸(RBD關鍵氨基酸殘基與ACE2氨基酸殘基的接觸和相互作用),在Rs3367對應的複合體中得到了維持(即SARS-CoV-2維持了Rs3367與ACE2的關鍵氨基酸接觸)。
由3、4可知,SARS-CoV-2、Rs3367兩病毒的RBD空間結構非常相似,它們與ACE2作用時的空間構象也非常相似。由此可以認為,SARS-CoV-2、Rs3367的RBD關鍵氨基酸是高度等價的。
新冠的RBD關鍵氨基酸是人為設計的
rs3367(WIV1)與新冠全基因組序列一致度約為82.13%,刺突蛋白aa(amino acid,氨基酸)序列一致度約為77%,rs3367(WIV1)與新冠的進化距離遙不可及;
相比之下,RaTG13與新冠全基因組序列的一致度為96.2%,刺突蛋白aa序列一致度約為97.4%。
新冠、rs3367(WIV1)與人類ACE2的結合能力都極強,而RaTG13卻不能結合ACE2(結合親和力非常弱);
新冠與RaTG13僅有一對RBD關鍵氨基酸相同,與rs3367(WIV1)卻有三對RBD關鍵氨基酸相同,還有一對理化屬性高度相似。
新冠的RBD關鍵氨基酸、人類ACE2結合能力與“第一近親”RaTG13相去甚遠,卻與八杆子打不着、進化距離非常遙遠的rs3367(WIV1)“酷肖”或密切關聯,這是自然演化的偶然巧合,還是人為借鑑、精心設計的痕跡?
新冠病毒東鱗西爪,集多種冠狀病毒、非冠狀病毒結構、特性於一身?這可能是自然演化的結果嗎?
新冠的五個RBD關鍵氨基酸不是隨機突變或偶然重組,無目的進化產生的,它們是基於明確的設計目標,參照、借鑑rs3367(WIV1),通過關鍵氨基酸復用、替換,人為設計、確定的。
冠狀病毒RBD的計算機建模,RBD與ACE2相互作用的計算機模擬是十多年前就已使用的非常成熟的技術,對一個經驗豐富的病毒學家來說,使用蛋白質(或分子)設計、模擬、預測工具(如Rosetta Design、MacPyMol等等),參照、基於rs3367(WIV1)的RBD關鍵氨基酸,通過氨基酸重用、替代,設計出高度等效的新冠病毒RBD關鍵氨基酸並非難事。忽略摸索過程,試錯、反覆及瑣碎細節,大致可通過以下步驟完成新冠RBD關鍵氨基酸的設計:
1、構建WIV1的RBD關鍵氨基酸結構模型,以該模型為新冠RBD關鍵氨基酸的初始模型;
2、復用WIV1的3個關鍵氨基酸:第五關鍵氨基酸--酪氨酸Y,第四關鍵氨基酸--天門冬酰胺N,第二關鍵氨基酸--苯丙胺酸F;
3、用理化屬性非常相似的麩酰胺酸Q替代天冬酰胺N,以之為模型中新的第三關鍵氨基酸;
4、在20種常見氨基酸中挑選第一關鍵氨基酸—絲氨酸S的替代者,入選氨基酸與已確定的四個氨基酸構成的新的關鍵氨基酸模型應與初始模型高度同構;
5、進行ACE2結合模擬,新模型應儘可能維持初始模型與ACE2的相互作用構象。
6、使用反向遺傳平台合成擁有所設計RBD關鍵氨基酸的病毒,通過實際的細胞感染實驗驗證新RBD關鍵氨基酸的有效性。
為什麼要借鑑rs3367來設計新冠病毒的RBD關鍵氨基酸
rs3367(WIV1)是功能增益研究的極佳借鑑、參照對象和原材料。
rs3367(WIV1)是新冠病毒出現前跨物種感染能力最強的冠狀病毒(另一對孿生病毒WIV16、Rs4874的跨物種感染能力應與WIV1、rs3367相同),它(們)的刺突蛋白能結合眾多脊椎動物的ACE2,綜合有限的研究成果可知,rs3367(WIV1)可感染的物種至少包括以下10種(類):
人類、非洲綠猴、恆河猴、果子狸、貉、雪貂、水鼬(即水貂)、貓、蝙蝠(包括菊頭蝠、果蝠等翼手目動物)、老鼠。
參照、借鑑rs3367(WIV1)的RBD關鍵氨基酸來設計高度等效的新冠病毒RBD關鍵氨基酸,首先就是為了製造出一種有強大跨物種感染能力的病毒。
來看看新冠病毒的跨物種感染能力。
新冠病毒的跨物種感染、傳播能力極為強大、驚人!已確認的,或已報告的可被新冠病毒感染的動物包括:
人類、靈長類動物(如大猩猩、非洲綠猴、恆河猴、食蟹獼猴、狒狒、黑長尾猴和狨猴)、穿山甲、狗、豬、兔子、某些鼠類(如倉鼠、田鼠)、鼬類或貂類(如雪貂、水貂、水獺、黃鼠狼等等)、家貓、老虎、獅子、雪豹、麝香貓、北美鹿(如白尾鹿)、貉、樹鼩、果蝠等等。


新冠病毒的宿主名單看上去比WIV1(rs3367)長得多,這是否說明新冠的跨物種感染能力比rs3367 (WIV1)強得多呢?未必如此。這首先是研究的不對等造成的,對rs3367、WIV1的研究遠遠少於新冠,對它們感染能力的發現自然也大大少於新冠;此外,rs3367、WIV1雖然細胞進入、感染能力廣泛,但它們毒性太弱,很少使被感染的動物發病或產生明顯症狀(它們還會從被感染器官、組織中自行消失,下篇文章將有論文說明這一點),不專門、細緻地研究、實驗,很難發覺、發現它們對某種動物的感染能力。因此,rs3367、WIV1可感染的動物絕不會只限於前述10種,它們的跨物種感染能力可能與新冠在伯仲之間。
除了跨物種感染能力非常強大外,rs3367 (WIV1)刺突蛋白與hACE2(human ACE2)的結合能力也非常強大,論文依據如下。
2016年3月14日,冠狀病毒合成之父Ralph
S. Baric領導的團隊在PNAS(美國國家科學院院刊)發表了如下論文:SARS-like WIV1-CoV poised for
human emergence(類SARS冠狀病毒WIV1-CoV對人類有潛在威脅)
https://www.pnas.org/content/113/11/3048
我的文章多次提及這篇論文,論文以小鼠體內實驗證明:
WIV1病毒刺突蛋白與hACE2的結合親和力遠強於它與mACE2(mice ACE2)的結合親和力;
WIV1-CoV(WIV1的實驗室克隆)、WIV1-MA15(WIV1刺突蛋白與SARS小鼠適應性變異體骨架的嵌合病毒)這兩種病毒只能使普通小鼠產生輕微臨床症狀,但對表達hACE2的轉基因小鼠(mACE2轉基因為hACE2的小鼠),它們的致病能力大大加強。它們能使轉基因小鼠體重減輕超過10%;它們在轉基因小鼠肺中的複製滴度,比在普通小鼠肺中的複製滴度高100倍;它們在轉基因小鼠大腦中的複製比在肺中更強勁,使部分轉基因小鼠患上了致命的腦炎。
由轉基因小鼠實驗推測,WIV1的刺突蛋白應該具有人類大腦感染能力;進一步推測,新冠病毒的大腦感染、侵犯能力,很可能與其RBD關鍵氨基酸設計有關(S1/S2處“RRAR” furin酶切位點賦予新冠病毒的高效膜融合感染能力,應該是新冠具有大腦感染、侵犯能力的另一個重要原因)。
rs3367(WIV1)雖然有很強的人類ACE2結合能力和人體細胞進入能力,但它們的病毒骨架毒性很弱。它們只能使(非轉基因的)實驗室小白鼠產生輕度的疾病症狀;它們沒有人體致病能力,不會使人體產生臨床疾病症狀,而且它們會自行從人體內消失(它們可能沒有機會到達人類大腦,或毒性不足以造成人類大腦損傷)。雖然本身沒有人類致病能力,但如果將它們的刺突蛋白、RBD或RBD關鍵氨基酸嫁接、嵌合、或應用到毒性強的病毒(如SARS)骨架上,就可以製造出新的危險、可怕的人類致病性病毒。
新冠病毒的hACE2結合能力也極為強大。
2021年6月24日,澳大利亞弗林德斯大學、拉籌伯大學的四位科學家在Nature
Science上發表了如下論文:In silico comparison of SARS-CoV-2 spike protein-ACE2
binding affinities across species and implications for viral
origin(新冠刺突蛋白與ACE2結合親和力的跨物種模擬比較及其對病毒起源的指示)
https://www.nature.com/articles/s41598-021-92388-5
研究者通過分子動力學定量模擬研究,計算出了新冠S蛋白(刺突蛋白)與各物種ACE2相互作用的結合能(binding
energies for the interactions),各物種ACE2與新冠S蛋白的結合能從高到低依次為:人類 > 穿山甲
> 狗 > 猴子 > 倉鼠 > 雪貂 > 貓 > 老虎 > 蝙蝠 > 麝貓 > 馬
> 牛 > 蛇 > 老鼠。
定量模擬計算結果表明:在14個對照研究物種中,與新冠病毒刺突蛋白結合能力最強的物種ACE2,就是hACE2!
新冠、rs3367 (WIV1)的跨物種感染能力都非常強大,它們的刺突蛋白都極為適宜結合hACE2,這是自然演化的“巧合”,還是人為借鑑、人為設計的必然結果呢?
新冠、rs3367 (WIV1)還有一項“巧合”:它們都具有泛器官、泛組織感染能力(WIV1病毒泛器官、泛組織感染能力的論文依據將在下篇文章給出)。
為什麼新冠、rs3367 (WIV1)能感染宿主的眾多器官、組織?因為它們都有強大的物種ACE2結合能力,而細胞表面的跨膜蛋白ACE2(Angiotensin Converting Enzyme2,血管緊張素轉換酶2 )廣泛存在於脊椎動物的呼吸、消化、血液、泌尿、生殖、神經(如眼部的相關組織,大腦中負責嗅覺的區域等等)等系統的器官、組織內。
新冠的泛器官、泛組織感染、侵犯能力要遠強於rs3367(WIV1),這不僅因為其毒性、抗免疫能力遠強於後者,還因為新冠具有同譜系(β譜系)所有蝙蝠冠狀病毒都不具有的furin酶切位點,而furin蛋白酶廣泛存在於人體各器官、組織之中,其分布的廣度、豐度超過了新冠使用的主要受體ACE2,furin酶切位點及其賦予新冠的膜融合感染能力極大地增強、加劇了新冠病毒的泛器官、泛組織感染、侵害能力。
接下來的問題是,誰借鑑rs3367(WIV1)的RBD 關鍵氨基酸,通過重用、替換,設計出了新冠病毒的RBD關鍵氨基酸?
相關文章:
連繫新冠病毒與Ralph S. Baric的雙紐帶(上)
連繫新冠病毒與Ralph S. Baric的雙紐帶(中)
連繫新冠病毒與Ralph S. Baric的雙紐帶(下)
(未完待續)