(本文原作於2021年6月14日)
本文完整標題:新冠刺突蛋白RBD(受體結合域)決定感染人類能力的五個關鍵氨基酸(殘基),是參照、基於rs3367的關鍵氨基酸(殘基),復用、替代得到的。
本文是對“新冠RBD5個關鍵氨基酸的實驗室選擇”一文的結論明確化、敘述簡明化。本文基於前文,與之並不衝突,但更簡明、清晰、準確,也更具結論價值。
寫作本文的目的是指出下述發現、事實,並作出基本的判斷:
1。新冠刺突蛋白RBD(受體結合域)決定感染人類能力的5個關鍵氨基酸(殘基),與特殊類SARS冠狀病毒rs3367的對應氨基酸之間存在着明顯的參照關係,被作為參照對象的病毒rs3367是已知的跨物種傳播能力最強的罕見的類SARS冠狀病毒。
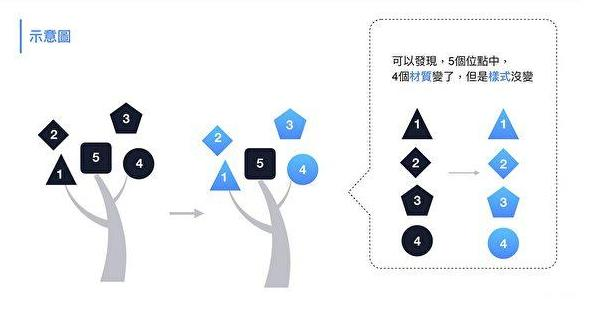
2。對比新冠與rs3367的RBD五個關鍵氨基酸:
它們的第五個關鍵氨基酸相同,均為酪氨酸Y;
它們的第四個關鍵氨基酸也相同,均為天門冬酰胺N;
它們的第二個關鍵氨基酸亦相同,均為苯丙胺酸F;
它們的第三、第一個關鍵氨基酸不同。
新冠的第三個關鍵氨基酸是麩酰胺酸Q,rs3367的第三個關鍵氨基酸是天門冬酰胺N,二者雖不相同,但它們的幾個理化屬性都非常相似或接近。

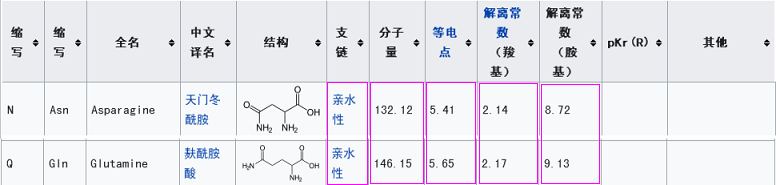
新冠第一個關鍵氨基酸是亮氨酸L(也稱白氨酸),rs3367的第一個關鍵氨基酸是絲氨基酸S,二者不同,但有一定的共性,它們都是不帶電荷或電荷中性的氨基酸,同時,它們的解離常數也比較接近。

3。新冠RBD的五個關鍵氨基酸中,有三個與rs3367相同,即第五、第四、第二關鍵氨基酸。這樣高的重複度,無法用自然、偶然、巧合等說辭來解釋。(這或許也意味着,就“自然演化偽裝性”而言,新冠其實還只是一個半成品)
4。新冠直接抄襲、復用了rs3367五個關鍵氨基酸中的三個,替代了另外二個:
參照rs3367第三個關鍵氨基酸-天門冬酰胺N,以與天門冬酰胺N理化屬性非常接近的麩酰胺酸Q為新冠的第三個關鍵氨基酸;
參照rs3367的第一個關鍵氨基酸-絲氨基酸S,在一定範圍內挑選並實驗確定了新冠的第一個關鍵氨基酸-亮氨酸L。
5。在新冠RBD5個關鍵氨基酸的設計過程中,可能也參照了Sars-Cov、rsSHC014的關鍵氨基酸組合及RBD結構。Sars-Cov、rsSHC014、rs3367都是罕見的能夠跨物種傳播,可感染人特殊冠狀病毒。
6。目的明確的關鍵氨基酸參照設計使新冠繼承了rs3367的強大跨物種傳播能力,特別是,它的刺突蛋白也能與人類細胞受體ACE2發生強相互作用並良好結合,新冠具有不亞於,甚至明顯強於SARS的人體細胞感染能力。
7。新冠刺突蛋白RBD決定人類感染能力的5個關鍵氨基酸不是隨機突變、無目的自然演化產生的,它們是基於明確的設計目標,參照、復用、替代特定病毒rs3367的關鍵氨基酸,人為確定的。
我要衷心感謝所有關注本文,參與討論,指出文中錯誤、不當,予我批評、建議的讀者朋友們。
同時,我也非常非常希望,科學、學術界的同仁、朋友們,能夠注意到本文,對上述發現、事實、判斷進行核查、確認、肯定或予以批駁、指錯、糾正,以利于澄清真相,或在此基礎上展開更深入的研究。
接下來,我們要從一對姐妹病毒說起。
姐妹病毒:CoVZC45、CoVZXC21是已知的與新冠病毒(SARS-CoV-2)“血緣”關係最接近的兩個冠狀病毒。類SARS冠狀病毒CoVZC45,2017年2月分離自舟山蝙蝠,基因序列2018年1月上傳至國際基因庫,全名為bat-SL-CoVZC45,GenBank
ID為:MG772933.1。它的姐姐類SARS冠狀病毒CoVZXC21,2015年7月分離自舟山蝙蝠,與妹妹CoVZC45同一天上傳至國際基因庫,全名是bat-SL-CoVZXC21。
CoVZC45與新冠(SARS-CoV-2)基因組(基因序列)的相似度是87.5%(我用Blast比照的結果是89.12%),CoVZXC21與SARS-CoV-2的相似度是87.3%。這對姐妹彼此的相似度是97.48%。在絕大多數情況下,有關CoVZC45的內容同樣適用於CoVZXC21。
相比之下,SARS-CoV(非典、薩斯)與SARS-CoV-2的相似度只有78.7%,比姐妹病毒低近10個百分點。

Sars-Cov(紅)、CoVZC45(藍)、CoVZXC21(紫)與Sars-Cov-2(2019-nCov)基因序列一致性對照圖

RaTG13、Sars-Cov、CoVZC45、WIV1等冠狀病毒與Sars-Cov-2(2019-nCov)基因序列一致性對照圖。2019-nCov是新冠的早期命名。
注意上圖中的WIV1,它就是本文的主人公rs3367(或者說它等價於rs3367)。
最近媒體頻頻提起的RaTG13不是新冠的近親。RaTG13與SARS-CoV-2相似度雖然高達96.2%,但它只有基因序列,沒有病毒毒株實證,它的基因序列是所謂“分析得出”的,其實很可能就是“創作”出來的,它沒有嚴肅的證據價值和學術討論價值;而且,就算它真實存在,它與新冠也沒有時間進化關係,新冠不可能由它進化而來。關於RaTG13與新冠的進化無關性,南方醫科大學2020年2月20日的論文“新型冠狀病毒SARS-CoV-2的變異和進化分析”已經給出了明確說明。該論文的一個地址:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7086142/
(順帶提一下,我認為,最近媒體高調宣揚RaTG13的作法有有意誤導的嫌疑,這等於轉移視線,客觀上起到了掩護真正秘密的作用。)
如果新冠是自然進化產生的,它最可能是由CoVZC45或它的姐姐進化而來的,這也是新冠進化最近、最快捷的途徑。但是這對姐妹病毒與新冠之間,仍然橫着一道進化的天塹。觀察前面兩個插圖,可以注意到,除RaTG13外,圖中其它病毒與新冠在S蛋白位置都存在着鴻溝般的巨大(一致性)落差。姐妹病毒要進化為新冠,必須完成諸多特定突變,消除它們與新冠在S蛋白上的巨大差異。CoVZC45與新冠其它蛋白的相似度都不低於94%,但二者S1蛋白(S蛋白的前半部分)的相似度卻猛降為69%。這決定了從CoVZC45到新冠的“演變”,是一個極不均衡、極為罕見、非常非常不自然的“自然進化”過程。更不可思議且又曠絕古今的是,這一本應漫長修遠、艱辛無比的“自然進化”過程,居然只用了幾年的時間就完成了(如果從姐妹病毒被發現的前後算起)。
自然界的冠狀病毒約有一百種,絕大多數天然冠狀病毒不能進入人體細胞,無法感染人類。大自然設置了冠狀病毒的傳播屏障:將S1蛋白決定宿主感染能力的重要部位設置為高度保守區域,這些部位的氨基酸通常不會發生突變。S1蛋白重要部位的穩定性使絕大多數冠狀病毒在漫長的歲月里始終無法跨越S1蛋白的進化天塹,它們只能感染固定的動物宿主,難以跨物種傳播,感染人類。
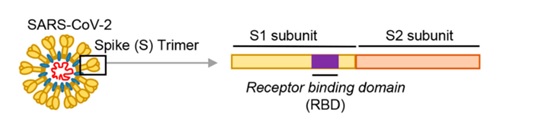
冠狀病毒能否進入宿主細胞,感染宿主,取決於它有沒有打開宿主細胞(鎖)的“鑰匙”。如果有匹配的細胞“鑰匙”,它就能與宿主細胞表面的相關受體(相當於細胞鎖)結合,繼而進入宿主細胞。冠狀病毒的細胞鑰匙就是它的S蛋白,即Spike蛋白,或叫刺突蛋白。刺突蛋白包括相連的兩個部分(兩個亞基),最外部的是S1蛋白,S1蛋白與病毒包膜之間的是S2蛋白。S2蛋白也叫膜融合亞基(參與新冠病毒與細胞的膜融合),它相當於鑰匙的手柄部分,S1蛋白是受體結合亞基,它負責與細胞表面的受體結合,相當於鑰匙的齒面部分。S1蛋白中有一個區域叫做受體結合域(Receptor
Binding
Domain),簡稱RBD,RBD是S1蛋白與細胞受體發生接觸的部分,它相當於齒面外側的鑰齒部位。RBD中有14個氨基酸與宿主細胞受體ACE2直接發生接觸,這14個氨基酸中,至關重要的是五個,它們決定刺突蛋白能否與ACE2結合,這五個關鍵氨基酸就是冠狀病毒打開宿主細胞的關鍵鑰齒。
註:ACE2,即Angiotensin
Converting
Enzyme2,血管緊張素轉換酶2,是細胞表面的一個膜蛋白,廣泛存在於脊椎動物的呼吸、消化、血液、泌尿、生殖、視覺等系統的器官、組織內。ACE2可介導與之發生結合的病毒進入它所附着的細胞內部。ACE2也是腎素-血管緊張素系統(RAS)中的一個關鍵酶;hACE2,即human
ACE2,人體細胞ACE2受體。

S1蛋白與宿主細胞受體(如ACE2)結合成功後,病毒可進而通過“胞吞”(Sars-Cov的方式)或“膜融合”(Sars-Cov-2的更高效的方式)兩種方式之一進入宿主細胞。
可感染人類,並產生疾病症狀的冠狀病毒已知有7種,其中包括SARS(Sars-Cov)和新冠(Sars-Cov-2)。除這7種病毒外,還有兩個很特別的冠狀病毒:rsSHC014和rs3367,它們也能與hACE2(human
ACE2)結合,進入人體細胞,但它們不會使人發病,且對人體無害。
RsSHC014,也稱作SHC014-Cov或SHC014病毒,GenBank ID為: KC881005.1。
rs3367,也叫WIV1病毒(SL-CoV-WIV1),GenBank ID為: KC881006.1。它在本文第二個貼圖中出現過。
RsSHC014、rs3367都搜集自雲南昆明中華菊頭蝠(亦稱中華馬蹄蝠)的腸道與糞便樣本,其病毒株分離獲得時間同為2011年4月,它們的基因序列上傳至國際基因庫的時間同為2013年4月。
RsSHC014、rs3367與SARS-CoV的基因組相似度均為95%,被認為極可能是SARS-CoV的自然進化來源。rs3367的RBD(Receptor
Binding
Domain,受體結合域)與SARS-CoV接近程度相當高,在RBD與宿主受體ACE2直接接觸的14個位點中,rs3367與SARS-CoV在11個位點上氨基酸相同,雖然另有三個位點氨基酸不同,但rs3367仍能與hACE2良好結合併進入人體細胞。相比之下,在RBD14個直接接觸位點中,RsSHC014與SARS-CoV在7個位點上氨基酸不同,但2015年秋拉爾夫·S·巴里克、Vineet
D
Menachery、石正麗、葛行義等人的著名實驗證明,雖然與Sars-Cov有一半RBD接觸位點不同,但RsSHC014的刺突蛋白仍然能與hACE2良好結合。這也說明,可與hACE2良好結合的關鍵氨基酸組合是不唯一的。
相比RsSHC014,rs3367更非同尋常,它具備強大的跨物種傳播能力,它能感染的動物包括(但不限於):人類、果子狸、貉、恆河猴、雪貂、水鼬、貓、蝙蝠、老鼠。
對普通民眾來說,rs3367和RsSHC014是兩個陌生的名字,但在冠狀病毒研究領域,它們確非無名之輩,在病毒跨物種傳播研究領域,它們更是極為重要的研究對象。它們的重要性主要在於其S(Spike)蛋白,即刺突蛋白。對它們的研究在2016年春之前就已經相當深入,並已取得了多個重大成果。我要列舉幾個與rs3367或RsSHC014緊密相關的研究工作。
2013年10月,
石正麗、Peter Daszak、葛行義等人發表了一篇重要論文:”Isolation and characterization of a
bat SARS-like coronavirus that uses the ACE2
receptor”,論文地址:https://www.nature.com/articles/nature12711
該論文對rs3367(實驗使用的SL-CoV-WIV1與rs3367毒株有99.9%的序列一致性,本文將它們視作同一種病毒)進行了深入研究,證實了rs3367或WIV1的跨物種傳播能力:它可與細胞的ACE2受體結合,並以此進入人類、果子狸、中華馬蹄蝠的細胞。該論文證實了,自然界中存在與Sars-Cov一樣可跨物種傳播的類Sars冠狀病毒,它被認為是Sars-Cov起源於自然界的有力證明。
2015年11月,Ralph S Baric、Vineet D Menachery、石正麗、葛行義等人發表了著名的病毒合成實驗論文,參與論文的包括美國、中國、瑞士三國的大學、研究機構、政府部門。論文地址:
https://www.nature.com/articles/nm.3985
這次研究最重要的實驗成果是,用RsSHC014的刺突蛋白和Sars-Cov-MA15(一種實驗室多次傳代培育的可感染小鼠並使其致病的Sars-Cov病毒變異體)的病毒主幹合成了一種人工改造病毒SHC014-MA15,這一實驗室改造的嵌合病毒能使人、鼠發病,並可使實驗小鼠致死。這次實驗為改造致病性病毒開創了道路。SHC014-MA15相當於Sars-Cov-2的一個早期原型,它們的基本原理是相同的,區別在於,Sars-Cov-2比SHC014-MA15技術上更複雜,功能更豐富、強大,它還有一定的“自然進化”偽裝性。
2016年3月,Ralph S. Baric、Vineet D. Menachery等人又發表了一篇研究rs3367(WIV1)的論文。論文地址:https://www.pnas.org/content/113/11/3048
這一次,研究者們用rs3367(WIV1)的刺突蛋白與Sars-Cov-MA15合成了另外一種嵌合病毒WIV1-MA15。實驗證明,WIV1-MA15能夠感染人體細胞,它在呼吸道、體內大量複製並使人發病,但症狀不及Sars嚴重。實驗者還再一次研究了嵌合病毒對人類的致病能力,以及對該病毒應用抗體治療的效果。2015年它們對SHC014-MA15也做過相關研究。這是Ralph
S. Baric、Vineet D. Menachery等人再一次使用嵌合方式改造出人類致病病毒並進行研究。
上述兩篇論文的第一作者都是Vineet D. Menachery,通訊作者都是Ralph S. Baric。二人都是北卡羅來納大學教堂山分校的病毒學家、生物醫藥學家,同時,他們也都是瑞德西韋(Remdesivir)的研發人員。
我們可以從相關研究中得到一些啟示。實驗室改造病毒,使之跨物種傳播的首要環節是換鑰匙或配鑰匙,也就是把不能打開人體細胞(即不能與人類細胞受體結合)的刺突蛋白(如CoVZC45或CoVZXC21等絕大多數冠狀病毒的刺突蛋白),替換或改造成可打開人體細胞的刺突蛋白(如Sars-Cov、rs3367、rsSHC014的刺突蛋白)。要得到一把好用的“鑰匙”,可以把鑰匙整個換掉,也可以只換齒面或只修磨鑰齒。可以只處理關鍵的幾個鑰齒,也就是改造刺突蛋白RBD(Receptor
Binding Domain)中的五個關鍵氨基酸。
作了很長的鋪墊,現在可以說新冠、rs3367二者5個關鍵氨基酸之間的關係了,這其中需要涉及姐妹病毒CoVZC45。
新冠刺突蛋白RBD的五個關鍵氨基酸依次為:
亮胺酸L(451),苯丙胺酸F(482),麩酰胺酸Q(489),天門冬酰胺N(497)和酪胺酸Y(501)。
氨基酸名稱、縮寫字母后的數字是該氨基酸在刺突蛋白的氨基酸序列中的序號。
上述關鍵氨基酸序號是基於長度為1269的新冠刺突蛋白(簡記為Spike_1269)而言的,如果選用長度為1273的新冠刺突蛋白(簡記為Spike_1273),那麼五個關鍵氨基酸依次為:
亮胺酸L(455),苯丙胺酸F(486),麩酰胺酸Q(493),天門冬酰胺N(501),酪胺酸Y(505)。
Spike_1269與Spike_1273的關鍵氨基酸相同,只是序號相差4,這是它們的氨基酸序列長度相差4造成的。在Spike_1269氨基酸序列的141、142兩個位點之間插入四個氨基酸LGVY,就得到了Spike_1273,二者其它對應位點的氨基酸完全相同。使用Spike_1269或Spike_1273,對本文來說是等價的。
CoVZC45對應位置上的五個關鍵氨基酸為:
絲氨酸S(446),空缺,絲氨酸S(470),纈胺酸V(478),酪氨酸Y(482)。
CoVZC45、Sars-Cov-2關鍵氨基酸的對照情況如下圖:


註:CoVZC45的Spike蛋白NCBI地址
https://www.ncbi.nlm.nih.gov/protein/AVP78031.1
不難發現,CoVZC45、新冠二者只有第五個關鍵氨基酸相同,同為酪氨酸Y,而且,CoVZC45第二個關鍵鑰齒氨基酸缺失!如果CoVZC45要演化為新冠,它必須:
在第二個關鍵位點處突變增生出一個苯丙胺酸F;
將第一個關鍵氨基酸-絲氨酸S(446)突變、演化為亮胺酸L;
將第三個關鍵氨基酸-絲氨酸S(470)突變、演化為麩酰胺酸Q;
將第四個關鍵氨基酸-纈胺酸V(478)突變、演化為天門冬酰胺N;
保持第五個關鍵氨基酸-酪胺酸Y不變。
另外,還可以注意到,兩病毒的關鍵氨基酸有一定的序號錯位,這是CoVZC45的刺突蛋白氨基酸序列比Sars-Cov-2短造成的,這需要CoVZC45變異增生出一定數量的氨基酸,消除氨基酸序列長度差異及氨基酸序號錯位,這無疑將加大CoVZC45自然演化為新冠的難度。
下面是rs3367的五個關鍵氨基酸:
絲氨酸S(443),苯丙胺酸F(473),天門冬酰胺N(480),天門冬酰胺N(488),酪胺酸Y(492)。
註:
rs3367的Spike蛋白NCBI地址
https://www.ncbi.nlm.nih.gov/protein/AGZ48818.1
將三個病毒的關鍵氨基酸匯總於下表。

從上表容易觀察到:
1。新冠與rs3367的第五個關鍵氨基酸相同,都是酪胺酸Y;
2。新冠與rs3367的第四個關鍵氨基酸也相同,都是天門冬酰胺N;
3。新冠與rs3367的第二個關鍵氨基酸亦相同,都是苯丙胺酸F;
即,新冠與rs3367的第五、第四、第二個關鍵氨基酸都相同。這兩個病毒在RBD五個關鍵位點中的三個位點上氨基酸相同,這是極不正常的。
它們之間的關聯還不僅如此。
新冠的第三個關鍵氨基酸是麩酰胺酸Q,rs3367的第三個關鍵氨基酸是天門冬酰胺N,二者雖不相同,但它們的幾個理化屬性都“很巧合地”非常相似或接近。


新冠第一個關鍵氨基酸是亮氨酸L(白氨酸),rs3367的第一個關鍵氨基酸是絲氨酸S,二者亦不同。這兩個氨基酸的相似度雖不及第三個關鍵位點的情況,但它們仍有一些共性:二者都是不帶電荷或電荷中性的氨基酸;二者的解離常數也比較接近。


在替代rs3367的第一個關鍵氨基酸-絲氨酸S時,替代候選不僅需要與絲氨酸S有一定的相似性,而且,它還要適應、協調第三個位點上從天門冬酰胺N=>麩酰胺酸Q的替代,使這二個位置上的替代整體上維持RBD原有的空間結構,以及靜電、范德華力等屬性。因此,新冠的第一個關鍵氨基酸-亮氨酸L不便機械參照,它需要在一定範圍內挑選、適配,並通過實驗予以確定。第一關鍵氨基酸的選拔標準可能包括:
1。與絲氨酸S的電荷、酸鹼屬性相似,解離常數相對接近;
2。與新的第三關鍵氨基酸-麩酰胺酸Q,及其它三個復用的關鍵氨基酸的組合能維持RBD與hACE2的良好結合能力。
另外,新冠的設計者應該掌握着不為我所知的論文成果,並擁有相關經驗積累,他們將籍此從一個精簡的候選範圍內快捷地確定出亮氨酸L。
如果新冠是由CoVZC45自然演化產生的,那麼,CoVZC45在五個關鍵氨基酸位點的演化情況為:
在第二個關鍵位點突變增生出與rs3367第一位點相同的苯丙胺酸F;
第四個關鍵位點的纈胺酸V(478)突變、演化為與rs3367第四位點相同的天門冬酰胺N;
第三個關鍵位點的絲氨酸S(470)突變、演化為與rs3367第三位點的天門冬酰胺N理化屬性非常相似的麩酰胺酸Q;
第一個關鍵位點的絲氨酸S(446)突變、演化為亮胺酸L;
保持第五個關鍵位點的酪胺酸Y(482)不變(但它的位置序號將變為501或505,它的前面將有若干新增生的氨基酸)。
上述四項突變、進化都發生在刺突蛋白的高度保守區域,通常,高度保守區域內的氨基酸是很少發生突變的。不論其它位置的突變,僅四個關鍵氨基酸的定向精準突變,及其位置序號的準確遷移,就是幾十年、幾百年,甚至幾千年。。。都無法完成的。
此外,舟山群島冠狀病毒CoVZC45,怎麼偏巧就進化出了和雲南冠狀病毒rs3367相同或高度相似的關鍵氨基酸?CoVZC45的進化模仿目標,為什麼恰好是已知跨物種傳播能力最強大的病毒rs3367?為什麼也恰巧是部分病毒學家反覆研究、實驗過,對其瞭如指掌的一個特殊病毒?該如何解釋這種種巧合?這樣偶然又偶然的事,自然發生的幾率有多大呢?
新冠決定人類感染能力的五個關鍵氨基酸不是隨機突變、無目的自然演化產生的,它們是參照極為特殊的病毒rs3367,通過氨基酸復用、定向挑選替代,hACE2結合實驗等過程選定的。


再簡單概括一下新冠五個關鍵氨基酸可能的確定過程:
1。以rs3367的五個關鍵氨基酸為新冠關鍵氨基酸的初始原型,並復用、保留第五、第四、第二個關鍵氨基酸;
2。將第三個位點的天門冬酰胺N替代為理化屬性非常相似的麩酰胺酸Q;
3。在四個位點關鍵氨基酸已確定的前提下,嘗試替代第一關鍵位點的絲氨酸S。先通過相關條件(如電荷、酸鹼屬性、解離常數的接近度)確定候選範圍,再試驗代入候選者的RBD與hACE2的結合能力。實驗發現,以亮胺酸L替代絲氨酸S後,RBD仍保持了與hACE2的良好結合能力,以亮胺酸L為新冠的第一關鍵氨基酸。
至此,新冠的五個關鍵氨基酸都已確定。
以上過程與實際確定過程之間肯定存在或多或少的不同,但這些細節上的出入並不重要。
關於五個關鍵氨基酸、RBD結構、RBD與hACE2的結合效果,新冠與Sars-Cov的對照情況如下:
1。新冠與Sars-Cov的五個關鍵鑰齒氨基酸只有第五個相同,其它四個都不相同,但這四對相異氨基酸每一對的疏水性和靜電極性都非常相似;
2。雖然有四個關鍵氨基酸不同,但兩者RBD(受體結合域)的3-D結構幾乎沒有明顯差異,或者說,兩者RBD的空間形態高度同構;在與人類受體的接觸界面上,兩個RBD結構體的范德華力(一種分子間的電性引力)和靜電作用效果非常相似;
3。與SARS一樣,新冠的RBD也能與人類細胞受體ACE2發生強相互作用並良好結合,新冠具有不亞於SARS的人體細胞感染能力。

SARS-Cov與Sars-Cov-2刺突蛋白關鍵氨基酸異同,及空間結構示意圖
新冠與Sars-Cov的上述對照結果,很可能也適用於新冠與rs3367,這一猜測有待後續的研究驗證。
介紹一下支撐新冠、Sars-Cov上述對比結果的兩篇相關論文。
論文一。2020年1月21日,來自中國科學院上海巴斯德研究所等單位的徐心恬、陳萍、王靖方等學者在SCIENCE
CHINA Life
Sciences(《中國科學:生命科學》)上發表了一篇論文,題為“源於武漢爆發的新型冠狀病毒的進化及其棘突蛋白對人類傳播風險的建模”(Evolution
of the novel coronavirus from the ongoing Wuhan outbreak and modeling
of its spike protein for risk of human transmission)。論文地址為:
https://link.springer.com/content/pdf/10.1007/s11427-020-1637-5.pdf
論文指出:
a)儘管新冠與SARS-CoV二者S蛋白的總體同源性較低,但二者的RBD區域卻有較高的同源性;
b)令我們驚訝的是,儘管替換了五個重要的界面氨基酸殘基中的四個,但新冠仍與人體ACE2有着顯著的結合親和力;
c)進一步觀察發現,新冠的S蛋白和SARS-CoV的S蛋白在RBD域具有幾乎相同的三維結構,在相互作用界面上保持了相似的范德華力和靜電性質。
論文二。2020年2月19日,美國德克薩斯大學奧斯汀分校Jason
S McLellan團隊,及國家過敏和傳染病研究所的研究人員在Science雜誌上聯合發表了題為“Cryo-EM Structure of
the 2019-nCoV Spike in the Prefusion Conformation”的論文。論文地址為:
https://science.sciencemag.org/content/367/6483/1260
論文指出:
a) 2019-nCoV與SARS-CoV的RBD存在一定的構象差異,但當按某一角度對齊時,二者就呈現出較高程度的結構同源性。
b) 兩種病毒的S1蛋白與ACE2的複合體非常相似;
c) 2019-nCoV的S1蛋白與ACE2的結合親和力是Sars-Cov的10-20倍。
最後,我們將刺突蛋白RBD關鍵氨基酸的確定過程延展,設想一下新冠實驗室改造的可能流程:
將CoVZC45的主幹與Sar-Cov(或rs3367、rsSHC014)的(擴展)RBD嵌合,得到新冠的原型病毒。原型病毒已具備感染人的能力;
參照rs3367、rsSHC014的關鍵鑰齒氨基酸,修改原型病毒的關鍵鑰齒氨基酸,確定新冠最終的五個關鍵鑰齒氨基酸;
參照rs3367、rsSHC014、Sars-Cov等病毒的RBD及S1蛋白,編輯新冠RBD及S1蛋白的其它位置,模糊嵌合操作痕跡;
參照Sar-Cov、HIV-1、埃博拉、HEV71等具備特殊功能的病毒,進行其它功能增益(Gain-of-Function)改造,包括複製能力、擴散能力增強,設計、實現免疫破壞力、抗免疫能力、免疫干擾能力等等;
進行其它基因編輯及實驗室痕跡模糊化處理。
關於新冠的功能增益,及為實現各項功能增益而引入的相應實驗室特徵“指紋”,我去年的一篇文章“新冠君,你額頭的Lab金印洗得掉麼?”中的第3~第6部分中有一些總結,有興趣的讀者可參考。
(正文完)
原文地址:新冠RBD5個關鍵氨基酸抄襲、修改自rs3367
相關文章:
新冠君,你額頭的Lab金印洗得掉麼?
深入分析Lyons-Weiler“新冠來自實驗室”一說
實驗室合成、編輯SARS-CoV-2簡明教程
SARS-CoV-2(新冠)是實驗室生成的























