接续:连系新冠病毒与Ralph S. Baric的双纽带(中)
新冠病毒决定ACE2结合能力,决定细胞进入(感染)能力,决定宿主范围的五个RBD关键氨基酸是人为设计的,有人参照WIV1病毒的关键氨基酸,通过氨基酸重用和等价、等效替代,设计出了新冠病毒的关键氨基酸。人为设计的新冠病毒的关键氨基酸,与WIV1(rs3367)病毒的关键氨基酸高度等价、等效(三个相同,一个高度等价,整体应该高度同构,与ACE2结合高度等效),这两个病毒关键氨基酸的高度关联,高度等价、等效性是以下三项“巧合”的内在原因:
1)新冠病毒、WIV1(rs3367)病毒的跨物种感染能力都极为强大,难分伯仲。
2)新冠病毒、WIV1(rs3367)病毒的宿主范围都极为广泛,而且,它们的宿主范围高度雷同,或者说,它们能感染的物种高度重合。
3)新冠病毒、WIV1(rs3367)病毒的刺突蛋白都极为适宜结合hACE2(human ACE2),它们的刺突蛋白与hACE2的结合亲和力都极为强大。
本系列上篇文章已经详细介绍、说明了“巧合”1)、2),第3)项“巧合”的依据如下:
a)本系列中篇文章中的论文A-2(Ralph S. Baric团队2016年3月14日的PNAS论文)以小鼠体内实验证明:WIV1病毒刺突蛋白与hACE2的结合亲和力远强于它与mACE2的结合亲和力,WIV1-CoV(WIV1的实验室克隆)及WIV1-MA15(刺突蛋白来自WIV1的实验室嵌合病毒)两种病毒在表达hACE2的转基因小鼠(mACE2转基因为hACE2的小鼠)肺中的复制滴度,比它们在普通小鼠肺中的复制滴度高100倍!这两种病毒只能使普通小鼠出现轻微临床症状,但它们能使表达hACE2的转基因小鼠体重减轻超过10%;它们在转基因小鼠大脑中的复制比在肺中更强劲,使部分转基因小鼠患上了致命性脑炎。相关内容可参见中篇文章论文A-2要点7)。
b)澳大利亚弗林德斯大学的论文:新冠刺突蛋白与ACE2结合亲和力的跨物种模拟比较及其对病毒起源的指示(2020年5月13日发表于预印本平台arxiv,2021年6月24日正式发表于Nature Science),通过分子动力学定量模拟研究,计算出了新冠S蛋白(刺突蛋白)与各物种ACE2相互作用的结合能(binding energies for the interactions),各物种ACE2与新冠S蛋白的结合能从高到低依次为:人类 > 穿山甲 > 狗 > 猴子 > 仓鼠 > 雪貂 > 猫 > 老虎 > 蝙蝠 > 麝猫 > 马 > 牛 > 蛇 > 老鼠。定量模拟计算结果表明:在14个对照研究物种中,与新冠病毒刺突蛋白结合能力最强的物种ACE2,是hACE2!
https://www.nature.com/articles/s41598-021-92388-5
其实还有第四项“巧合”:新冠病毒、WIV1病毒都具有泛组织、器官感染能力。这当然首先与ACE2的泛组织、器官存在性有关;它应该同时与新冠RBD关键氨基酸的人为设计有关,因为这一人为设计赋予了新冠病毒强大的hACE2结合能力,使它能够非常有力、高效地结合人体各个组织、器官细胞的跨膜糖蛋白受体--ACE2,非常有力、高效地感染人体各个组织、器官(的细胞)。
是谁参照WIV1(rs3367)病毒的关键氨基酸,通过复用和等价、等效替代,设计出了新冠病毒的关键氨基酸?
设计出新冠病毒关键氨基酸的人,肯定对WIV1(rs3367)病毒,对关键氨基酸,都做过深入研究。
有一个病毒学家,及他领导的科学团队,不仅对WIV1(rs3367)病毒、对冠状病毒的RBD关键氨基酸都做过深入的研究,而且,还同时满足以下五个条件:
1)反复、深入研究过WIV1(rs3367)病毒;
2)“无数次”研究过冠状病毒的RBD(Receptor Binding Domain,受体结合域)、RBD的关键氨基酸,对它们与ACE2,特别是与hACE2的作用机制了如指掌;
3)有着长期的,极其丰富的冠状病毒改造、合成经验,功能增益研究经验,无数次人工合成自然冠状病毒(克隆)、常规改造冠状病毒、功能增益性改造冠状病毒;
4)多次实施RBD关键氨基酸的改造、替代实验,研究它们的改变对物种感染能力,包括对人体细胞感染能力的影响,改造、培育出过多种可跨物种传播的冠状病毒,如可感染人类和灵长类动物的冠状病毒;
5)曾以WIV1(rs3367)病毒为原材料进行功能增益性的冠状病毒嵌合实验,改造出了有人类致病能力的危险病毒WIV1-MA15。
这个病毒学家是谁?就是冠状病毒研究的全球顶级权威Ralph S. Baric。Ralph S. Baric及其团队应该是唯一全部符合以上五个条件的个人、团队。
Ralph S. Baric以模拟、预测病毒自然突变的名义对冠状病毒进行功能增益研究,其众多论文的实质就是在探索、尝试:
如何将不能感染人类的动物来源的冠状病毒改造为可感染人类的冠状病毒,
如何将没有人类致病力的动物来源的冠状病毒改造为可使人类致病的冠状病毒,
如何增强、完善实验室冠状病毒对人类及其它动物的感染、致病能力。
Ralph S. Baric(团队)对关键氨基酸的研究
Ralph S. Baric团队不仅对双纽带之一--WIV1(rs3367)做过反复、深入的研究(中篇文章已经介绍了Ralph S. Baric团队研究WIV1、rs3367的四篇论文),而且对另一纽带--冠状病毒的RBD关键氨基酸也做过极其频繁、极其细致、极其深入、极其透彻的研究。
Ralph S. Baric几乎每一篇论文都要研究冠状病毒的刺突蛋白,研究刺突蛋白的RBD,其研究RBD关键氨基酸的论文非常之多,本文将提供四篇示例。其中,论文B-1、B-2就是中篇文章中的论文A-1、A-2,Ralph S. Baric团队在这二篇论文中同时研究了WIV1病毒和冠状病毒的RBD关键氨基酸。
论文B-1
2015年11月9日,Ralph S. Baric团队在《自然医学》(Nature Medicine)杂志发表了著名的嵌合病毒论文:A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence(一个类似SARS的蝙蝠冠状病毒群显示了产生人类流行疫情的潜力)
https://www.nature.com/articles/nm.3985
该论文就是中篇文章中的论文A-1。WIV1在这篇论文中是病毒主角SHC014的对照病毒。
论文分别比较了WIV1与SARS,SHC014与SARS两对病毒RBD关键氨基酸的异同。论文指出:在刺突蛋白决定ACE2结合能力、细胞进入能力及宿主范围的5个RBD关键氨基酸(残基)中,WIV1病毒与SARS病毒虽然有三个关键氨基酸(1、2、4)不同,但其刺突蛋白仍能与hACE2(human ACE2)有效结合。
WIV1、SARS关键氨基酸对照表。二者的第3、5关键氨基酸相同,第1、2、4关键氨基酸不同。
WIV1是具有人体细胞进入(感染)能力的特殊蝙蝠冠状病毒,其刺突蛋白可有效结合hACE2,这是石正丽团队2013年10月30日的nature论文已得出的结论,前面的描述引用了这一结论。
https://www.nature.com/articles/nature12711
论文接着指出,相比WIV1,SHC014与SARS关键氨基酸差异更大,二者的关键氨基酸无一相同。
SHC014、SARS关键氨基酸对照表,它们的5个关键氨基酸无一相同。
SHC014的RBD关键氨基酸与SARS迥异,它的刺突蛋白能否如SARS的刺突蛋白那样,有效结合hACE2呢?它能否如SARS那样,进入(感染)人体细胞呢?这是该论文要研究的核心问题之一(hACE2结合能力与人体细胞进入能力是等价的)。
为解决上述问题,Baric团队用SHC014的刺突蛋白和SARS-CoV-MA15的骨架构建了嵌合病毒SHC014-MA15,并实施了该病毒对人气道上皮的感染实验。实验结果表明,SHC014-MA15能有效感染人气道上皮组织,并在组织细胞内大量复制。这即是证明了:SHC014的刺突蛋白也能有效结合hACE2,SHC014与WIV1一样,也是具有人体细胞进入(感染)能力的特殊蝙蝠冠状病毒。
注:WIV1、SHC014都有人体细胞进入(感染)能力,同时又都没有人体致病能力,他们都不会使人体产生疾病症状;绝大多数蝙蝠冠状病毒都没有人体细胞进入(感染)能力,因而没有人体致病能力。
所有已知的蝙蝠冠状病毒,无论是否有人体细胞进入(感染)能力,它们统统都没有人体致病能力,不存在已知的有人体致病能力的蝙蝠冠状病毒(发现自蝙蝠的冠状病毒)!
论文B-2
2016年3月14日,Ralph S. Baric团队在PNAS(美国国家科学院院刊)发表了如下论文:SARS-like WIV1-CoV poised for human emergence(类SARS冠状病毒WIV1-CoV对人类有潜在威胁)
https://www.pnas.org/content/113/11/3048
该论文就是中篇文章中的论文A-2。在这篇论文中,Ralph S. Baric团队对比了SARS-WT(即SARS-CoV)、SARS-MA15、WIV1三种冠状病毒与hACE2直接相互作用的14个RBD氨基酸残基,包括五个关键氨基酸残基,见图A;同时深入、细致地对照研究了SARS-CoV、WIV1这两种病毒的刺突蛋白与hACE2的接触、结合模型,特别是442、472、487三个RBD关键氨基酸残基与hACE2的作用情况,见图B。
为便于大家理解,我对图A、图B再作一些补充说明。
SARS-WT,SARS-CoV wild type,指SARS病毒的野生毒株;SARS-MA15,即SARS-CoV-MA15,Ralph S. Baric团队在实验室中培育的SARS-CoV的小鼠适应性变异体,SARS-CoV能感染小鼠细胞,但不会使小鼠产生临床症状,SARS-CoV-MA15则可使小鼠严重致病并致死。
图A是SARS-WT、SARS-MA15、WIV1-CoV三种病毒刺突蛋白RBD与hACE2直接接触的14个氨基酸残基,后二种病毒与SARS-WT不同的氨基酸残基分别以深红或深蓝背景色突出显示,紫红色长条框标出了它们的5个RBD关键氨基酸残基。
SARS病毒的五个关键氨基酸(残基)依次是刺突蛋白的第442、472、479、487、491氨基酸(残基),
WIV1病毒的五个关键氨基酸(残基)依次是刺突蛋白的第443、473、480、488、492氨基酸(残基)。

WIV1、SARS关键氨基酸对照表,它们的第442、472、487三个关键氨基酸残基不同。
图A中14个氨基酸的序号基于SARS,WIV1的氨基酸都向前移了一位,以与SARS的对应氨基酸对齐。
图B左图是SARS病毒刺突蛋白S1亚基(也叫受体结合亚基,S1亚基前端为RBD)与hACE2的作用模型,图B右图是WIV1病毒刺突蛋白S1亚基与hACE2的作用模型。
图B两子图中,右侧的双螺旋结构是hACE2,其上的橙黄色部分是hACE2自身的接触残基;
图B两子图中,左侧是两种病毒刺突蛋白的S1亚基,SARS的S1亚基以灰黑色表示,WIV1的S1亚基以蓝色表示。红色图案代表两病毒相同的RBD氨基酸接触残基,圆圈处是二者三个不同的关键氨基酸残基(442、472、487)与hACE2残基的作用情况。
论文B-3
2007年12月19日,Ralph S. Baric团队于Journal of Virology(病毒学杂志)在线发表了一篇论文:Mechanisms of Zoonotic Severe Acute Respiratory Syndrome Coronavirus Host Range Expansion in Human Airway Epithelium(人畜共患SARS冠状病毒在人气道上皮中扩大宿主范围的机制)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2258931/
https://journals.asm.org/doi/10.1128/JVI.02041-07

Ralph S. Baric仍是论文的通讯作者。
这篇论文主要做了两件事:
1)演示了如何对病毒的关键氨进行人为替换,如何在人气道上皮中培养、筛选病毒,如何将不能感染人类的动物来源的冠状病毒简易、快捷地改造、培育为可感染人气道上皮的,可跨物种感染、传播的冠状病毒。
具体而言,是对果子狸冠状病毒SZ16的第三关键氨基酸进行了人为替换,并将中间病毒放到人气道上皮中培养、筛选,成功改造、培育出了两种可感染人类和灵长类动物的冠状病毒。
2)极为深入地研究、解读了关键氨基酸与hACE2的作用机制,以及关键氨基酸替代、改变对ACE2结合能力、细胞感染能力的影响机理。
论文病毒改造的原材料是果子狸(civet,有时译作麝香猫)类SARS冠状病毒SZ16(SARS-CoV SZ16),该病毒分离自SARS疫情期间中国广东地区动物市场中的果子狸。SZ16的刺突蛋白与SARS流行病毒株SARS-Urbani的刺突蛋白有18个氨基酸差异,其中16个位于S1亚基(S1亚基是受体结合亚基,S2亚基是膜融合亚基,受体结合域RBD是S1亚基的一部分)。
论文列出了SZ16、SARS-Urbani、SARS-GD03三种病毒株刺突蛋白的氨基酸差异,见下图:
蓝色表示动物(果子狸)来源的氨基酸,黄色表示SARS疫情早期出现的氨基酸,橙棕色表示疫情中期出现的氨基酸,红棕色表示疫情晚期出现的氨基酸。
SARS-Urbani是SARS疫情晚期分离自美国的一个SARS病毒株;
GD03是比Urbani更晚出现的SARS病毒株,它是2004年1月疫情再次零星出现时,分离自一散发广东患者的SARS病毒株。由图可见,它的部分氨基酸似乎出现了返祖现象。
SARS疫情发生于2002年11月16日-2003年9月2日,高峰期为2002年11月16日-2003年7月16日。
研究者首先用SZ16刺突蛋白的基因序列,以及SARS-Urbani刺突蛋白以外部分的基因序列,设计了一个嵌合的基因序列,而后基于嵌合的基因序列,使用反向遗传平台合成、收获了嵌合病毒icSZ16-S(基于基因序列合成病毒,这是反向遗传平台的基本功能)。实验证明,icSZ16-S不能感染Vero E6细胞(非洲绿猴肾细胞系细胞),也不能感染HAE细胞(人气道上皮细胞)。
注:
ic:infectious cDNA,ic前缀表示使用反向遗传平台合成的有生物活性的冠状病毒。SZ16-S表示嵌合病毒icSZ16-S的S蛋白来自SZ16(骨架来自SARS),S蛋白即Spike蛋白,就是刺突蛋白。
HAE细胞:human airway epithelium cells,人气道上皮细胞,包括纤毛上皮细胞、非纤毛上皮细胞以及杯状细胞。
接下来,研究者对icSZ16-S的一个RBD关键氨基酸进行了替换,人为制造了一个氨基酸突变K479N:
即将icSZ16-S刺突蛋白的第479氨基酸--赖氨酸K(来自SZ16),替换为SARS刺突蛋白的第479氨基酸--天冬酰胺N(亦称为天门冬酰胺)。第479氨基酸是SARS及SZ16五个RBD关键氨基酸中的第三个。
SZ16的第479氨基酸是赖氨酸K,SARS-Urbani的第479氨基酸是天冬酰胺N。
基于K479N替换后得到的基因序列,再次使用反向遗传平台,合成、收获了第二个实验室病毒:icSZ16-S 479N。相比不能感染Vero E6细胞的icSZ16-S,icSZ16-S 479N有了一定的“进步”:实验证明,icSZ16-S 479N能感染Vero E6细胞,并能在细胞中低水平地复制,衰弱地传代、传播;icSZ16-S 479N仍然不能感染HAE细胞。
为使icSZ16-S 479N适应HAE细胞,研究者将其放到人气道上皮样本中持续培养,并按一定的策略反复进行传代和优化筛选。
培养、传代、筛选第8天,得到了第三个实验室病毒icSZ16-S K479N D8。相比icSZ16-S K479N,D8在人气道上皮组织中发生了一个适应性变异Y442F:刺突蛋白第442氨基酸由酪氨酸Y变异为苯丙氨酸F;
培养、传代、筛选第22天,得到了第四个实验室病毒icSZ16-S K479N D22。D22在Y442F变异的基础上,又发生了另一个适应性变异L472F:刺突蛋白第472氨基酸由亮氨酸L变异为苯丙氨酸F。
SARS、SZ16刺突蛋白的第442氨基酸就是它们的第一个RBD关键氨基酸,第472氨基酸就是它们的第二个RBD关键氨基酸。也就是说,人为替换第479氨基酸(第三个RBD关键氨基酸)改造出的icSZ16-S 479N,在人气道上皮环境中,先后发生了另外二个关键氨基酸的适应性突变,变异出两种新病毒。
相关病毒关键氨基酸对照表,表中展示了K479N替换、Y442F变异、L472F变异所涉及的关键氨基酸
有一个小小的巧合,新冠病毒、WIV1病毒、icSZ16-S K479N D22病毒的第二个RBD关键氨基酸都是苯丙氨酸F。
S蛋白氨基酸序列长度为1269、1273的新冠、WIV1、SARS、D22五病毒关键氨基酸对照表
能感染人气道上皮(HAE)细胞的病毒已经产生了。
实验证明:
1)icSZ16-S K479N D22能有效感染HAE细胞、Vero E6细胞、DBT-hACE2细胞,并有效复制,但它在三种细胞中的复制能力或多或少弱于icSARS(使用反向遗传平台合成的SARS流行毒株Urbani的克隆毒株);
2)icSZ16-S K479N D8也能感染上述三种细胞,但它在这些细胞中的复制能力或多或少弱于D22;
3)icSZ16-S K479N在HAE细胞和DBT-hACE2中的复制能力低下,复制滴度与D22、D8相差几个数量级;
4)icSARS、icSZ16-S K479N、icSZ16-S K479N D8、icSZ16-S K479N D22都不能感染未转基因的普通DBT细胞。
稍后提供的四病毒对四细胞的感染实验数据图将更形象、具体地展示以上实验结果。
注:
DBT-hACE2是论文研究者设计、制造了一种表达hACE2的转基因小鼠DBT细胞,其细胞的跨膜糖蛋白--ACE2受体被转基因为hACE2。
DBT:Delayed Brain Tumor,延迟脑肿瘤;小鼠DBT细胞,即小鼠延迟脑肿瘤细胞,或称为小鼠星形细胞瘤迟发性脑瘤细胞。
icSARS、K479N、D8、D22对HAE、Vero E6、DBT-hACE2、普通DBT细胞的感染实验数据图。
横坐标:感染后时间,单位为小时;纵坐标:细胞培养物中的病毒滴度,单位为PFU/ml。
注:PFU,Plaque-forming unit,单位体积的病毒形成的空斑数,是代表有活性的病毒粒子浓度的单位。空斑(Plaque)是病毒诱导宿主细胞裂解形成的点状物,可通过显微镜观察。
为研究各病毒RBD及RBD关键氨基酸与hACE2的作用、结合机制,研究者使用蛋白质结构设计、预测工具Rosetta Design生成了SZ16、icSZ16-S K479N、icSZ16-S K479N D8和icSZ16-S K479N D22等病毒的RBD结构模型,并将这些结构模型叠加到SARS Urbani RBD与hACE2相互作用的晶体结构模型上,得到了以上病毒与hACE2相互作用的晶体结构模型。
基于RBD-hACE2相互作用的晶体结构模型,研究者极为深入地分析了各病毒442、472、479、487四个RBD关键氨基酸与hACE2的具体结合或作用情况(没有涉及最保守的第五关键氨基酸,即刺突蛋白的第491氨基酸,这几个病毒的第491氨基酸全都相同,都是酪氨酸Y),解释了不同的RBD关键氨基酸,如何导致了不同的hACE2结合能力,不同的细胞进入能力。具体分析、解读如下:
a)SZ16的第479氨基酸残基--Lys479(赖氨酸K),似乎与hACE2的结合热点残基Lys31和His34存在静电排斥(碰撞),因而其RBD不能与hACE2良好结合,见图B。图B中lys31和His34两个hACE2残基对应的点密集团块为深褐色,表示这两个hACE2残基与附近的RBD残基存在冲突(静电排斥或碰撞)。
b)引入点突变K479N,即将479氨基酸替换为SARS Urbani 的479氨基酸--天冬酰胺N(Asn479)后,479位点与hACE2残基的排斥力被消除,因而icSZ16-S K479N的刺突蛋白能够与hACE2结合,见图C。图C中lys31和His34两个hACE2残基对应的团块为浅绿色,表示它们与周围的RBD残基相互吻合。
c)SARS Urbani 442、479两个RBD关键氨基酸残基分别与两个不同的hACE2残基相互作用(残基442与Lys31相互作用,残基479与His34相互作用),见图A,二对作用互不干扰,互不竞争,因而结合亲和力较强;尽管icSZ16 K479N 的442、479残基与Urbani相同,但这两个残基预计会同时与hACE2残基Asp32作用,而且,残基442预计还会同时与Lys31、Asp32这两个hACE2残基作用,见图C。这种残基作用的交叉竞争削弱了RBD与hACE2的结合亲和力,因而,icSZ16 K479N的刺突蛋白虽然能与hACE2结合,但结合能力较弱。
d)icSZ16-S K479N、SARS Urbani唯一不同的RBD关键氨基酸是第487氨基酸,即第四个RBD关键氨基酸(参见前面的“相关病毒关键氨基酸对照表”)。前者的第487氨基酸是丝胺酸-S(Ser487),它只与一个hACE2残基(Tyr41)结合,见图C;SARS Urbani 第487氨基酸是苏胺酸-T(Thr487),它独自结合了三个hACE残基,而且没有其它RBD残基交叉竞争与这三个hACE残基的结合,见图A(图A似乎看不到与Thr487作用的三个hACE2残基?)。Urbani的487残基与hACE2的氢键强于K479N的487残基与hACE2的氢键,这是Urbani与hACE2的结合亲和力强于icSZ16-S K479N的另一个原因。
e)Rosetta Design模型预测icSZ16-S K479N D8的Y442F突变消除了K479N的442、472残基对hACE2残基的交叉竞争,D8的F442(即Phe442)、N479残基(Asn479)各自与不同的hACE2残基作用(F442结合Lys31,N479结合His34);同时,它的S487残基(Ser487)与hACE2的Tyr41残基之间的相互作用和氢键网络保持不变,见图D。这使得icSZ16-S K479N D8与hACE2的结合能力大大提高,因此,D8在HAE细胞和DBT-hACE2细胞中的生长(感染、复制)比K479N茁壮得多。
f)Rosetta Design模型预测icSZ16-S K479N D8的L472残基(Leu472)无交叉竞争地同时结合了两个hACE2残基(Leu79、Met82),见图D;icSZ16-S K479N D22由于发生了L472F突变(亮氨酸L突变为苯丙氨酸F),预计其F472残基(Phe472)将无交叉竞争地同时结合三个hACE2残基(Leu79、Met82、Tyr83),见图E,Rosetta Design还预测F472残基将与这三个hACE2残基产生强烈的疏水相互作用,进一步加强彼此的结合。因为上述原因,L472F突变增强了RBD与hACE2的结合亲和力,所以,D22在HAE细胞和DBT-hACE2细胞中比D8更具生长优势。
以上各图中,hACE2边缘的点密集团块表示与RBD氨基酸残基相距不超过4Å(1Å=0.1纳米)的hACE2残基,预计它们会与邻近的红色图案表示的RBD氨基酸残基发生相互作用。
在论文前面“材料和方法”中的“SARS冠状病毒尖峰的系统发育分析和计算机建模”小节,论文仿照479替换衍生442、476突变这一模式,提出了如下RBD氨基酸替换研究模式:利用Rosetta Design web server及分子建模工具MacPyMol,对SARS病毒RBD既有氨基酸的各种替换、突变可能性进行模拟,为每个位点氨基酸的替换、改变生成十个其它位点衍生替换、改变的模型,为每个模型再生成十个次级衍生替换、改变模型,如此反复迭代,通过比较前后生成的各模型与hACE2的结合能,从中选出与hACE2结合的最佳关键氨基酸模型或最佳RBD氨基酸模型。
(这段内容在论文的后续部分似乎没有展开)
如果我的理解没有错的话,通过上述建模和算法,Ralph S. Baric团队能得出与hACE2结合的冠状病毒最佳RBD关键氨基酸组合甚至最佳RBD氨基酸序列,所得结果可能被用于设计或辅助设计新冠病毒关键氨基酸,及新冠病毒RBD氨基酸。
在论文Disscussion部分,研究者意犹未尽地写道:
显然,可能存在多种遗传途径来允许人畜共患病SARS冠状病毒宿主范围的扩大,确定其他接触界面点突变是否能增强人畜共患病病毒对HAE细胞(人气道上皮细胞)的感染将是一件有趣的事情。
论文B-3也是一篇SARS相关的功能增益研究论文,它改变了冠状病毒的感染特性和宿主范围,它通过关键氨基酸的人为替换和人为创造的人气道上皮培养环境,用没有人类、灵长类感染能力的果子狸冠状病毒SZ16改造、培育出了可以感染人气道上皮细胞(HAE)和灵长类动物Vero E6细胞的可跨物种感染、传播的冠状病毒icSZ16-S K479N D8和icSZ16-S K479N D22。
D8和D22还能感染BALB/c小鼠(白变种实验室小鼠)的肺细胞,并在小鼠肺中良好生长、复制,不过,它们都不会使BALB/c小鼠产生临床症状。
论文B-4
2008年9月1日(Published online 2008 Jun 25),Ralph S. Baric等人在Journal of Virology发表了论文:Pathways of Cross-Species Transmission of Synthetically Reconstructed Zoonotic Severe Acute Respiratory Syndrome Coronavirus(人畜共患严重急性呼吸综合征冠状病毒的跨物种传播途径)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2519660/
https://journals.asm.org/doi/10.1128/JVI.00818-08
Ralph S. Baric依然是论文的通讯作者。

论文B-4是论文B-3研究的延续。
论文研究了7种病毒对不同细胞的感染能力,它们是:
病毒1:嵌合病毒icSZ16-S,它的刺突蛋白来自果子狸冠状病毒SZ16,骨架来自SARS病毒株Urbani,
病毒2:icSZ16-S K479N,它是对icSZ16-S的479氨基酸实施人为替换(K479N)后得到的病毒,
病毒3:icSZ16-S K479N D22,它是icSZ16-S K479N在人气道上皮上培养、传代、筛选得到的实验室变异体,
病毒4-6:三个SARS病毒的克隆毒株:icSARS、icCUHK-W1、icGZ02,
病毒7:SARS不同毒株的人工混嵌体icGD03-S,它应该是SARS-GD03的刺突蛋白与SARS-Urbani的骨架嵌合而成的。
关于病毒4-6的更多说明:
icSARS是用反向遗传平台合成的SARS-Urbani的克隆,SARS-Urbani是SARS疫情晚期分离自美国的SARS病毒株。
GZ02是SARS疫情早期分离自广州的SARS病毒株。
CUHK-W1是SARS疫情中期分离自香港的SARS病毒株。
GD03是比Urbani更晚的SARS病毒株,它是2004年1月疫情再次零星出现时分离自一散发广东患者的SARS病毒株。
(SARS疫情发生于2002年11月16日-2003年9月2日,高峰期为2002年11月16日-2003年7月16日)
论文详尽地列出了所涉及各病毒刺突蛋白的氨基酸差异,并标出了其它6种刺突蛋白相对于SARS-Urbani刺突蛋白的氨基酸差异数,见图D;
论文还细致地列出了cACE2(civet ACE2)及hACE2或primate-ACE2(灵长类动物ACE2)的所有热点氨基酸残基及与它们发生作用或接触的SARS-Urbani的RBD氨基酸残基,见图E。
前一论文(B-3)研究、实验了相关病毒对HAE细胞(人气道上皮细胞)、Vero E6细胞、普通小鼠DBT细胞、转基因小鼠DBT-hACE2细胞的感染复制情况。论文B-4又引入了另一种转基因小鼠DBT细胞:DBT-cACE2,以进一步研究相关病毒的感染、复制能力,对照分析它们的RBD、关键氨基酸与不同ACE2的作用机制。
DBT-cACE2细胞是将普通小鼠DBT细胞中的ACE2转基因为cACE2(civet ACE2,果子狸或麝香猫的ACE2)而得到的。
相关实验数据见下图。
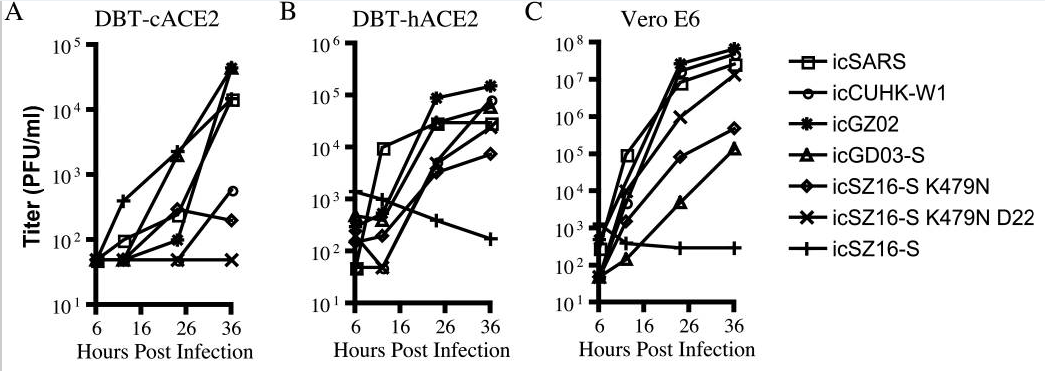
7种病毒对4种细胞中的感染、复制实验数据图。
横坐标是感染后时段,单位为小时;纵坐标是病毒的复制滴度,单位为PFU/ml。
以上实验数据图表明:
a)icSZ16-S K479N、icSZ16-S K479N D22及icCUHK-W1不能在DBT-cACE2细胞中有效复制,或只能低水平复制,而其它病毒,包括icSZ16-S都能在DBT-cACE2细胞中有效复制,见图A;
b)icSZ16-S不能在DBT-hACE2细胞中有效复制,而其它病毒都能在DBT-hACE2细胞中不同程度地复制(K479N复制能力相对较差),见图B;
c)icSZ16-S不能在Vero E6细胞中有效复制,而其它病毒都能在Vero E6细胞中不同程度地复制,GZ02、CUHK-W1、icSARS、icSZ16-S K479N D22在Vero E6细胞中的复制都极为强烈,见图C;
(论文还指出:上述七种病毒皆不能感染未转基因的普通小鼠DBT细胞。)
可见,icSZ16-S与icSZ16-S K479N及icSZ16-S K479N D22在细胞感染、复制能力,物种ACE2结合能力上存在巨大差异。
icSZ16-S、icSZ16-S K479N二者的刺突蛋白只有一个氨基酸不同,即第479氨基酸,icSZ16-S的第479氨基酸是赖氨酸K,而icSZ16-S K479N的第479氨基酸被人为替换为SARS-Urbani的第479氨基酸--天冬酰胺N(人为制造了K479N突变)。刺突蛋白第479氨基酸是第三个RBD关键氨基酸。
icSZ16-S、icSZ16-S K479N D22二者的刺突蛋白有三个氨基酸不同,除了K479N差异外,它们还有另外两个氨基酸差异:Y442F和L472F。刺突蛋白第442、472氨基酸分别是第一、第二个RBD关键氨基酸。

相关病毒RBD关键氨基酸对照表
icSZ16-S、K479N、K479N D22这三个病毒在不同物种ACE2结合能力,不同物种细胞感染、复制能力上的巨大差异就是它们RBD关键氨基酸的差异造成的。
为了解释各病毒与cACE2、hACE2的不同结合能力,研究者使用RosettaDesign和Modeler软件开发了4种病毒(SARS-Urbani、SZ16、icSZ16-K479N、SZ16-K479N D22)刺突蛋白与cACE2、hACE2相互作用的结构模型,深入分析了各病毒与cACE2、hACE2在各个关键氨基酸位点的作用情况,解读了关键氨基酸差异对hACE2结合能力的影响。论文指出:
1)cACE2分子与hACE2分子有两个关键残基(E30和Y34)不同,cACE2的E30和Y34的附加甲基可能会使cACE2结合界面产生明显的突起。SARS-Urbani的RBD能够良好适应hACE2的结合界面,见图A;同时,它又能容纳cACE2的表面突起,见图B。因此,SARS-Urbani对人类和civet(果子狸或麝香猫)有双重宿主适应能力;
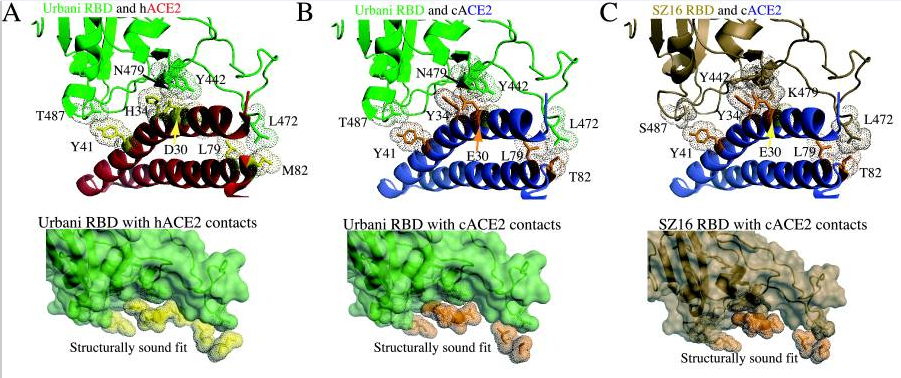
2)与Urbani RBD类似,SZ16 RBD也能容纳cACE2的E30、Y34造成的表面突起,以实现有效结合,见图C;
3)SZ16 K479N中的K479N突变(人为替换)引入的479N(天冬酰胺)重塑了SZ16刺突蛋白的结合界面,促进了其与hACE2的结合,见图D;
4)见图E,479N对SZ16 K479N结合界面的重塑使RBD氨基酸残基(V404、Y440)与cACE2氨基酸残基(E30、Y34)之间产生冲突(绿色表示吻合,褐色表示存在冲突,深褐色表示冲突难以克服的区域),SZ16 K479N RBD无法容纳cACE2的延长突出部分,这阻碍了二者的结合。因此,K479N突变(人为替换)使RBD获得了结合hACE2的能力,但同时失去了结合cACE2的能力;
5)在K479N基础上,Y442F和L472F突变进一步重塑了SZ16 K479N D22的RBD,进一步提高了RBD与hACE2的结合效率,见图F;
6)与SZ16 K479N一样,SZ16 K479N D22的RBD也不能容纳cACE2的延长突出部分,从而使二者无法结合,见图G。
和论文B-3一样,论文B-4也是功能增益研究论文。本文介绍的四篇论文全都是SARS相关的功能增益研究论文。这四篇论文无一例外,全都得到了美国国立卫生研究院(NIH)下属的美国国家过敏和传染病研究所(NIAID)的资助、支持。十几年来,NIAID的所长,一直是现白宫首席医学顾问,声称新冠病毒来自自然界的福奇。
由论文B-3、B-4可知:
早在2007、2008年,Ralph S. Baric对冠状病毒的RBD关键氨基酸,对它们与ACE2,特别是与hACE2的作用机制,就已经研究得极为深入、透彻了;
早在2007,Ralph S. Baric就已经成功实施了关键氨基酸的人为替换,成功实施了冠状病毒的人类组织适应性培养,成功改造、培养出了能感染人体细胞的实验室病毒。
本系列三篇文章的结论
1)有人参照WIV1(rs3367)病毒的关键氨基酸,通过氨基酸复用及等价、等效替换,为新冠病毒设计了一套与WIV1的关键氨基酸高度等价、等效的关键氨基酸。
2)新冠拥有与WIV1高度等价、等效的关键氨基酸,导致了以下“巧合”:
a)新冠、WIV1的跨物种感染能力都极为强大,难分伯仲;
b)新冠、WIV1的宿主范围都极为广泛,而且,它们的宿主范围高度雷同(它们可感染的物种高度重合);
c)新冠、WIV1的刺突蛋白都极为适宜结合hACE2,与hACE2的结合亲和力都极为强大。
3)新冠病毒关键氨基酸的设计者,即新冠病毒的设计者,极有可能就是Ralph S. Baric,或者Ralph S. Baric团队的某个、某些资深成员。
























