(一)
是我在撒謊,還是他們在撒謊?
最危險的,不是自然界中的動物,而是那些在實驗室中編輯、改造病毒基因,人為增強病原體致病能力、傳播能力的人。這本應是一個公民常識。能否樹立這一常識,禁止或高度警惕、防範基因改造、病原體功能增益行為,並採取可靠、有效的措施(如嚴格的立法、完善的公民社會監督系統),關繫到每一個人的安全,關繫到我們子孫後代的安全、健康和幸福,關繫到人類未來的命運。
我們需要真相。
功能增益研究,奧巴馬禁令,禁令撤銷,疫情出現
功能增益研究,也稱為功能獲得性研究(Gain-of-Function,縮寫為G-o-F),是指通過基因編輯、基因改造手段,人為增強病毒(及其它病原體)的致病能力或傳播能力。
鑑於“功能增益研究”存在巨大的潛在危險,鑑於美國及世界各國多次發生實驗室泄漏事故的一再警示,2014年10月22日,奧巴馬總統頒布了一項針對“功能增益研究”的禁令,禁止科學家進行危險病原體的功能增益研究,即禁止在實驗室改造病毒或其它病原體,人為增強它們的致病能力或傳播能力。
++++++
2021年7月27日補註兼修正。奧巴馬禁令實際上是一個暫停令,它是奧巴馬政府於2014年10月17日頒布的,全文可見於:
http://www.phe.gov/s3/dualuse/Documents/gain-of-function.pdf
該暫停令並沒有絕對禁止功能增益研究,它只是暫停了對流感、SARS、MERS相關的功能增益研究的政府資金支持,並要求對功能增益研究進行廣泛、健全、客觀、嚴格的審議及確保聯邦對功能增益研究的有效監督。它允許通過客觀、嚴格的審議,個別批准某些功能增益研究實驗或某些類別的功能增益研究實驗。
++++++
3年後,2017年12月19日,Trump政府撤銷了奧巴馬政府頒布的“功能增益研究”禁令,允許美國科學家重新申請聯邦經費,開展人為增強病毒或病原體致病能力、傳播能力的功能增益研究。
功能增益研究支持者聲稱,該類研究模擬了自然界未來可能發生的危險病毒突變,有預測、預防大流行病的作用。功能增益研究的重要支持者,Trump政府撤銷奧巴馬禁令的主力推手之一,美國國家衛生研究院(National Institutes of Health,NIH)院長弗朗西斯·柯林斯(Francis S. Collins)在禁令解除時說:“功能獲得性研究非常重要,能夠幫助我們識別快速演化的、對公眾健康構成威脅的病原體,並制定有效對策。”
2017年12月撤銷功能增益研究禁令,2019年底新冠疫情發生,這只是個巧合嗎?
自2017年12月到2019年,美國病毒學家們在功能增益研究領域難道一事無成,沒有製造出任何一種危險病毒嗎?美國病毒學家製造出的危險病毒中,肯定沒有新冠病毒嗎?
新冠大疫情發生後,對2017年12月Trump政府重啟“功能增益研究”,對大疫情恰好發生於奧巴馬禁令撤銷、“功能增益研究”重啟兩年後,美國政界、科學界、媒體界上上下下一個個諱莫如深、百般迴避,裝聾作啞、不置一詞,仿佛撤銷禁令,重啟“功能增益研究”這一事實沒有發生過,仿佛這一重大政策改變與新冠大疫情的發生毫無關係,無須進行任何調查、研究、反思、反省。
唯一的例外是前副國家安全顧問博明。 2021年6月8日,在美國國會參議院軍事委員會舉辦的“美國與中國的戰略競爭”聽證會上,博明提出,美國應以身作則,停止功能增益研究,並恢復奧巴馬政府的功能增益研究禁令。博明說:“功能增益研究旨在幫助預測當前的大流行病,但實際上可能反而為這次大流行埋下了種子”。
插貼一張冠狀病毒的結構示意圖,它對理解下面的內容摘要可能有所幫助。
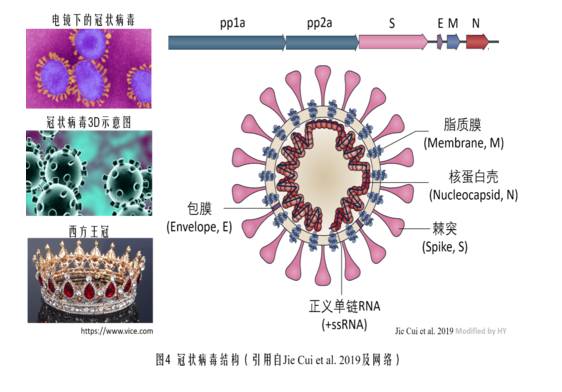
內容摘要 新冠是怎樣被設計成病毒集大成者的
1、RBD關鍵氨基酸設計。參照跨物種傳播能力最強的病毒rs3367,設計出了新冠刺突蛋白(Spike蛋白)RBD(受體結合域)的5個關鍵氨基酸,這5個關鍵氨基酸決定冠狀病毒的人體細胞感染能力和跨物種傳播能力。這一組設計取得了如下效果:
a) 新冠刺突蛋白與hACE2(人類細胞ACE2受體)的結合能力極強,這使得新冠病毒能夠非常容易地進入、感染人體細胞;
b) 相比SARS刺突蛋白與hACE2的結合親和力,新冠刺突蛋白與hACE2的結合親和力提高了10-20倍;
c) 人類ACE2與新冠刺突蛋白的結合親和力,在脊椎動物之中最強(相關對比實驗中,人類ACE2與新冠刺突蛋白的結合親和力,大於其它13種脊椎動物ACE2與新冠刺突蛋白的結合親和力,見稍後將介紹的澳大利亞弗林德斯大學論文)。這說明,人類ACE2最適合與新冠刺突蛋白結合,人體細胞是新冠的最佳感染對象,新冠刺突蛋白受體結合域的5個關鍵氨基酸是專門為感染人類設計的。
2、刺突蛋白三關節式組合鉸鏈設計。基於SARS-CoV、MERS-CoV(中東呼吸綜合症冠狀病毒)、 PEDV(豬流行性腹瀉病毒)等病毒的簡單鉸鏈結構,為新冠刺突蛋白設計了非常精巧、靈活的(可能是前所未有、獨一無二的)三關節式組合鉸鏈結構,這組關節式鉸鏈與人體髖、膝、踝三個關節的運動機制相仿,它們有如下功能:
a) 當“關節”直立時,刺突蛋白向上運動,將RBD暴露出來以便與宿主受體ACE2結合;
b) 當“關節”彎曲時,刺突蛋白向下運動,使RBD處於“躺臥”狀態並隱藏在刺突蛋白三聚體頭部之中,避免被抗體及宿主免疫細胞搜索到。
c) 三個“關節”非同尋常的活動能力和靈活性,使新冠刺突蛋白(及RBD)能夠以不同高度、角度和姿態相當自由、靈活地接觸ACE2受體並與之結合,大大提高了感染宿主細胞的效率。
d) 新冠病毒逃避抗體藥物結合的能力,以及逃避宿主免疫系統搜索、打擊的能力遠超SARS病毒,重要原因之一,就是它有SARS所沒有的,SARS簡單鉸鏈無法比擬的三關節式組合鉸鏈。
(註:本組設計指紋補充於2021年7月27日,後有所修改)
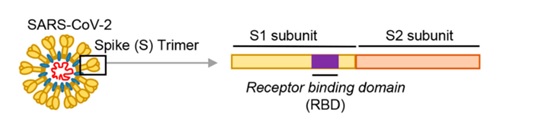
3、furin酶切位點設計。借鑑艾滋病、埃博拉、甲型禽流感(三者都不是冠狀病毒)、鼠肝炎等病毒的既有結構,為新冠病毒也設計了furin酶切位點,並且將furin酶切位點恰好設置在刺突蛋白兩個亞基S1蛋白、S2蛋白的連接交界處。furin酶切位點設計取得了如下效果:
a) 新冠刺突蛋白與hACE2結合後,它的兩個亞基S1、S2蛋白將被furin蛋白酶切割。與S1蛋白分離後,S2蛋白將與宿主細胞膜直接接觸,其融合肽區疏水、親脂的氨基酸將嵌入含脂細胞膜,誘導病毒包膜與宿主細胞膜直接接觸並發生膜融合。膜融合後,病毒包膜內的病毒RNA將直接釋放到宿主細胞中,第一時間在宿主細胞內開始複製、組裝新病毒的過程。
b) SARS病毒沒有furin酶切位點,不能發生膜融合,不能通過膜融合直接釋放病毒RNA迅速展開病毒複製。新冠病毒在人體細胞內複製的效率,相比只能以胞吞方式進入人體細胞的SARS病毒,提高了100-1000倍。
(註:胞吞,指病毒連殼帶瓤、囫圇吞棗地整個進入宿主細胞。由於病毒RNA包裹在病毒包膜內,在病毒包膜被細胞內蛋白酶分解前,病毒RNA無法釋放到細胞中開啟病毒複製。)
在S1、S2蛋白結合處設置furin酶切位點,還賦予了新冠病毒以膜融合的方式感染並殺死T淋巴細胞,破壞人體免疫系統的能力。這項能力SARS病毒也不具備。
furin酶切位點在新冠所屬的β譜系冠狀病毒中極為罕見,鼠肝炎冠狀病毒是新冠出現之前β譜系唯一具有furin酶切位點的病毒。與新冠全基因組序列相似度(一致性)>40%的所有冠狀病毒都沒有furin酶切位點,新冠不可能從任何一位近親那裡獲得furin酶切位點。
4、gp120蛋白、Gag蛋白設計。借鑑艾滋病病毒HIV-1,在S1蛋白基因組中插入了表面糖蛋白gp120和Gag蛋白的基因,使新冠病毒可以象HIV-1那樣結合另一種人類細胞受體CD4,進而感染、殺死CD4+T淋巴細胞(表面附着CD4受體的T淋巴細胞)。這一設計賦予了新冠第二種破壞人體免疫系統的能力;
5、O-Linked聚糖設計。借鑑HIV、埃博拉、丙型肝炎等病毒的聚糖屏蔽機制,在furin酶切位點附近(即S1、S2亞基結合處附近)為新冠設計了一個O-Linked聚糖結構,這一結構能與人體細胞表面的某些蛋白質相互作用,形成一個可逃避免疫打擊的糖鏈屏障。這一設計還帶來以下效果:
a) 大大延緩了人體的免疫反應,使新冠病毒獲得了較長的潛伏期,得以隱蔽地在人體內巨量複製,並幾乎無所不至地向各個器官、組織擴散;
b) 使新冠病毒具有強悍的人體適應生存能力,不易被徹底清除或根除。
O-Linked聚糖設計賦予了新冠病毒另一種逃避宿主免疫系統打擊的途徑(前一途徑是“刺突蛋白三關節式組合鉸鏈設計”賦予的)。許多新冠患者只能產生低水平的抗體並長期患病,O-Linked聚糖設計是造成這一狀況的原因之一。
6、nsp3A編碼設計。借鑑HEV71病毒(71型人腸道病毒),在新冠N蛋白(Nucleocapsid protein,核衣殼蛋白,病毒包膜內包裹病毒核酸即RNA的殼蛋白)基因組中加入了nsp3A編碼,賦予了新冠干擾、抑制人體免疫系統的能力,同時進一步完善、加強了新冠病毒的抗免疫能力。這一設計的具體作用包括:
a) 干擾免疫信號傳遞,抑制免疫應答,使人體免疫反應延遲或減弱;
b) 使人體在免疫反應延遲後過度反應,引發“細胞因子風暴”,進而(可能)導致多器官衰竭。這可能是新冠病人病情常常突然加重、惡化,甚至不治,以及輕症、普通病人有時突然轉為重症的重要原因。
c) 使新冠病毒能夠對抗、反制RNA干擾藥物,使RNAi免疫療法無效或低效。
7、逆轉錄病毒RNA至人體DNA設計。借鑑艾滋病病毒(HIV-1)、人類嗜T淋巴球病毒一型(HTLV-1)等逆轉錄病毒,為新冠設計了逆轉錄(以RNA為模板合成DNA)功能。這一設計的結果及效果包括:
a) 新冠的RNA可逆轉錄並整合到人體被感染細胞的DNA中;
b) 康復患者體內仍存在新冠病毒RNA;
c) 許多康復患者的PCR檢測結果仍為陽性。實際上這些康復患者體內應該並沒有完整成形的新冠病毒,檢測到的RNA是被逆轉錄到人體細胞中的新冠RNA。新冠設計者實現了將新冠RNA整合到人體細胞DNA的逆轉錄功能,但應該沒有實現由這些RNA組裝出各種蛋白及完整新冠病毒的功能。
以上列舉的7組人為設計指紋並非新冠病毒的全部實驗室改造特徵,後續可能還將整理出其它新冠實驗室改造特徵或人為設計指紋,並補充到本文、本系列文章中。
本系列文章將依次展開新冠各組人為設計指紋,並提供每一指紋的證據。首先聚焦第一組設計指紋。
I、RBD關鍵氨基酸設計
參照跨物種傳播能力最強的病毒rs3367,設計出了新冠刺突蛋白RBD的5個關鍵氨基酸,賦予其感染人類的能力及跨物種傳播能力。這一設計使新冠刺突蛋白與hACE2的結合親和力,相比SARS提高了10-20倍。而且,新冠刺突蛋白與hACE2的結合親和力,比它與其它脊椎動物ACE2的結合親和力都強。新冠不是動物來源的自然界病毒,新冠刺突蛋白RBD的5個關鍵氨基酸是專門為感染人類而設計的。
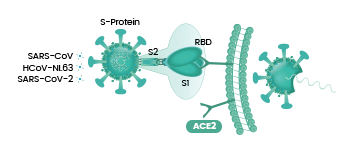
病毒能否進入宿主細胞,感染宿主,取決於它有沒有打開宿主細胞(鎖)的“鑰匙”。附着在宿主細胞表面的相關受體,如ACE2,TMPRSS2,CD4等等,相當於細胞的“鎖”,如果病毒有匹配某把細胞“鎖”(細胞受體)的“鑰匙”,它就能與該受體結合,在該受體的介導下進入(感染)宿主細胞。
冠狀病毒用來打開細胞鎖的“鑰匙”,就是它的S蛋白,即Spike蛋白,也叫刺突蛋白或棘狀蛋白。
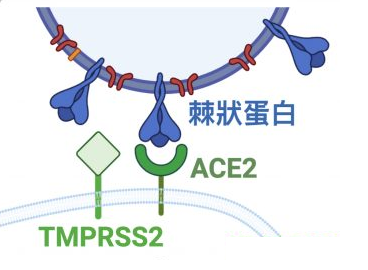
刺突蛋白由相連的兩個部分(也叫兩個亞基)組成,向外突出的部分是S1蛋白,連接S1蛋白與病毒包膜的是S2蛋白。S2蛋白有時也叫膜融合亞基(新冠病毒的S2蛋白參與病毒包膜與宿主細胞膜的膜融合過程),它相當於病毒鑰匙的手柄部分;S1蛋白也叫受體結合亞基,它負責與宿主細胞表面的受體(“鎖”)結合,相當於病毒鑰匙的齒面部分。
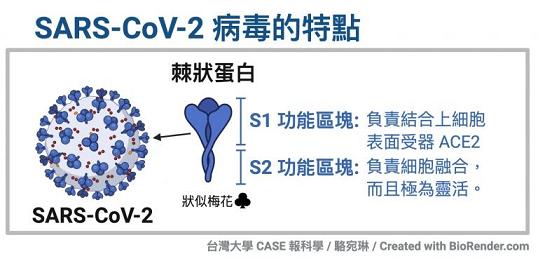
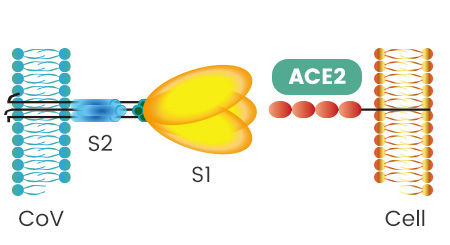
S1蛋白中有一個區域叫做受體結合域(Receptor Binding Domain),簡稱RBD,RBD是S1蛋白與細胞表面的受體發生接觸的部分,它相當於病毒鑰匙齒面的鑰齒部分。
RBD中有14個氨基酸與宿主細胞受體ACE2發生直接接觸,這14個氨基酸中,又有5個對刺突蛋白能否與ACE2結合起決定作用,這5個氨基酸是冠狀病毒刺突蛋白打開宿主ACE2細胞鎖的5個關鍵鑰齒。
如果這5個氨基酸與ACE2適配,刺突蛋白就能與ACE2成功結合,宿主的ACE2細胞鎖就順利打開了,冠狀病毒將得以進入、感染ACE2所附着的細胞。
註:ACE2,即Angiotensin
Converting
Enzyme2,血管緊張素轉換酶2,是細胞表面的一個膜蛋白,廣泛存在於脊椎動物的呼吸、消化、血液、泌尿、生殖、神經(如眼組織相關細胞,嗅覺相關細胞等等)等系統的器官、組織內。ACE2可介導與之發生結合的病毒進入它所附着的細胞內部。ACE2也是腎素-血管緊張素系統(RAS)中的一個關鍵酶。
因此,要賦予病毒感染某一脊椎動物宿主(如人類)的能力,只要為它提供或設計出適配該宿主ACE2受體的RBD5個關鍵氨基酸就足夠了。至少有以下三種方式可以做到這一點:
a) 病毒嵌合。將病毒A刺突蛋白(或S1蛋白或RBD)的基因序列嵌合到病毒B的基因組之中,病毒B就將獲得病毒A的5個關鍵氨基酸,從而繼承A與某宿主ACE2的結合能力,也就是A對該宿主的感染能力;
b) 直接編輯,抄襲、復用。直接編輯病毒B的5個關鍵氨基酸,將它們全部改為病毒A的5個關鍵氨基酸,病毒B也將繼承病毒A的ACE2相關的宿主感染能力;
c) 復用+替代。參照病毒A的5個關鍵氨基酸,讓病毒B復用A的部分關鍵氨基酸,用理化性質相近的氨基酸替代其餘關鍵氨基酸,如果替代前後兩組關鍵氨基酸與ACE2有相近的結合效果,那麼,病毒B也將與病毒A有着相近的ACE2相關的宿主感染能力。
單純使用前二種方式非常簡單、省事,但人為痕跡太過赤裸;第三種方式既有一定的人為痕跡隱蔽性,也有一定的技術挑戰性。復用得越少,替換得越多,隱蔽性就越強,但必須克服更高的技術難度。
經過上述準備之後,現在可以提出、解決如下問題了:新冠病毒刺突蛋白RBD決定人類感染能力的5個關鍵氨基酸,是怎麼得來的?答案:它們是參照、基於特殊病毒rs3367的5個關鍵氨基酸,復用+替代得到的。
下表(第三、第四行)展示了新冠、rs3367,這兩個病毒5個關鍵氨基酸的對應關係。括號內的數字代表氨基酸在相應刺突蛋白氨基酸序列中的序號。如,第三行第二列的亮胺酸L(451),代表SARS-CoV-2(新冠)的第一關鍵氨基酸--亮胺酸L,在新冠刺突蛋白的氨基酸序列中是第451個氨基酸。
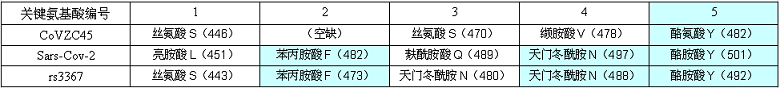
可見,新冠、rs3367的5個關鍵氨基酸有三個相同:
它們的第五關鍵氨基酸同為酪氨酸Y;
第四關鍵氨基酸同為天門冬酰胺N;
第二關鍵氨基酸同為苯丙胺酸F;
也就是說,新冠復用了rs3367五個關鍵氨基酸中的三個:第五、第四、第二關鍵氨基酸。
新冠設計者沒有繼續復用rs3367的第三關鍵氨基酸-天門冬酰胺N,他精心挑選了一個替代者,與天門冬酰胺N理化屬性非常相似或接近的麩酰胺酸Q,以之作為新冠的第三關鍵氨基酸。
新冠設計者最後選擇以亮氨酸L(白氨酸)為新冠的第一關鍵氨基酸。這個最後確定的關鍵氨基酸選擇時的第一考量,不是它與rs3367的第一關鍵氨基酸-絲氨基酸S理化性質應該最接近,而是它與之前已選定的四個關鍵氨基酸應當整體上最配套:新冠五個關鍵氨基酸的結構體、RBD的結構體,在與hACE2相互作用時,它們與rs3367對應的結構體,應當儘量同構或儘量等效。
關於新冠、rs3367五個關鍵氨基酸復用、替代關係的更詳細分析、解讀,可參見我之前的一篇文章:新冠RBD5個關鍵氨基酸抄襲、替換自rs3367。
為什麼要參照、復用rs3367的關鍵氨基酸來設計新冠的關鍵氨基酸呢?因為rs3367太有參照價值了!它是已知的自然界中跨物種傳播能力最強的病毒。
已發現的自然來源的冠狀病毒(粗分的話)約有一百種。大自然為冠狀病毒設置了一道傳播屏障:將S1蛋白決定宿主感染能力的RBD等區域設置為高度保守區域,這些區域的氨基酸很少發生突變。絕大多數蝙蝠或動物來源的冠狀病毒不能跨越物種傳播屏障,它們只能感染特定的動物(物種特異性),不能進入人體細胞,無法感染人類。然而,事無絕對,rs3367、rsSHC014就是兩個罕見的具備跨物種傳播能力的蝙蝠來源的冠狀病毒,它們的刺突蛋白都能與hACE2(human ACE2)良好結合。它們還有一個奇特之處:雖然能夠進入人體細胞,但卻不會使人發病,對人體無害。同時,雖然它們本身對人體無害,但功能增益研究卻可以利用它們的人類感染能力來合成或改造人類致病性、致死性病毒。兩者相比,rs3367更非同尋常,它是已知的自然界中跨物種傳播能力最強的病毒,它能感染的動物包括但不限於:人類、果子狸、貉、恆河猴、雪貂、水鼬、貓、蝙蝠、老鼠等等。新冠設計者復用、(等效或近效)替代rs3367 RBD的5個關鍵氨基酸,就是要使新冠病毒擁有與之相近的非凡跨物種傳播能力,特別是感染人體細胞的能力。
rs3367病毒(GenBank ACCESSION ID: KC881006)的病毒毒株2012年3月從雲南昆明中華菊頭蝠(又稱中華馬蹄蝠)的腸道與糞便樣本中分離獲得;rsSHC014(GenBank ID: KC881005),亦稱SHC014病毒或SHC014-CoV,它的病毒毒株於2011年4月獲得,同樣收集、分離自雲南昆明中華菊頭蝠的腸道與糞便樣本。rs3367與rsSHC014這兩個類SARS冠狀病毒彼此非常相似,它們全基因組序列的一致性或相似度為98.8%。rs3367,rsSHC014的全基因組序列(核苷酸序列),以及WIV1病毒S蛋白(GenBank ID:KC881007,收集於2012年9月)的基因序列,都是2013年4月8日這一天上傳到NCBI(National Center for Biotechnology Information,美國國家生物技術信息中心) GenBank生物數據庫,完成國際共享的。
需要說明一下rs3367與WIV1的關係。WIV1病毒(GenBank ID:KF367457,全基因組序列上傳時間為2013年7月),在某些論文中也稱為WIV-CoV或SL-CoV-WIV1,它與rs3367全基因組序列的同一性或相似度為 99.92% ,在決定物種感染能力(宿主範圍)的spike蛋白S1亞基部分,它們的氨基酸序列同一性為 100%。在不同論文中,有時使用rs3367,有時則使用WIV1,其實它們可以相互替代,不會對論文產生任何實質影響。為描述方便,本文將它們視為同一病毒。
參照rs3367設計新冠的關鍵氨基酸效果如何?我們看兩篇論文。
論文一。2020年3月13日,美國德克薩斯大學奧斯汀分校Jason S McLellan團隊,及美國國家過敏和傳染病研究所的研究人員在《Science》雜誌上聯合發表了一篇論文:Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion Conformation(膜融合前構象中2019-nCoV 刺突蛋白的冷凍電鏡結構)
https://science.sciencemag.org/content/367/6483/1260
這篇論文發表於預印本平台biorxiv的時間是2020年2月15日。
https://www.biorxiv.org/content/10.1101/2020.02.11.944462v1
論文指出: 2019-nCoV(新冠,SARS-CoV-2的舊稱)S蛋白與hACE2的結合親和力,比SARS-CoV S蛋白與hACE2的結合親和力高10-20倍(原文:ACE2 bound to the 2019-nCoV S ectodomain with ~15 nM affinity, which is ~10- to 20-fold higher than ACE2 binding to SARS-CoV S)。
論文二。2020年5月13日,澳大利亞弗林德斯大學的科學家團隊在預印本平台arxiv發表了一篇論文:In
silico comparison of SARS-CoV-2 spike protein-ACE2 binding affinities
across species and implications for viral
origin(新冠刺突蛋白與ACE2結合親和力的跨物種模擬比較及其對病毒起源的指示)
https://arxiv.org/abs/2005.06199
https://arxiv.org/ftp/arxiv/papers/2005/2005.06199.pdf
由於論文強烈指示着新冠病毒可能來自實驗室,是專門針對人類設計的,這一論文被壓制了超過13個月,直到2021年6月24日,論文才得以發表於《Nature Science》(《自然醫學》)雜誌。
https://www.nature.com/articles/s41598-021-92388-5
相比之下,德克薩斯大學Jason S McLellan團隊的論文從2020年2月15日發表於預印本平台biorxiv,到2020年3月13日發表於《Science》雜誌,只用了不到一個月的時間。
弗林德斯大學科學家的論文講了些什麼呢?我歸納了以下要點:
a. 新冠病毒具備跨物種傳播能力,除了人類,它還能感染穿山甲、狗、猴子、倉鼠、雪貂、貓、老虎等動物。
b. 通過分子動力學定量模擬研究,計算出了新冠S蛋白(刺突蛋白)與各物種ACE2相互作用的結合能(binding energies for the interactions),各物種ACE2與新冠S蛋白的結合能從高到低依次為:人類 > 穿山甲 > 狗 > 猴子 > 倉鼠 > 雪貂 > 貓 > 老虎 > 蝙蝠 > 麝貓 > 馬 > 牛 > 蛇 > 老鼠。
c. 論文引用其它研究的報告指出:上述排序中,老虎之前動物物種的ACE2對新冠S蛋白的結合比較寬容,其中部分動物被新冠感染後將出現明顯的患病症狀,如猴子、倉鼠、貓、老虎;蝙蝠及其後物種的ACE2對新冠S蛋白的結合不寬容,新冠不易或不能感染這些物種。這些對照研究的結論與要點b的計算結果及結論是一致的。
d. 蝙蝠ACE2對新冠S蛋白的結合不寬容,其與新冠S蛋白的結合能或結合親和力不僅遠低於人類ACE2,而且也低於多種其它物種ACE2,不認為蝙蝠是新冠的原始宿主;
e. 不認為穿山甲是新冠的中間宿主或原始宿主。原因之一是,迄今為止發現的所有穿山甲冠狀病毒都缺乏新冠S蛋白S1/S2亞基交界處的furin(弗林)蛋白酶切位點;
f. 人類ACE2與新冠刺突蛋白的結合親和力最強,遠高於假設的原始宿主蝙蝠,也高於假設的中間宿主穿山甲,這說明,人類ACE2是新冠刺突蛋白的最佳結合對象,人體細胞是新冠病毒的最佳感染對象。
g. 新冠最早的分離株( 2019年12月在武漢分離得到的新冠病毒樣本)已經具備了與hACE2(人類ACE2)的極佳結合親和力,這說明,從剛被發現起,新冠就極為適合感染人類,人體細胞從一開始就是新冠的最佳感染對象,它沒有表現出任何適應人類的過程。如果新冠是動物來源的,那麼,從動物宿主轉移到人類宿主之初,它最適合感染的,不是人類,而是它的動物來源宿主(人畜共患病病毒在跨越物種傳播之初,通常對原始宿主物種表現出最高的結合親和力);如果新冠病毒是動物來源的,那麼它將需要一個感染人類的適應過程,它需要針對人體細胞ACE2進行刺突蛋白的適應性變異以達到最佳的人類感染效果。然而,事實上,新冠病毒沒有經歷任何適應人類的變異過程,就直接達到了最佳的人類感染狀態。
由以上7點,特別是f和g,可以得出或作出以下推論或引申:
A. 新冠病毒的原始宿主可能就是人類;
B. 新冠病毒可能原本就是為人類量身定製,為感染人類而專門設計、製造出來的;
C. 疫情發生前,新冠病毒有可能在人體細胞樣本中培養過,已經在實驗室中完成了對人體細胞的適應過程。
某個科學家通過對rs3367 RBD關鍵氨基酸的借鑑、復用、(等效或近效)替代,為新冠病毒設計了一套可跨物種傳播且最適合感染人類的關鍵氨基酸。
哪些科學家對rs3367進行過深入的研究?這也許是一個值得挖掘的問題。
首先應該關注中國科學院武漢病毒研究所石正麗團隊。rs3367和rsSHC014都是石正麗團隊搜集、分離的,他們肯定是最了解這兩個特殊病毒的人之一。不僅如此,該團隊還發表過專門以rs3367為研究對象的重磅論文。
2013年10月30日,中國石正麗團隊、美國Peter Daszak(彼得-達斯扎克,生態健康聯盟主席)團隊在《Nature Science》雜誌聯合發表了一篇以rs3367為主角(也提及了rsSHC014)的重要論文:Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor(使用ACE2受體的蝙蝠類SARS樣冠狀病毒的分離和特徵)
https://www.nature.com/articles/nature12711
論文第一作者為石正麗團隊的葛行義,通訊作者為石正麗和達斯扎克。論文的要點有:
a. 以實驗證實了rs3367(WIV1)的跨物種傳播能力:它的刺突蛋白可與人類、果子狸、中華馬蹄蝠(以及豬腎)等物種的ACE2受體結合,使rs3367能夠進入這些物種的細胞,並在細胞內有效複製;
b. 這說明,自然界中存在如Sars-CoV那樣,使用ACE2受體感染細胞,可跨物種傳播的動物來源的冠狀病毒;
c. rs3367的跨物種傳播能力證明:某些蝙蝠類SARS冠狀病毒不需要中間宿主就可以直接感染人類;
d. 論文認為,rs3367的宿主中華馬蹄蝠應該也是SARS-CoV的自然原始宿主;
e. 論文認為,rs3367是SARS-CoV起源於自然界的一項最有力證據。
註:rs3367、rsSHC014二者與SARS-CoV全基因組序列(總體核苷酸序列)一致性都約為95%。
需要指出,該論文是一篇病毒跨物種傳播研究論文,但不是一篇病毒功能增益研究論文。前面提到過,rs3367、rsSHC014這兩個病毒雖然能夠進入人體細胞,但不會使人發病,它們本身對人體無害。該論文證實了rs3367可跨物種傳播,但沒有對rs3367,或rsSHC014或論文中涉及的其它任何一種病毒進行增強致病力或傳播能力的功能增益改造。
還要預先提個醒,希望諸位讀者一會不要忘了這篇2013年論文,該論文及它的第一作者葛行義,在後續其它論文的討論中,還要涉及和用到。
石正麗團隊,或Peter Daszak團隊是對rs3367研究最深的科學家嗎?未必。對rs3367、rsSHC014研究最深入、最全面的,恐怕應該是北卡羅來納大學教堂山分校的國際病毒學頂級權威Ralph S. Baric(拉爾夫.巴里克)及其團隊。Ralph S. Baric團隊不僅深悉這兩個病毒的跨物種傳播特徵,而且還利用這一特徵進行功能增益研究,用這兩個無害於人的病毒至少先後兩次合成了可使人致病甚至致死的危險病毒。
2016年3月14日,Ralph S. Baric團隊在PNAS(Proceedings of the National Academy of Sciences of the United States of America,美國國家科學院院刊)發表了一篇以rs3367(WIV1)為研究主角的論文:SARS-like WIV1-CoV poised for human emergence(類SARS冠狀病毒WIV1-CoV有產生人類流行疫情的潛在危險)
https://www.pnas.org/content/113/11/3048
這篇2016年病毒嵌合-功能增益論文及相關研究得到了美國國立過敏和傳染病研究所、NIH(美國國立衛生研究院)國家老齡化研究所及國家糖尿病、消化和腎臟疾病研究所等機構的支持和資助。
論文部分要點歸納如下:
a. 基於WIV1(即rs3367)的刺突蛋白和SARS-CoV-MA15的骨幹,合成了嵌合病毒WIV1-MA15。同時合成了WIV1的全長病毒WIV-CoV。SARS-CoV-MA15,是通過反覆傳代培育出的可感染小鼠並使其致病、致死的SARS-CoV實驗室變異體。SARS-CoV可感染(進入)小鼠細胞,但不會使其(明顯)發病。
b. WIV1-CoV和WIV1-MA15都能強烈感染原代人類呼吸道上皮細胞(HAE,可分離自供體肺分叉上方的氣道上皮) ,並在細胞內大量複製;
c. WIV1-MA15或WIV-CoV對小鼠的致病力明顯弱於SARS-CoV-MA15,它們不會使較年輕的實驗小鼠(10周齡)致死或體重顯著減輕;
d. 如果將實驗小鼠換成轉基因小鼠(其肺纖毛上皮細胞表達人類 ACE2),那麼,小鼠將更容易感染WIV1-CoV,並且症狀加重,部分10-20周齡的小鼠體重減輕超過10%,並因WIV1-CoV在大腦中的強大複製而患上了腦炎。這表明,相比小鼠ACE2,WIV1刺突蛋白更適宜結合人類ACE2。
e. 嵌合病毒WIV1-MA15對小鼠的致病力強於WIV1-CoV,這說明WIV1-MA15的骨架(骨幹)更適合感染小鼠,或者說,病毒骨架的變化能改變病毒的致病力。
f. 論文“Discussion”部分指出,除受體結合域外,S1蛋白的其餘部分以及S2蛋白的變化也可能在冠狀病毒感染、傳播、發病機制中發揮關鍵作用。這些刺突蛋白區域可能會影響蛋白酶的靶向性,刺突的切割特性或擴展性,它們的某些變化可能使病毒獲得更健全的感染能力(原文:Whereas the receptor binding domain had garnered the most interest, changes in the remaining portion of S1 as well as the S2 portion of spike may also play a critical role in facilitating CoV infection, transmission, and/or pathogenesis.Differences in these regions of spike may yield increased protease targeting, enhanced spike cleavage, and/or expanded tropism leading to more robust infection for the epidemic SARS strains)。這實際上提出了完善感染能力的病毒改造方向和建議:即,進一步改造刺突蛋白,如改造S1蛋白受體結合域外的部分,或改造S2蛋白,將使刺突蛋白更有針對性地與蛋白酶發生作用,可增加刺突蛋白的切割(被蛋白酶切割)特性,可使刺突蛋白更富擴展性。令人驚訝的是,這三項病毒改造建議,即與蛋白酶作用的針對性、刺突蛋白新的酶切特性、刺突蛋白的擴展性及靈活性,在新冠病毒中全都實現了!後續文章將予以證實並給出證據。
g. 論文還研究了對嵌合病毒WIV1-MA15使用單克隆抗體治療,以及使用SARS疫苗治療的效果,實驗發現:針對SARS-CoV的單克隆抗體(Fm6 和 230.15)對WIV1刺突蛋白介導的感染也有強大的中和作用即療效;但SARS-CoV疫苗DIV(福爾馬林、紫外線雙重滅活過的SARS-CoV病毒)對WIV1-MA15造成的感染不僅沒有明顯療效,而且還有其它副作用。
該論文相關的研究不僅基於WIVI(rs3367)的刺突蛋白+SARS-CoV-MA15的骨幹,組裝出了具有活性的嵌合病毒WIV1-MA15毒株,還基於WIVI的全基因組序列,組裝出了具有活性的完整的WIV1(克隆)毒株WIV1-CoV。WIV1-MA15毒株和WIV1-CoV毒株,都是使用反向遺傳克隆平台組裝出來的。
Ralph S. Baric團隊早在2003年SARS疫情結束後,就與美國陸軍傳染病醫學研究院(U.S. Army Medical Research Institute of Infectious Diseases)、美國范德堡大學醫學中心(Vanderbilt University Medical Center)合作研發了可快速、有效地合成病毒的反向遺傳克隆平台。
2003年10月28日,Ralph S. Baric團隊、美國陸軍傳染病醫學研究院、范德堡大學醫療中心於PNAS聯合發表了論文:Reverse genetics with a full-length infectious cDNA of severe acute respiratory syndrome coronavirus(SARS病毒全長傳染性cDNA的反向遺傳學)
https://www.pnas.org/content/100/22/12995
該論文的相關研究使用逆轉錄、反向遺傳學持術,合成了可自我複製、具有傳染性的SARS-CoV病毒cDNA及病毒毒株。論文的部分要點為:
a. 將SARS-CoV的RNA逆轉錄為cDNA,並在組裝全長cDNA前插入若干識別標記;
註:cDNA,即complementary DNA,互補DNA,是利用逆轉錄酶,以RNA(通常是mRNA)為模板製作的RNA的DNA復製品。
b. 將SARS-CoV的帶標記的轉錄本(cDNA或cDNA進一步轉錄成的RNA)以電穿孔的方式釋放到Vero E6細胞中,48小時後,在細胞培養物中檢測到了相當滴度(病毒含量)的帶識別標記的SARS-CoV克隆毒株icSARS-CoV。這說明實驗製作的SARS-CoV轉錄本能夠在細胞內自我複製並組裝出完整的SARS-CoV病毒毒株;
c. 將轉錄本組裝出的病毒icSARS-CoV放入到未被病毒感染過的Vero E6細胞培養物中,72小時後,可觀察到明顯的細胞病變,這說明icSARS-CoV具有感染細胞的能力及傳染性;
d. 半胱氨酸蛋白酶抑製劑E64-D可抑制icSARS-CoV在細胞中的複製、組裝。
註:Vero E6細胞,是一類非洲綠猴腎細胞系細胞,它在形成單層膜後顯示出一定程度的接觸抑制,最初用於繁殖一些複製緩慢的病毒,現在,該細胞系已被廣泛用於麻疹病毒、埃博拉病毒、克里米亞-剛果出血熱病毒、SARS病毒、新冠病毒等病毒的分離和生長。
2003年論文還被同樣出自Baric團隊之手的2015年嵌合病毒論文(稍後即將介紹)引用,作為後者提及“SARS-CoV reverse genetics system”時的注釋。
Ralph S. Baric團隊2003年後人工合成、組裝了多種冠狀病毒的全長感染性cNDA及病毒毒株,除SARS-CoV外,其它例子還包括HCoV-NL63(人類冠狀病毒NL63) 、HKU3(蝙蝠冠狀病毒HKU3,包括13個病毒毒株)、HKU5(伏翼蝠冠狀病毒HKU5)等等。
2012年6月MERS疫情爆發後,Ralph S. Baric團隊再次使用反向遺傳克隆平台,全球率先合成了MERS-CoV病毒的全長cDNA並實現了MERS-CoV 的分子克隆遺傳學系統。2013年10月1日,該成果以論文形式正式發表於PNAS:Reverse genetics with a full-length infectious cDNA of the Middle East respiratory syndrome coronavirus(MERS病毒全長傳染性cDNA的反向遺傳學)
https://www.pnas.org/content/110/40/16157
該論文與2003年的SARS病毒cDNA論文有很多相似之處,其要點有:
a. 基於已發表的MERS-CoV的RNA基因組序列,逆轉錄出若幹個cDNA片段,並在這些cDNA片斷中插入識別標記;
b. 通過內切酶將上述cDNA片段無縫組裝為全長cDNA;
c. 將全長cDNA再轉錄為RNA,以電穿孔的方式將RNA釋放到Vero細胞中,48-72小時內,在培養物中檢測到了細胞病變效應和轉錄物,以及相當滴度(病毒含量)的帶識別標記的MERS-CoV毒株rMERS-CoV。這說明實驗製作的MERS-CoV轉錄本能夠在細胞內自我複製並組裝出完整的MERS-CoV病毒毒株;
d. 將轉錄本組裝出的病毒rMERS-CoV放入到未被病毒感染過的Vero 81細胞培養物中,12小時後,可觀察到細胞感染特徵,這說明rMERS-CoV具有感染細胞的能力及傳染性;
e. rMERS-CoV還可感染並在純化的原代肺泡II肺細胞、微血管內皮細胞、成纖維細胞中有效複製。
這篇論文得到了美國國立衛生研究院 (NIH)和美國國防威脅降低局(DTRA,Defense Threat Reduction Agency)的資助。
Ralph S. Baric團隊開發的反向遺傳克隆平台已成為病毒、疫苗研究的快速反應平台及功能增益、病毒改造的核心平台,其最大的特點是,可以基於病毒的基因序列人工組裝出具有活性的病毒毒株或克隆。這一特點還意味着:
a. 病毒研究可以擺脫對各種自然界來源的病毒毒株,包括蝙蝠冠狀病毒毒株的採集依賴;
b. 進行功能增益研究,或病毒改造時,可以先設計病毒的基因序列,然後再基於基因序列,使用反向遺傳克隆平台組裝出病毒毒株;
c. 該平台極大地簡化、便利了病毒的基因編輯、改造工作,使編輯基因序列與操作病毒毒株可以相對獨立地分開進行。即編輯病毒基因序列時不必每每在高等級生物安全實驗室操作病毒毒株,可以先在普通環境下,用電腦軟件編輯、修改基因序列相關的文件,並進行模擬分析,有需要時,再使用反向遺傳克隆平台組裝出新基因序列對應的病毒毒株,對之進行相關實驗。
前面所說的2016年3月的病毒嵌合論文不是Ralph S. Baric團隊的第一篇功能增益改造論文。
2015年11月9日,Ralph S. Baric團隊在《自然醫學》(Nature Medicine)雜誌發表了著名的嵌合病毒論文:A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence(一個類似SARS的蝙蝠冠狀病毒群顯示了產生人類流行疫情的潛力)
https://www.nature.com/articles/nm.3985
2016年論文與2015年論文的核心工作都是製作嵌合病毒,2016年的嵌合材料是rs3367(WIV1),2015年則是rsSHC014(SHC014病毒,SHC014-CoV)。兩篇論文中的另一嵌合材料同為可感染小鼠的SARS-CoV變異體SARS-CoV-MA15。
2015年論文的部分要點為:
a. 使用反向遺傳克隆平台,基於SHC014-CoV(即rsSHC014)的刺突蛋白和SARS-CoV-MA15的骨幹,合成了一種嵌合病毒SHC014-MA15。前面已經介紹過(2016年3月論文),SARS-CoV-MA15是Ralph S. Baric團隊通過反覆傳代培育出的可感染小鼠並使其致病、致死的SARS-CoV實驗室變異體;
b. 實驗證明,SHC014-MA15能夠有效利用hACE2感染人類呼吸道細胞,在細胞內大量複製,並產生相當於SARS-CoV的體外滴度(可理解為傳染性相當於SARS);
c. SHC014-MA15在小鼠肺內的複製滴度(濃度)與SARS-CoV-MA15幾乎等同;
d. SHC014-MA15的致病力、致死力弱於SARS-CoV-MA15,但能使被感染的小鼠體重穩定、持續地減輕,大量10-week-old(10周齡)的BALB/C小鼠(白變種實驗室老鼠)在感染4天后體重減輕超過10%。SHC014-MA15對較年長小鼠有致死性,它能使被感染的部分12個月大(12-month-old)的小鼠死亡;
e. 現有的針對SARS-CoV的免疫治療和預防方法對SHC014-MA15感染的治療效果不佳,特別是年長小鼠的感染,單克隆抗體和疫苗(如雙滅活SARS-COV疫苗DIV)方法均未能中和並防止SHC014-MA15造成的感染。
Ralph S. Baric團隊這篇2015年論文為實驗室製造人類致病性病毒開創了一條重要道路,這是科學家第一次以嵌合方式改造出有嚴重人類致病能力的危險病毒(當然它不是改造危險病毒的首例,病毒改造--功能增益研究的歷史要早得多)。SHC014-MA15可視為新冠的一個早期原型(新冠也很可能使用了病毒嵌合的方式)。當然,相比SHC014-MA15,新冠應用的改造技術更複雜、多樣,功能也更豐富、強大、完善;SHC014-MA15的實驗室痕跡非常赤裸,新冠則有一定的“自然進化”偽裝性。
這篇2015年病毒嵌合、功能增益論文及相關研究得到了美國國立衛生研究院 (NIH) 國家過敏和傳染病研究所、美國國家老齡化研究所的資助。
2015、2016年兩篇病毒嵌合-功能增益論文的通訊作者都是Ralph S. Baric,第一作者都是Vineet D. Menachery(維內特·德梅納赫里)。參與論文的,除Baric團隊外,還包括其它美國科學家,及中國、瑞士的科學家。有二位中國科學家在2015年論文中列名:石正麗及其團隊成員葛行義。
有些文章不知是無意張冠李戴還是有意偷梁換柱,它們將Ralph S. Baric(拉爾夫.巴里克)團隊2015年的嵌合病毒論文歸到了石正麗及其團隊名下,稱這篇2015年11月的《自然醫學》(Nature Medicine)論文是石正麗團隊發表的。 這種說法,應該視作荒唐的笑話,還是無恥的謊言呢?石正麗團隊只有兩人在論文中列名:第14作者石正麗、第9作者葛行義,他們能算論文的主創人員嗎?我甚至懷疑,石、葛二人可能根本就沒有直接參與2015年論文的相關研究工作。情況是否如此?我們來看看他們在Ralph S. Baric 2015年論文中究竟做了些什麼吧。
先看第9作者葛行義。2015年論文中說,“X.-Y.G. performed pseudotyping experiments”(葛行義完成了假分型實驗)。根據論文相關內容可知,假分型試驗是指:測量編碼WIV1棘突蛋白的慢病毒進入表達hACE2的細胞的能力。
這個假分型實驗的目的是什麼呢?確定WIV1病毒(即rs3367)刺突蛋白結合hACE2,進入人體細胞的能力。注意兩點。其一,2015年嵌合病毒論文的病毒主角不是WIV1即rs3367,而是rsSHC014,也就是說,這一關於WIV1(rs3367)的假分型實驗並非論文中的重要實驗,只是一個次要的裙帶性實驗;其二,前面我們介紹過2013年10月30日的《Nature Science》論文(石正麗團隊、彼得-達斯扎克團隊聯合發表,葛行義為第一作者),2013年論文早已實驗證實了WIV1(rs3367)病毒刺突蛋白結合hACE2,進入人體細胞的能力(見前文所列2013年論文要點a),而且,相關實驗是2013年論文的核心實驗。
https://www.nature.com/articles/nature12711
葛行義為Ralph S. Baric2015年論文重做了2013年論文的核心實驗?或者設計、實施一個結論完全相同的類似實驗?可能性太小太小了,完全沒有必要。我認為,葛行義並沒有為Baric2015年論文redo2013年實驗或performed類似實驗,他應該只是向Baric團隊提供了自己2013年論文核心實驗的詳實細節。
注1:假分型,pseudotyping,即假性病毒或假病毒,是人工改造或人工合成的,去除了毒性的缺陷型病毒(某些類別的疫苗,如腺病毒載體疫苗也是用改造過的缺陷型病毒合成的)。製作假病毒與功能增益研究有相同之處:都要對病毒進行實驗室改造;它們的不同之處是:功能增益研究人為增強病毒的致病能力(毒性)或傳播能力,而製作假病毒並不增強病毒的致病能力或傳播能力;
注2:慢病毒指潛伏期較長,緩慢發病的一類逆轉錄科病毒,艾滋病病毒(HIV)就是一種慢病毒。慢病毒常被用來製作假病毒。
再來看第14作者石正麗。論文中說,石正麗的貢獻是“提供了SHC014刺突蛋白的基因序列和質粒”。由此可知,石正麗只是為2015年論文提供了兩項“原材料”,並未參與任何相關研究工作。而且,早在2013年4月8日,石正麗團隊就已將SHC014的全基因組序列上傳到了完全開放查閱的NCBI GenBank數據庫,Ralph S. Baric只要知道SHC014刺突蛋白基因序列(片斷)在全基因組序列中的起止序號,就可由GenBank獲得SHC014刺突蛋白的基因序列;同時,Baric其實並不需要石正麗為其提供SHC014刺突蛋白的質粒(可理解為SHC014刺突蛋白的RNA片斷+該RNA片斷的實驗室載體),基於SHC014刺突蛋白的基因序列,Baric團隊可使用反向遺傳克隆平台自行組裝出SHC014的刺突蛋白質粒。上述分析可小結為:石正麗並未參與2015年論文的任何研究工作,她為相關研究提供兩項“原材料”的貢獻,也不是非常專門和不可替代的。這也許就是石正麗列名第14作者(通訊作者Ralph S. Baric之前的最後一位作者),為該論文最次要作者的原因。
還有一個重要問題:石正麗團隊進行過功能增益研究嗎?
美國之音報導,2021年5月25日(星期二),來自肯塔基州的共和黨籍聯邦參議員蘭德·保羅(Rand Paul)提出了一項修正案,禁止NIH(National Institutes of Health,美國國立衛生研究院)和其他聯邦機構資助在中國進行的“增加功能”研究。這個修正案被加入到旨在與中國展開全面競爭的《美國創新與競爭法》。
引自VOA新聞:美參院通過修正案,禁止為武毒所及中國“增加功能”研究提供資助
https://www.voachinese.com/a/US-senate-amendment-gain-of-function-research-wiv-20210526/5905707.html
蘭德·保羅稱:納稅人的錢不應該被用來資助在武漢的增加功能研究,現在我們永久性地阻止了這個做法。
蘭德·保羅這副嘴臉道貌岸然、虛偽可笑,他的言下之意莫非是:美國納稅人的錢應該專門資助美國的功能增益研究,作為美國病毒學家開展這類研究的聯邦經費?
在5月舉行的一場國會聽證會上,蘭德·保羅與美國國立過敏和傳染病研究所(NIAID)所長、白宮首席醫學顧問安東尼·弗契(Dr. Anthony Fauci)有過一段言辭交鋒。
保羅批評NIH對中國的增加功能研究提供資助,弗契則說,這種說法是錯誤的。
弗契說:“保羅參議員,恕我直言,你是完全不正確的,NIH從來沒有、現在也沒有資助武漢病毒研究所的增加功能研究。”
蘭德·保羅稱NIH資助了武漢病毒研究所的功能增益研究;安東尼·福奇則稱NIH從未資助武漢病毒研究所的功能增益研究。那麼,武漢病毒研究所是否進行了功能增益研究?
“美國某些機構資助了武漢病毒研究所的功能增益研究”,這是一個移花接木捏造出的謊言。
實際情況是怎樣的呢?
其一,石正麗團隊的“蝙蝠冠狀病毒跨物種傳播研究”與“病毒功能增益研究”不是一回事,至少從公開發表的論文看,石正麗團隊從未人為增強過病毒的致病力或傳播能力。
其二,美國某些機構確實資助過武漢病毒研究所,如美國國立衛生研究院 (NIH),美國國際開發署 (USAID) ,皮特·達薩克(Peter Daszak)為主席的生態健康聯盟等,但他們所資助的,不是子虛烏有的“功能增益研究”項目,而是“預測:中國病原體探索”項目(PREDICT:China Pathogen Discovery)”。這一項目是“新發傳染病PREDICT”項目的一個子項目,PREDICT項目是生態健康聯盟等機構在美國國際開發署資助下於2009創辦的一個全球性合作項目,這一項目與31~35個國家合作,在這些國家搜尋野生動物中的病毒樣本,中國是其中之一。石正麗團隊在中美合作中的分工是收集、分離蝙蝠冠狀病毒,並研究它們的其跨物種傳播能力,rsSHC014、rs3367及石正麗團隊、皮特·達薩克(Peter Daszak)團隊聯合發表的2013年Nature Science論文,都是這一合作的重要成果。武漢病毒研究所不是無償接受資助,作為回報,石正麗團隊要將他們在中國採集、分離得到的病毒樣本提供給生態健康聯盟。基於這種合作,大批來自中國的病毒樣本被生態健康聯盟運送至美國,充實美國的病毒庫,用於美國科學家的病毒研究,包括功能增益研究。據統計,自2008年4月至2018年9月,通過PREDICT項目,美國從中國共獲得了上萬件動物及人體病毒。
迄今為止,我沒有發現石正麗團隊進行功能增益研究的任何記錄,沒有發現任何合乎邏輯、經得起推敲的可靠可信的證據。相反,美國病毒學家一再進行功能增益研究,則是一個確鑿無疑的鐵的事實!Trump政府2017年12月19日撤銷了奧巴馬禁令(功能增益研究禁令),支持美國科學家開展功能增益研究,並為其提供聯邦經費。Trump政府此舉打開了潘多拉災難之盒。奧巴馬禁令撤銷兩年後,新冠大疫情就發生了,這只是一種巧合嗎?
美國功能增益研究的代表人物之一是頂級冠狀病毒、埃博拉病毒學術權威Ralph S. Baric。如前所述,Ralph S. Baric領導的北卡團隊2015、2016年接連發表了兩篇功能增益研究的重磅論文。
這裡存在一個問題:為什麼2014年10月發布的奧巴馬功能增益研究禁令對Ralph S. Baric團隊形同虛設?
奧巴馬禁令實際上是一個暫停令,全文見:
http://www.phe.gov/s3/dualuse/Documents/gain-of-function.pdf
它並沒有絕對禁止功能增益研究,奧巴馬政府只是暫停了對流感、SARS、MERS相關的功能增益研究的資金支持,並要求對功能增益研究進行廣泛、健全、客觀、嚴格的審議及確保聯邦對功能增益研究的有效監督。該暫停令允許通過客觀、嚴格的審議,個別批准某些功能增益研究實驗或某些類別的功能增益研究實驗。
由2015年論文的“Biosafety and biosecurity”及“Acknowledgements”兩部分的相關說明可知,論文相關的研究在涉及流感、MERS、SARS的Gain-of-Function研究資金暫停前已啟動;暫停令發布後,美國國立衛生研究院(NIH)經過“審查”,批准了Ralph S. Baric團隊繼續進行這一研究的要求。就這樣,Baric團隊在奧巴馬暫停令發布後仍然完成了兩項與SARS直接相關的病毒嵌合-功能增益研究並正式發表了論文。2016年論文中也有相似的“Biosafety and Biosecurity”說明。
2015年11月9日的《自然醫學》(Nature Medicine)論文也不是Ralph S. Baric基因改造-病毒嵌合-功能增益方面的第一篇論文,Ralph S. Baric從事功能增益研究的歷史至少可追溯到2008年。
2008年12月16日,Ralph S. Baric等人在PNAS(美國國家科學院院刊)發表了一篇論文:Synthetic recombinant bat SARS-like coronavirus is infectious in cultured cells and in mice(合成的重組蝙蝠類SARS冠狀病毒在培養細胞和小鼠中具有傳染性)
https://www.pnas.org/content/105/50/19944
Ralph S. Baric是此論文的第一通訊作者。Baric等人在該論文相關研究中用SARS-CoV的RBD替換了蝙蝠冠狀病毒的RBD,合成了嵌合病毒Bat-SRBD,這個蝙蝠冠狀病毒的人工變異體可有效感染表達人類ACE2的轉基因小鼠DBT細胞、表達果子狸ACE2的轉基因小鼠DBT細胞,以及靈長類動物的Vero E6細胞(非洲綠猴腎細胞系細胞),並在細胞內大量複製。Bat-SRBD還能感染人氣道上皮的纖毛細胞。也就是說,這一嵌合病毒實驗擴展了蝙蝠冠狀病毒的感染能力,製造出了一種可跨物種傳播的新病毒。
註:小鼠DBT細胞,指小鼠延遲腦腫瘤細胞,或稱為小鼠星形細胞瘤遲發性腦瘤細胞。
這篇2008年病毒嵌合-功能增益論文得到了美國國立過敏和傳染病研究所(National Institute of Allergy and Infectious Diseases,NIAID)的支持。
Ralph S. Baric及其團隊成員還參與了吉利德公司(Gilead Sciences Inc.)抗病毒特效藥瑞德西韋(Remdesivir)的合作研發。2017年6月28日,Baric團隊(北卡羅來納大學教堂山分校流行病學系)、范德堡大學醫學中心、波蘭Jagiellonian University、吉利德科技等在《ScienceTranslational Medicine》雜誌上聯合發表了一篇論文:Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses(廣譜抗病毒藥物GS-5734可抑制流行性和人畜共患冠狀病毒)
https://stm.sciencemag.org/content/9/396/eaal3653
論文中的GS-5734就是瑞德西韋(Remdesivir)。論文指出:目前正在臨床開發的用於治療埃博拉病毒的GS-5734 對多種病毒,包括SARS-CoV 和 MERS-CoV都有明顯的抑制療效,GS-5734的預防性和早期治療顯著降低了肺病毒載量,改善了臨床症狀以及呼吸功能。
Ralph S. Baric是該論文的第二通訊作者,論文的第一至第五作者,全都是Baric團隊成員,其中第四作者Vineet D. Menachery(維內特·德梅納赫里),就是2015、2016年兩篇嵌合病毒論文的第一作者。
至此,本文已介紹了Ralph S. Baric的6篇論文,它們是:
1) 2003年10月合成SARS-CoV cDNA並進而組裝出SARS-CoV病毒毒株的論文;
2) 2008年12月合成嵌合病毒Bat-SRBD的論文;
3) 2013年10月合成MERS-CoV cDNA並進而組裝出MERS-CoV病毒毒株的論文;
4) 2015年11月合成嵌合病毒SHC014-MA15的論文;
5) 2016年3月合成嵌合病毒WIV1-MA15的論文;
6) 2017年6月,證明埃博拉病毒治療藥物瑞德西韋(Remdesivir,GS-5734)對SARS-CoV、MERS-CoV及其它多種病毒都有明顯抑制療效的論文。
上述論文中,至少有3篇對病毒進行了功能增益改造(2008、2015、2016),人為增強了病毒的致病力或增強、擴展了病毒的感染、傳播能力。6篇論文都對病毒進行了人工合成、組裝,包括2017年的瑞德西韋論文。在2017年論文中,Ralph S. Baric等人利用反向遺傳克隆平台,人工合成、組裝了7種冠狀病毒的毒株:SARS-CoV、MERS-CoV、HCoV-NL63(人類冠狀病毒NL63)、HKU3(蝙蝠冠狀病毒HKU3)、HKU5、WIV1(rs3367)和SHC014(rsSHC014),並以它們來試驗瑞德西韋的病毒抑制效果。
6篇論文相關的研究都得到了美國國立衛生研究院(National Institute of Health,NIH),或NIH下屬的美國國家過敏與傳染病研究所(National Institute of Allergy and Infectious Diseases,NIAID)的資助或支持。美國國立衛生研究院(NIH)的院長是弗朗西斯·柯林斯(Francis S. Collins),美國國家過敏與傳染病研究所的所長是白宮首席醫學顧問安東尼·福奇(Anthony Fauci)。
誰在進行功能增益研究?NIH資助了哪些人的功能增益研究?美國政府、政府官員與功能增益研究有着怎樣的關係?
Ralph S. Baric團隊還與美國軍方有着密切的合作。病毒改造的核心平台--反向遺傳克隆平台,就是該團隊與迪特里克堡的美國陸軍傳染病醫學研究院,以及范德堡大學醫學中心聯合研發的;該團隊2015年病毒嵌合改造論文實驗所用的培養病毒的Vero E6細胞,也是美國陸軍傳染病醫學研究院提供的;該團隊2013的MERS病毒cDNA論文得到了美國國防威脅降低局(DTRA,Defense Threat Reduction Agency)的資助。
(未完待續)















