(二)
是我在撒謊,還是他們在撒謊?
最危險的,不是自然界中的動物,而是那些在實驗室中編輯、改造病毒基因,人為增強病原體致病能力、傳播能力的人。能否樹立這一常識,禁止或高度警惕、防範基因改造、病原體功能增益行為,並採取可靠、有效的措施(如嚴格的立法、完善的公民社會監督系統),關繫到每一個人的安全,關繫到我們子孫後代的安全、健康和幸福,關繫到人類未來的命運。
我們需要真相。
接續:新冠,科學瘋子設計的病毒集大成者(一)
展開後續內容之前,先貼一張冠狀病毒結構示意圖。
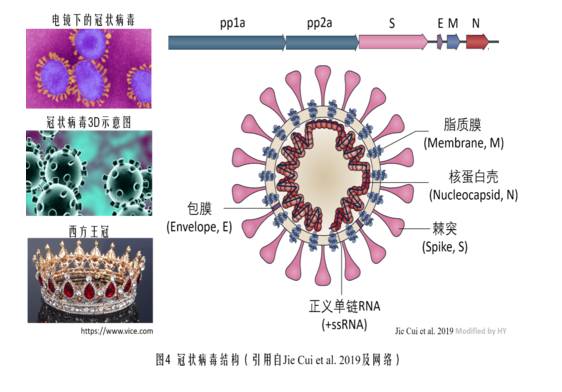
本文將聚焦新冠病毒的刺突蛋白三關節式組合鉸鏈,介紹、展開論文依據,分析其人為設計性,並對相關設計嫌疑人進行初步探查。
II、刺突蛋白三關節式組合鉸鏈設計
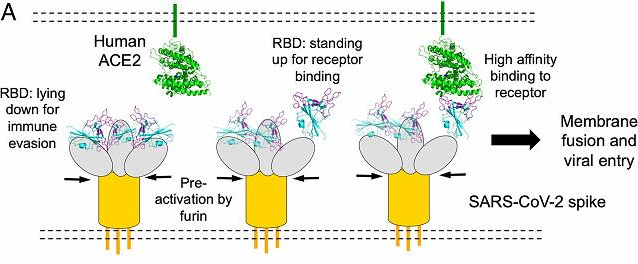
參考SARS-CoV、MERS-CoV(中東呼吸綜合症冠狀病毒)、 PEDV(豬流行性腹瀉病毒)等病毒的簡單鉸鏈結構,為新冠刺突蛋白設計了非常精巧、靈活的(可能是前所未有、獨一無二的)三關節式組合鉸鏈結構,這組關節式鉸鏈與人體髖、膝、踝三個關節的運動機制類似,它們有如下功能:
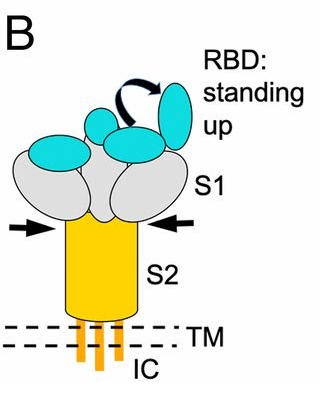
a) 當“關節”挺直時,刺突蛋白向上運動,RBD將暴露出來以便與宿主受體ACE2結合;
b) 當“關節”彎曲時,刺突蛋白向下運動,RBD將處於“躺臥”狀態並隱藏在刺突蛋白三聚體頭部之中,避免被宿主免疫系統或抗體藥物搜索到。
c) 三個“關節”非同尋常的活動能力和自由度,使新冠刺突蛋白(及RBD)能夠以不同高度、角度和姿態相當靈活地接觸ACE2受體並與之結合,大大提高了感染宿主細胞的效率。
d) 新冠病毒逃避抗體藥物結合的能力,以及逃避免疫系統搜索、打擊的能力遠超SARS病毒,重要原因之一,就是它有SARS所沒有的,SARS的簡單鉸鏈所無法比擬的三關節式組合鉸鏈。
上述“刺突蛋白三關節式組合鉸鏈”結構及功能歸納自以下三篇論文。
論文一。
2020年3月13日,美國德克薩斯大學奧斯汀分校Jason S McLellan團隊,及美國國家過敏和傳染病研究所的研究人員在《Science》雜誌上發表了一篇論文:Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion Conformation(膜融合前構象中2019-nCoV刺突蛋白的冷凍電鏡結構)
https://science.sciencemag.org/content/367/6483/1260
這篇論文在上篇文章中簡單介紹過,當時是用來說明RBD5個關鍵氨基酸設計所取得的如下設計效果: 2019-nCoV(新冠,SARS-CoV-2的舊稱)S蛋白與hACE2的結合親和力,比SARS-CoV S蛋白與hACE2的結合親和力高10-20倍。
註:S蛋白即Spike蛋白,即刺突蛋白或棘突蛋白。
這次,我們較全面地介紹一下該論文的要點(其中b、c兩項與“三關節式組合鉸鏈”有關):
a) 確定了(膜)融合前構象中2019-nCoV刺突蛋白三聚體的3.5埃分辨率冷凍電子顯微鏡結構;
b) 新冠刺突蛋白可通過鉸鏈式構象運動,使S1亞基呈現出兩種狀態:向下構象與向上構象。向下構象對應着不可接近宿主細胞受體的狀態(隱藏RBD的狀態),向上構象則對應着可接近受體的狀態(暴露RBD的狀態)。刺突蛋白三聚體可通過向上旋轉將向下構象轉變為向上構象。通過兩種構象的切換,新冠病毒可隱藏或暴露與ACE2結合的RBD部位。
c) 類似的鉸鏈式構象運動在以下三種病毒的結構特徵研究中也曾發現過:與新冠同譜系的β譜系冠狀病毒SARS-CoV、MERS-CoV,關係較遠的α譜系冠狀病毒PEDV(Porcine epidemic diarrhea virus,豬流行性腹瀉病毒) 。
d) 表面等離子體共振量化研究表明,新冠S蛋白(刺突蛋白)與ACE2的結合親合力,比SARS-CoV S蛋白與ACE2的的結合親和力高10至20倍;
e) 2019-nCoV刺突蛋白、ACE2結合後形成的複合物,與SARS-CoV刺突蛋白、ACE2結合後形成的複合物非常相似;
f) 對SARS-CoV有效(能代替ACE2強力結合SARS的RBD)的三種單克隆抗體(S230、m396 和 80R)對2019-nCoV都無效(不能有效結合新冠的RBD)。
論文二。
2020年10月9日,德國海德堡歐洲分子生物學實驗室、法蘭克福馬克斯普朗克生物物理研究所、法蘭克福歌德大學生物物理研究所等機構的一組德國科學家(Gerhard Hummer等)在《Science》雜誌發表了一篇論文:In situ structural analysis of SARS-CoV-2 spike reveals flexibility mediated by three hinges(原位結構分析揭示了由三個鉸鏈介導的新冠刺突蛋白的靈活性)
https://science.sciencemag.org/content/370/6513/203
論文部分要點歸納如下:
a) 新冠刺突蛋白刺突頭部與病毒包膜之間的莖幹部分似乎是動態的,電子斷層掃描圖像表明,頭部之下、跨膜區域之上的刺突蛋白莖幹中存在三個柔性鉸鏈。
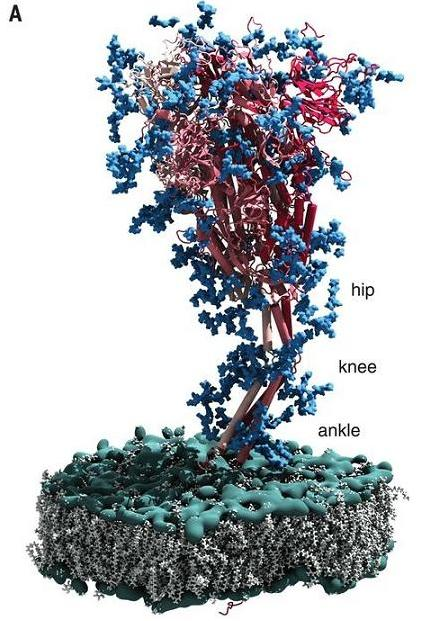
b) 這三個鉸鏈與人類的髖、膝、踝三個關節類似,不妨稱之為新冠刺突蛋白的髖關節、膝關節和踝關節。三個關節中,膝關節的可屈曲幅度最大,其次是踝關節,髖關節可屈曲幅度最小。通過三個關節的屈曲或挺直,刺突蛋白可側移(橫向位移)、傾斜、或直立,可調節其頭部RBD的空間位置、高度和活動方向,甚至刺突蛋白的頭部及RBD可貼近病毒包膜,處於倒伏的狀態。
註:新冠刺突蛋白的踝關節位於S2蛋白的跨膜區域之上並貼近病毒包膜。論文沒有明確指出另外兩個關節的準確位置,結合論文有關內容,我的推測是:髖關節大致位於S1蛋白的三聚體頭部之下,膝關節可能位於S1蛋白、S2蛋白的連接處附近。
c) 新冠刺突蛋白被相當龐大的聚糖鏈裝飾,它的表面被這些廣泛存在的N-糖基化位點所覆蓋;髖、膝、踝三個關節處的N-糖基化覆蓋、裝飾情況尤為顯著。這三個部位的N-糖基化裝飾可能有助於保護功能重要的鉸鏈免受抗體結合併保持它們的靈活性。
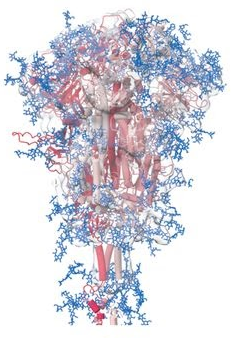
新冠刺突蛋白被N-糖基化位點(聚糖鏈)覆蓋、裝飾示意圖。蘭色圖案代表N-糖基化位點(聚糖鏈)。
d) 三個柔性關節賦予的刺突蛋白的運動自由度可能有助於新冠病毒逃避抗體與其RBD的結合;
e) 三個柔性關節賦予的刺突蛋白的運動自由度還可能使新冠病毒便於接觸宿主細胞相對平坦的(細胞膜)表面,並有助於其RBD以更高的親和力,更靈活的姿態,更有效地結合細胞表面的ACE2受體。
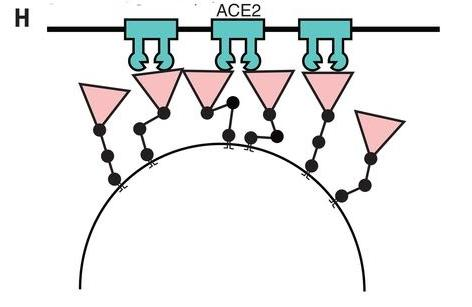
關節式鉸鏈促進刺突蛋白與受體接合示意圖。圖中的刺突蛋白能以不同的高度、角度、姿態靈活地接觸、結合ACE2受體。
f) 就我們所知,與新冠刺突蛋白這種廣泛的(註:高度自由的)靈活性相當的特性,其他I類融合蛋白(註:冠狀病毒刺突蛋白也是一種I類融合蛋白),包括HIV env、流感HA或Ebola GP,都尚未報道過,儘管流感HA的短接頭結構允許高達25°的彎曲。(註:即,含其它I類融合蛋白的病毒可能都沒有類似新冠的三關節結構)
註:HIV env,指艾滋病病毒(HIV)表面包膜糖蛋白Env三聚體,它介導HIV病毒與宿主細胞發生膜融合,是HIV-1疫苗研究的重要靶點;
流感HA,即流感病毒血球凝集素蛋白(HemAgglutinin,HA),它是流感病毒表面的一種囊膜蛋白,是流感病毒結合宿主細胞受體的主要工具,相當於冠狀病毒的刺突蛋白;
Ebola GP,指埃博拉病毒表面的包膜糖蛋白(glycoprotein,GP),它介導Ebola病毒與宿主細胞發生膜融合,作用與HIV env類似。
HIV病毒屬於逆轉錄病毒科,慢病毒屬; 流感病毒屬於正黏液病毒科,下分甲、乙、丙、丁四個屬;Ebola病毒屬於絲狀病毒科,埃博拉病毒屬。它們都不屬於冠狀病毒科,都不是冠狀病毒。
新冠刺突蛋白的這種三關節式組合鉸鏈結構應該是首次在病毒研究中發現。從論文一的相關引用論文判斷,SARS-CoV、MERS-CoV、PEDV三個病毒刺突蛋白中的鉸鏈很可能都是簡單的單一鉸鏈,因為被引用論文無一指出相關病毒刺突蛋白中存在一個以上的鉸鏈(hinge);論文二要點f)指出,含其它I類融合蛋白的非冠狀病毒(HIV、流感、Ebola)都未報道過類似的三關節式組合鉸鏈結構。那麼,同樣含刺突蛋白這種I類融合蛋白的其它冠狀病毒(包括SARS-CoV、MERS-CoV、PEDV)是否有類似結構呢?如果之前有論文報告過類似的三關節式組合鉸鏈結構,無論其是否發現於冠狀病毒,我相信,論文一、論文二,及稍後將介紹的論文三的作者們一定會指出來,這麼重要的發現,他們不會全都不知道。
因此,新冠刺突蛋白的三關節式組合鉸鏈結構,不僅應該是首次在病毒研究中發現,而且有可能在病毒中是獨一無二的(截止目前)。
新冠刺突蛋白的三關節式組合鉸鏈結構,是無人為干預地自然演化產生的嗎?理論上存在這種可能性。但無論通過自身變異或重組,自然演化、獲得或產生如此複雜、精巧的結構必然要經歷漫長的歲月,留下由簡單到精巧,由低級到高級的階段性演化印跡。新冠刺突蛋白的鉸鏈不同於SARS等病毒的簡單鉸鏈,它含三個鉸鏈,而且,這三個鉸鏈不是彼此無關的,它們能高度協調地配合工作。突如其來地從簡單鉸鏈“演化”出三關節式組合鉸鏈,看不到任何類似的高級結構,看不到任何過渡性的中間演化產物,這樣的演化太神奇、太不可思議了。
新冠病毒刺突蛋白的三關節式組合鉸鏈結構,可能是隨機性、無目的自然演化的結果嗎?
來歷不明的新冠病毒在“自然演化”過程中完成的不可思議的奇蹟是不是太多了一點?
論文三。
2020年5月26日(first published May 6, 2020),美國明尼蘇達大學李放團隊在美國科學院院報(PNAS)發表了一篇論文:Cell entry mechanisms of SARS-CoV-2(新冠病毒的細胞進入機制)
https://www.pnas.org/content/117/21/11727
論文揭示了新冠病毒感染人體細胞以及免疫逃逸的機制。與“刺突蛋白三關節式組合鉸鏈”相關的論文要點歸納如下:
a) 和SARS病毒一樣,新冠的RBD也可以在站立姿勢和躺臥姿勢之間不斷切換。站立姿勢的RBD適合與受體進行結合;躺臥姿勢的RBD非常不適合與受體結合,但可以使RBD隱藏起來逃避免疫系統的搜索、攻擊或抗體藥物的結合。
b) Cryo-EM(低溫電子顯微鏡或冷凍電鏡) 研究表明,SARS刺突蛋白RBD處於站立狀態的頻率更高,而新冠刺突蛋白RBD則更常處於躺臥狀態。
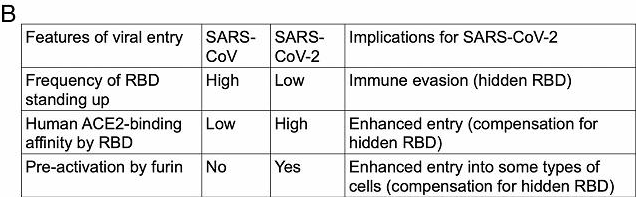
c) 表面等離子體共振(SPR)檢測結果表明,新冠RBD與hACE2的結合親和力顯著高於SARS病毒RBD;但蛋白質下拉測定的結果卻是:新冠刺突蛋白與hACE2的結合親和力低於SARS刺突蛋白與hACE2的結合親和力。
註:為什麼兩種測定的結果不一致?因為新冠有更多RBD處於躺臥狀態,不適於結合hACE2,更多處於躺臥狀態的RBD(或刺突蛋白)拉低了蛋白質下拉測定的結果。
d) 病毒通常使用兩種主要策略隱藏RBD或刺突蛋白的其他關鍵部分,以避免觸發宿主的適應性免疫反應。第一種是構象掩蔽,將RBD隱藏在峽谷(如小核糖核酸病毒)或凹陷的口袋(如HIV)等位置、結構處。第二種是聚糖屏蔽,利用聚糖簇來屏蔽、隱藏刺突蛋白的關鍵部分(如HIV、埃博拉病毒、丙型肝炎病毒)。新冠病毒將RBD隱藏在刺突蛋白三聚體頭部內的方式屬於構象掩蔽策略。
註:除構象掩蔽外,新冠病毒還應用了聚糖屏蔽,而且應用了兩種聚糖屏蔽方式。第一種聚糖屏蔽是用大量的聚糖鏈(N-糖基化位點)覆蓋、裝飾刺突蛋白的三個關節式鉸鏈,使其免受抗體結合。參見論文二要點c) ;第二種聚糖屏蔽是用O-Linked聚糖結構來形成糖鏈屏障。參見上篇文章內容摘要部分列舉的第5項人為設計特徵:O-Linked聚糖設計。
e) 最近的一項研究顯示,
https://www.nature.com/articles/s41422-020-0305-x
SARS-CoV RBD誘導的小鼠血清也能以高親和力結合SARS-CoV-2 RBD,但對SARS-CoV-2假病毒感染宿主細胞的中和作用卻很差;相比之下,相同的血清不僅能以高親和力結合SARS-CoV RBD,並且能有效地中和SARS-CoV假病毒對宿主細胞的感染(註:假病毒是人工改造或人工合成的,去除了致病力的缺陷型病毒,用於更安全、便利地模擬研究原生病毒的行為)。
註:為什麼小鼠血清中的抗體能有效結合新冠RBD,卻不能阻止新冠對細胞的感染?這應該是因為,(在實際感染環境中)新冠RBD有效地躲避了抗體,使抗體很少有機會與之接觸並進而發生結合。上述研究結果或許可以表明,新冠隱蔽RBD,逃避抗體結合的“技能”,遠比SARS高超。
f) 新冠的RBD隱藏“技能”還延遲了免疫反應,或使免疫反應不足。
註:這應該是新冠潛伏期較長的原因之一。
g) 新冠逃避宿主免疫系統監視、搜索、打擊的能力也明顯比SARS出色,這可能是許多新冠患者只能產生低水平的抗體並長期患病的原因之一。
h) 新冠隱藏RBD的技能加大了抗體研發的難度,有效的新冠抗體藥物應能在新冠RBD的有限暴露期間快速鎖定並非常緊密地保持與RBD的強力結合。
李放團隊的這篇論文還(率先?)指出新冠病毒存在furin蛋白酶切位點,並實驗證實了furin蛋白酶在新冠感染過程中的顯著作用,論文同時實驗確認了其它一些蛋白酶,包括TMPRSS2(跨膜絲氨酸蛋白酶2),及某些溶酶體組織蛋白酶在新冠感染中的作用。這些內容可能會在後續文章中引用、介紹。
誰設計了“刺突蛋白三關節式組合鉸鏈”?
上篇文章指出,新冠設計者參照跨物種傳播能力最強的病毒rs3367(WIV1),復用+替代rs3367的五個關鍵氨基酸,設計出了新冠病毒RBD的五個關鍵氨基酸。“RBD關鍵氨基酸設計”的最大設計嫌疑人是北卡羅來納大學教堂山分校的國際病毒學頂級權威Ralph S. Baric(拉爾夫.巴里克)及其團隊。
Ralph S. Baric團隊對rs3367(WIV1)做過非常深入、反覆的研究,包括功能增益研究。上篇文章已經介紹了部分與rs3367(WIV1)相關的Baric團隊論文,但還非常不完備。有必要專門整理出一篇更全面的文章,例舉、介紹Ralph S. Baric團隊發表過的,改造rs3367(WIV1),或利用rs3367進行病毒改造的論文,及其它研究、涉及rs3367的論文;同時例舉、介紹該團隊對刺突蛋白進行改造的論文,包括使用刺突蛋白或其一部分進行病毒嵌合的論文,對RBD進行基因編輯和氨基酸替換的論文,對RBD外的S1蛋白其它部分進行基因編輯、氨基酸替換的論文,對S2蛋白進行基因編輯、氨基酸替換的論文等。在關注候選論文的過程中,我發現,Ralph S. Baric及其團隊發表過的涉及病毒改造(包括功能增益改造)或病毒人工合成的論文比我之前已知的要多得多,較完備地搜集、閱讀、歸納、總結相關論文將花費大量的時間和精力。但我稍後將進行這一工作,即使文章的初始版本只能總結、展示Ralph S. Baric及其團隊相關論文中的一部分。
Ralph S. Baric或其團隊成員是否也有設計“新冠刺突蛋白三關節式組合鉸鏈”的嫌疑?答案是肯定的。我先提供一組證據。
上篇文章介紹了Ralph S. Baric團隊2016年3月14日發表於PNAS(Proceedings of the National Academy of Sciences of the United States of America,美國國家科學院院刊)的以rs3367(WIV1)為研究主角的病毒嵌合-功能增益論文(用rs3367即WIV1的刺突蛋白+SARS-CoV-MA15的骨幹合成了人、小鼠致病性嵌合病毒WIV1-CoV):SARS-like WIV1-CoV poised for human emergence(類SARS冠狀病毒WIV1-CoV有產生人類流行疫情的潛在危險)
https://www.pnas.org/content/113/11/3048
論文“Discussion”部分指出:除受體結合域(RBD)外,S1蛋白的其餘部分及S2蛋白的變化也可能在冠狀病毒感染、傳播、發病機制中發揮關鍵作用。這些刺突蛋白區域可能會影響蛋白酶的靶向性,刺突的切割特性或擴展性,它們的某些變化可能使病毒獲得更健全的感染能力(原文:Whereas the receptor binding domain had garnered the most interest, changes in the remaining portion of S1 as well as the S2 portion of spike may also play a critical role in facilitating CoV infection, transmission, and/or pathogenesis.Differences in these regions of spike may yield increased protease targeting, enhanced spike cleavage, and/or expanded tropism leading to more robust infection for the epidemic SARS strains)。
這段文字實際上提出了以完善、健全病毒感染能力為目標的病毒改造建議和實驗方向,即:進一步改造RBD之外的刺突蛋白部分,如改造S1蛋白RBD外的部分,或改造S2蛋白,改造產生的變化可能使刺突蛋白更有針對性(靶向性、目的性)地與蛋白酶發生作用,可能增加刺突蛋白的切割(被蛋白酶切割)特性,可能使刺突蛋白更具擴展性。
令人驚奇的是,這三項病毒改造建議兼預測,即與蛋白酶作用的針對性、刺突蛋白新的酶切特性、刺突蛋白的擴展性(及靈活性),全都在新冠病毒中實現了!它們都是通過改造刺突蛋白的RBD外部分實現的。其中,與蛋白酶作用的針對性、刺突蛋白的擴展性(及靈活性)這二項特性,都是“刺突蛋白三關節式組合鉸鏈設計”所賦予的。三關節式組合鉸鏈橫跨S2蛋白和S1蛋白的RBD外部分,它正是通過對這兩部分施以基因改造而實現的,進而賦予了新冠與蛋白酶作用的針對性,提高了刺突蛋白的擴展性(、靈活性)。
關於新冠刺突蛋白的擴展性、靈活性。由論文二、論文三相關要點可知,新冠刺突蛋白或其RBD能夠彎曲、挺直,收縮、伸展,傾斜(甚至倒伏或躺臥)、直立,變換方向,這表明,三關節式組合鉸鏈設計大大提高了新冠刺突蛋白的擴展性和靈活性;
關於新冠與蛋白酶作用的針對性。同樣由論文二、論文三可知,新冠RBD“平時”可以非常有效地隱蔽起來,逃避人類抗體或抗體藥物的結合,逃避免疫系統的搜索和攻擊,在需要時,它又可以暴露出來,以不同的高度、角度、姿態靈活、高效地接觸、結合ACE2受體。這表明,三關節式組合鉸鏈設計也高質量地賦予了新冠RBD與蛋白酶(ACE2)作用、結合的針對性或者說靶向性、目的性。注意,ACE2(Angiotensin Converting Enzyme2,血管緊張素轉換酶2)受體,本身就是細胞表面的一個膜蛋白酶。
刺突蛋白新的切割(酶切)特性,則是S1、S2蛋白交界處的furin酶切位點賦予的,這涉及新冠病毒的另一組人為設計特徵,即上篇文章內容摘要中的第3項-“furin酶切位點設計”,它將在後續文章中聚焦和展開。
Ralph S. Baric(團隊)2016年3月功能增益論文中提出的三個病毒改造建議,在新冠病毒中全都出色地實現了,這又是偶然的巧合嗎?
(未完待續)












