有人說,“雲南的RaTG13冠狀病毒與新冠病毒(只)有幾十年的進化距離”。
新冠病毒有約3萬個核苷酸(鹼基對),RaTG13冠狀病毒與新冠病毒的全基因組序列一致性(相似度)約為96.2%,差異度約3.8%,它們之間約有3.8*300~=1100個核苷酸的差異,差異比例似乎不大,但這樣的差異,對於自然演化來說,已形同天塹。
RaTG13幾十年就能進化成新冠病毒嗎?不能。RaTG13與新冠病毒至少有8組重要結構差異,其中之一是:新冠有furin酶切位點,而RaTG13沒有furin酶切位點。僅進化出furin酶切位點,就至少需要上千年。
關於無furin酶切位點的冠狀病毒進化出furin酶切位點的幾率,參見:估算舟山蝙蝠病毒一千年內進化出酶切位點的幾率
RaTG13進化為新冠,不只是時間長短的問題。2020年2月20日,南方醫科大學發表了如下論文:新型冠狀病毒SARS-CoV-2的變異和進化分析,論文明確指出:RaTG13幾乎不存在進化為新冠病毒的可能性。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7086142/


新冠病毒不是RaTG13進化產生的,那麼,有沒有其它蝙蝠冠狀病毒能在幾十年內進化為新冠病毒?
有消息說,法國巴斯德研究所和老撾大學的研究人員發現了3種與新冠病毒RBD高度相似的蝙蝠冠狀病毒。這3種蝙蝠冠狀病毒能在幾十年內進化為新冠病毒嗎?
首先我要指出,上述發現並不是什麼新發現。2020年5月7日,華南農業大學肖立華、沈永義及廣州動物園陳武等人在Nature雜誌發表了一篇論文:Isolation of SARS-CoV-2-related coronavirus from Malayan pangolins(從馬來亞穿山甲中分離出SARS-CoV-2相關的冠狀病毒)
https://www.nature.com/articles/s41586-020-2313-x

論文指出,從馬來亞穿山甲中分離出來的冠狀病毒pangolin-CoV的E蛋白、M(Membrane,脂質膜糖蛋白)、N蛋白(Nucleocapsid,核衣殼蛋白)、S蛋白(Spike,刺突蛋白)四種結構蛋白與新冠病毒對應蛋白的氨基酸序列同一性(相似度)分別為100%、98.6%、97.8%、90.7%
;特別是,pangolin-CoV的S蛋白的RBD與新冠病毒的RBD幾乎完全相同,只有一個非關鍵氨基酸差異。

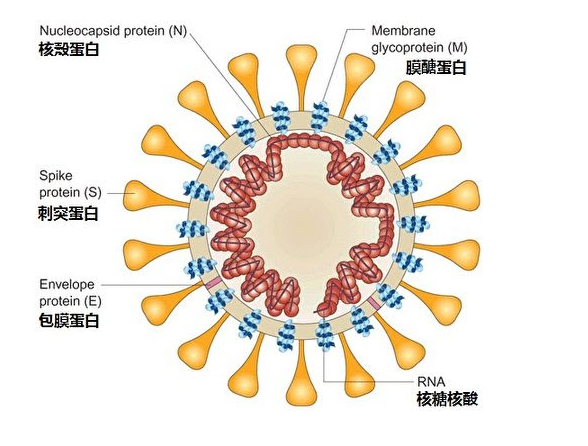
可見,早在2020年上半年,肖立華等人就已經發現了與新冠病毒RBD高度相似的穿山甲冠狀病毒pangolin-CoV,而且,該病毒與新冠病毒不只是RBD高度相似。
pangolin-CoV與新冠病毒有這麼多高度相似之處,論文發表者敢說:pangolin-CoV幾十年就能進化出新冠病毒嗎?科學界得出如下結論了嗎:新冠病毒是由穿山甲病毒進化而來的。都是沒有的事。
人們找到幾十年即可進化成新冠病毒的自然病毒了嗎?當然沒有,如果找到的話,新冠的溯源問題就解決了;有任何論文宣稱蝙蝠冠狀病毒幾十年就能變異為新冠病毒嗎?不會有這樣的論文。
RBD(Receptor
Binding
Domain,受體結合域)只含200多個氨基酸(殘基),而新冠病毒總共有約1萬個氨基酸(殘基)。法國、老撾研究人員發現的3種RBD與新冠高度相似(即200多個氨基酸高度相似)的蝙蝠冠狀病毒與新冠病毒的自然演化距離有多遠?差着一千個銀河系。
幾十年的時間蝙蝠冠狀病毒無法演化為新冠病毒;那麼,時間再長點,情況又如何呢?就是經過一億年,蝙蝠冠狀病毒也難以自然演化為新冠病毒。這麼說是不是太誇張了?一點也不誇張。
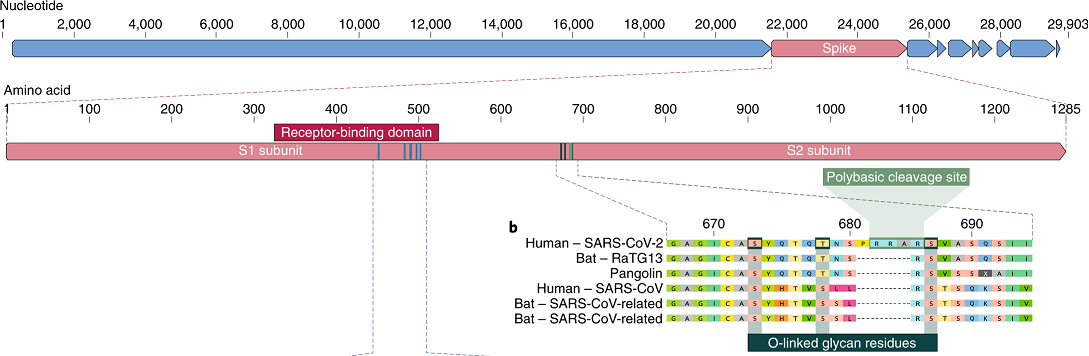
新冠病毒在刺突蛋白S1、S2亞基交界處這個決定感染能力的關鍵位置恰恰有一個furin酶切位點,即RRAR四氨基酸(殘基)組合。由於具備furin酶切位點,新冠病毒能以膜融合的方式迅速向細胞內釋放其RNA並立即展開病毒複製;相比只能以胞吞方式進入細胞的SARS病毒,新冠病毒感染細胞、在人體內複製擴散的效率提高了100~1000倍。
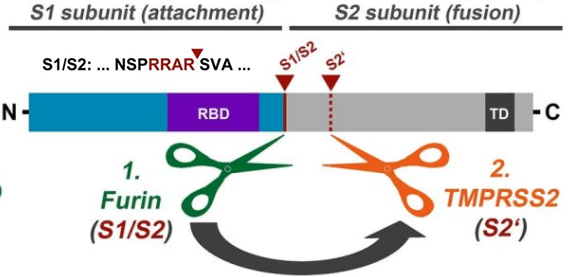
如果新冠病毒是蝙蝠冠狀病毒進化而來的,那麼,它的祖先應該是一個有furin酶切位點的蝙蝠冠狀病毒。哪種蝙蝠冠狀病毒有furin酶切位點?答案是:沒有任何一種蝙蝠冠狀病毒有furin酶切位點!
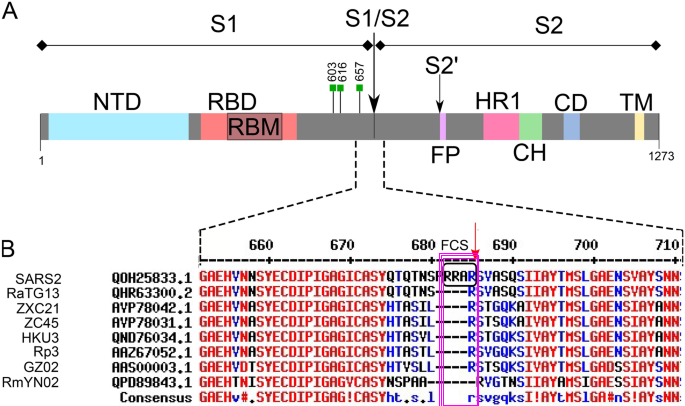
在漫長的自然演化長河中,沒有一種蝙蝠冠狀病毒演化出furin酶切位點,它們可能演化出新冠病毒嗎?
新冠病毒furin酶切位點RRAR四氨基酸組合中的雙精氨酸RR對應的核苷酸短序列為:CGGCGG,這種雙CGG結構在自然病毒中極為罕見,沒有人報告過,在蝙蝠冠狀病毒中存在這種雙CGG結構。
註:一個氨基酸(殘基)對應三個核苷酸(鹼基對)組合,同一個氨基酸(殘基)可以對應不同的三核苷酸組合(密碼子)。精氨酸有六種核苷酸組合(密碼子):CGU、CGC、CGA、CGG、AGA、AGG。

新冠病毒刺突蛋白中有一個精巧的三關節式組合鉸鏈結構,它的功能是:使刺突蛋白RBD更靈活地接觸、結合ACE2受體;使RBD躲避抗體的結合。這一結構從未在蝙蝠冠狀病毒中發現過,從未在任何病毒中發現過。
參考文章:
出自科學瘋子之手的病毒集大成者(二)
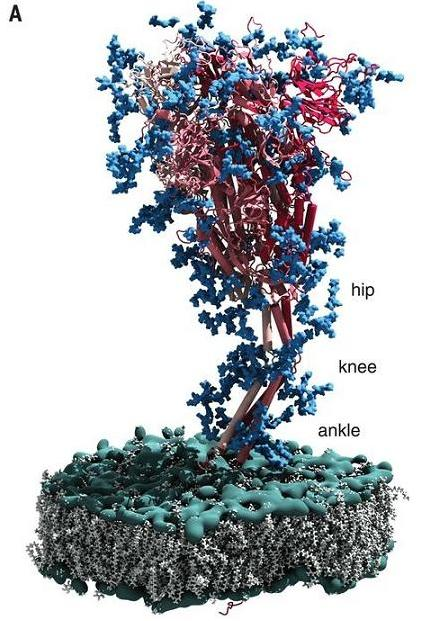
新冠病毒刺突蛋白髖、膝、踝三關節式絞鏈結構示意圖
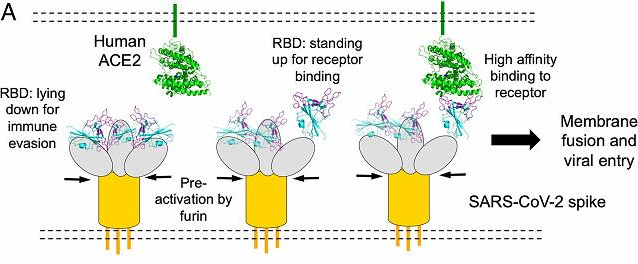
新冠病毒刺突蛋白RBD倒伏以免疫逃避(逃避抗體結合),直立以結合ACE2受體示意圖
新冠病毒刺突蛋白的S1亞基中有與艾滋病病毒HIV-1(屬於逆轉錄病毒科、慢病毒屬)高度相似的gp120蛋白和Gag蛋白,這兩種蛋白使新冠病毒獲得了殺死CD4+T淋巴細胞,破壞人體免疫系統的能力。從未有人在蝙蝠冠狀病毒中發現過這兩種蛋白及相應的免疫破壞機制。
新冠病毒刺突蛋白S1、S2亞基交接區域有一個可屏蔽人體免疫系統打擊的O-Linked聚糖結構,這是HIV-1、埃博拉(屬於絲狀病毒科)、丙型肝炎(屬於黃病毒科)等非冠狀病毒科病毒的特殊結構,從未有人報告過,在任何蝙蝠冠狀病毒中,在任何冠狀病毒中有類似的結構,類似的免疫屏蔽機制。
圖示:新冠病毒furin酶切位點周圍的一個蘇氨酸(T),二個絲氨酸(S)形成一個O-Linked聚糖結構。
新冠病毒N蛋白中有可干擾、抑制人體免疫機能的nsp3A編碼,這是人腸道病毒71型(EV71,嬰幼兒手足口病的主要病原體之一,屬於微小病毒科)的獨特機制,沒有人報告過,在任何蝙蝠冠狀病毒中,在任何冠狀病毒中存在類似的編碼。
新冠病毒可逆轉錄自身RNA為cDNA(RNA的互補DNA)並將其整合到人體被感染細胞的DNA中,這是艾滋病病毒(HIV-1)、人類嗜T淋巴球病毒一型(HTLV-1)等逆轉錄科病毒的獨特功能,從未有人在任何蝙蝠冠狀病毒中,在任何冠狀病毒中發現過類似的功能、機制。
在漫長的歲月中,沒有任何一種蝙蝠冠狀病毒,演化出上述任何一種結構或功能。新冠病毒不可能是蝙蝠冠狀病毒自然演化產生的,新冠病毒甚至不可能是冠狀病毒自然演化產生的。
新冠病毒是借鑑多種非冠狀病毒的結構、功能,人為精心設計的跨科屬的病毒集大成者。
什麼人設計、製造了新冠病毒?
是武漢病毒研究所嗎?武漢病毒研究所沒有發表過任何一篇功能增益研究論文,沒有對病毒做過任何功能增益性改造,沒有改造出過任何一種人類致病性病毒,但有人卻一而再、再而三,反覆不休地憑空捏造、無中生有:武漢病毒研究所胡折騰高危病毒。
有人說,新冠病毒是武漢病毒研究所“胡折騰高危病毒無意間搞出來的”。
S1/S2亞基交界處的furin酶切位點,雙CGG密碼子,刺突蛋白的三關節式組合鉸鏈,S1亞基中的gp120蛋白、Gag蛋白,刺突蛋白的O-Linked聚糖結構,N蛋白中的nsp3A編碼,逆轉錄自身RNA並將其整合到人體被感染細胞DNA的功能,都是無意間搞出來的?這些結構或功能,無意間搞得出來嗎?

















