(二)拉爾夫·巴里克與新冠的furin酶切位點
上
接續:拉爾夫·巴里克與新冠病毒的不解之緣(一)
I 新冠病毒具有致病能力強大的furin酶切位點
冠狀病毒的S蛋白(spike蛋白,刺突蛋白)由兩個部分組成。位於前端,朝向外部的是S1蛋白,與S1蛋白相連並嵌入病毒包膜的是S2蛋白。S1蛋白負責與嵌在宿主細胞膜上的受體蛋白(如ACE2--血管緊張素轉換酶2,TMPRSS2--跨膜絲氨酸蛋白酶2,CD4--表面抗原分化簇4糖蛋白等等)結合,也稱為受體結合亞基(attachment subunit);S2蛋白含有融合肽,可介導病毒包膜與宿主細胞膜融合,也稱為膜融合亞基(fusion subunit)。
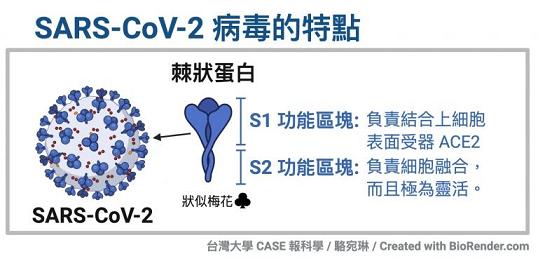
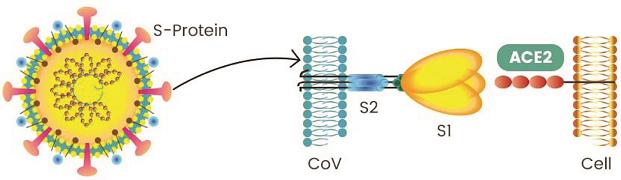
新冠病毒具有furin(弗林)酶切位點,新冠的furin酶切位點恰好位於刺突蛋白受體結合亞基S1、膜融合亞基S2的交界處。
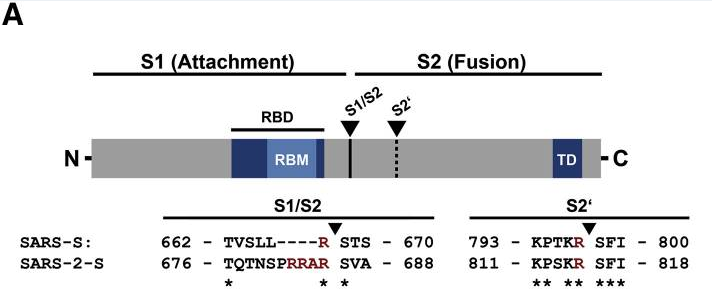
新冠病毒具有多項其近親病毒無一具有的特殊結構,furin酶切位點是其中之一。如上圖所示,相比近親病毒SARS,新冠病毒(圖中的SARS-2)S蛋白在S1、S2亞基交界處,多出了四個氨基酸(殘基)“PRRA”(脯氨酸-精氨酸-精氨酸-丙氨酸),其中後三個氨基酸“RRA”,與其後的精氨酸 “R”形成了“RRAR”(精氨酸-精氨酸-丙氨酸-精氨酸)四氨基酸組合,這一組合符合furin蛋白酶的識別模式“RXXR”(X是通配符)。S1/S2位置處(即S1、S2交界處)的“RRAR”四氨基酸組合就是新冠病毒的furin酶切位點。
人體內的furin蛋白酶在識別“RRAR”位點後,將從最後一個精氨酸“R”處對刺突蛋白進行切割,使S1、S2亞基分離。這是一個furin蛋白酶促成的水解、裂解過程。
註:“RRAR”組合末尾的精氨酸“R”是新冠S蛋白的第685個氨基酸(殘基),也是S1亞基的最後一個氨基酸(殘基)。
S1、S2亞基交界處的furin酶切位點,對新冠病毒感染、致病、傳播能力的貢獻極為巨大。
2020年2月4日,南開大學高山、阮吉壽等學者在中國預印本論文平台ChinaXiv發表了一篇題為“武漢2019冠狀病毒S蛋白可能存在Furin蛋白酶切位點”的論文,
http://chinaxiv.org/abs/202002.00004
http://swxxx.alljournals.cn/html/2020/2/20200205.html
該論文率先報告了新冠病毒中的furin酶切位點,論文指出:
1、 2019-nCoV的S蛋白可能存在Furin蛋白酶切位點,這一結構是大部分Beta冠狀病毒(新冠和SARS同處冠狀病毒的β譜系,即第二譜系,冠狀病毒共四個譜系),特別是SARS和類SARS(SARS-like)冠狀病毒所不具有的。
2、由於具有Furin酶切位點,因此,新冠的感染機制將有別於SARS等大部分Beta冠狀病毒,而與鼠肝炎冠狀病毒、HIV、埃博拉病毒和一些禽流感病毒的感染機制更相似(後四類病毒都有furin酶切位點)。
3、furin酶切位點將顯著增強新冠病毒的細胞侵染能力和傳播能力。援引一篇2005年論文中(蛋白酶介導對感染效率影響)的有關數據,2019-nCoV的細胞侵染效率將是SARS-CoV的100~1000倍。
https://www.pnas.org/content/102/35/12543
為什麼furin酶切位點如此強大,能將新冠病毒的侵染效率提高100~1000倍之多?
在感染宿主細胞時,新冠病毒需要先利用刺突蛋白前端的S1亞基結合ACE2等嵌在宿主細胞膜上的受體蛋白,將自己錨定(綁定)到細胞膜上;接着,病毒將暴露出S1、S2亞基的連接處,使這一位置處的“RRAR”酶切位點被組織環境中furin蛋白酶識別。在furin蛋白酶的作用下,刺突蛋白將被水解裂解,S1、S2亞基將被割裂、分離。
S1亞基從刺突蛋白上分離、脫落後,膜融合亞基S2將得以暴露出來,直接與細胞膜接觸,繼而介導病毒包膜與宿主細胞膜發生膜融合。二膜融合之後,包膜內的病毒RNA將進入到宿主細胞中。得到脫殼釋放的病毒RNA將在細胞內立即開始RNA自我轉錄、複製,合成各種結構蛋白、非結構蛋白、輔助蛋白,並以複製、合成的RNA及結構蛋白組裝出新的新冠病毒。
相比之下,S1/S2處沒有furin酶切位點的SARS病毒(SARS-CoV)的S1、S2亞基在受體結合後不會被切割、分離(除非在有胰蛋白酶存在的小腸)。在通常的肺部感染中,SARS的S2亞基無法暴露到刺突蛋白前端,沒有機會與細胞膜直接接觸,不能介導病毒包膜與宿主細胞膜發生“膜融合”。在完成受體結合後,SARS病毒將以一種叫做“胞吞”或“內吞”的方式“囫圇吞棗”、“連皮帶瓤”地整個被“吞”入宿主細胞中,並在部分細胞膜的包裹下形成內吞體。內吞後,SARS病毒不能立即開始病毒複製,原因是,雖然已進入細胞,但RNA還困在病毒包膜內,整個病毒還裹在內吞體中,處於被“關小號”的“禁閉”狀態。SARS病毒還需要繼續等待,等待病毒包膜與內吞體膜發生融合。細胞內的膜融合完成後,病毒RNA才能破繭而出,獲得充分自由,直到這時,它才能利用細胞資源開始病毒複製過程。
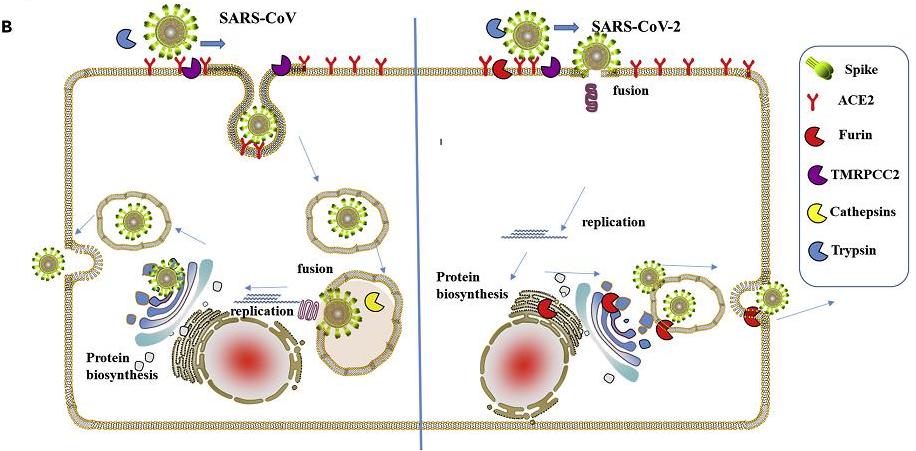
新冠與SARS細胞感染生命周期(侵入、脫殼、複製、擴散)對照圖
也就是說,新冠病毒細胞感染周期中的侵入、脫殼(釋放RNA)兩個步驟是同時完成的,而SAR病毒是分步完成的:先整體侵入,而後在細胞內脫殼。相比新冠病毒,SARS病毒的複製過程顯著遲緩,其複製出新病毒繼續擴散感染的效率明顯低下。這就是新冠病毒複製、侵染效率大大高於SARS病毒的原因所在,這一巨大優勢正是S1/S2處的furin酶切位點賦予的。
furin酶切位點的強大能力,不僅僅體現在大幅提高感染、複製、擴散效率上。
有furin酶切位點的病毒都相當牛B,其中最著名的是兩種非冠狀病毒:艾滋病病毒HIV-1、埃博拉病毒(Ebolavirus),furin酶切位點自然也為這兩種病毒的強大感染效率和致病能力作出了突出貢獻。HIV-1、埃博拉病毒還有一個共同點:它們都具備破壞人體免疫系統的特殊能力。二者的這一能力,也與furin酶切位點有關。簡單機理是,當與人體免疫細胞,如T淋巴細胞接觸時,它們能夠藉助高效的膜融合,感染、侵入T細胞。與T細胞的“膜融合”之所以能夠發生,當然是拜furin酶切位點所賜。
人體免疫細胞--淋巴細胞計數(明顯)減少是WHO和眾多國家公認的新冠感染臨床診療特徵(尤其適用於重症、危重症患者)。眾多研究表明,淋巴細胞的減少程度,與新冠感染的危重程度存在高度一致性。為什麼新冠感染會造成淋巴細胞減少?因為新冠病毒也具備一定程度的免疫破壞能力,新冠可能同時具有三種不同的免疫破壞機制、途徑,其中兩種與其furin酶切位點有關。
2020年4月7日,(前?)紐約血液中心研究員姜世勃和上海復旦大學的一個研究小組在《Nature》子刊《cellular & molecular immunology》(《細胞分子免疫學》)上合作發表了如下論文:
SARS-CoV-2 infects T lymphocytes through its spike protein-mediated membrane fusion
(新冠病毒通過其刺突蛋白介導的膜融合感染T淋巴細胞)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7136698/
論文指出:
1、新冠病毒有與艾滋病病毒類似的免疫破壞能力,它能夠攻擊、破壞人體主要免疫細胞-T淋巴細胞。新冠可能是通過受體依賴性的,S蛋白(刺突蛋白)介導的膜融合感染T淋巴細胞的。
2、新冠病毒的免疫破壞能力與艾滋病病毒(HIV-1)不完全相同(比後者弱):HIV-1能感染T細胞並在T細胞內複製、倍增;新冠只能感染T細胞,但不能在T細胞內複製,它將與被感染的T細胞一同降解、消亡(同歸於盡)。
新冠病毒還具備由刺突蛋白的其它特殊結構賦予的另一種免疫破壞機制、途徑。
2020年1月31日,印度理工學院、德里大學的普拉丹(Pradhan)教授,昆杜(Bishwajit Kundu)教授等學者在生物預印本平台BioRxiv發表了如下廣為人知的論文:
Uncanny similarity of unique inserts in the 2019-nCoV spike protein to HIV-1 gp120 and Gag
(2019-nCoV刺突蛋白中的獨特插入片斷與HIV-1 gp120和Gag的驚人相似性)
https://www.biorxiv.org/content/10.1101/2020.01.30.927871v1.full
論文指出:
1、2019-nCoV 刺突糖蛋白(S蛋白)中有4個插入片段(氨基酸序列位置:404—409,462—467,136—150,366—384,皆位於S1亞基內),這4個插入片段中的前三個片斷與HIV-1(艾滋病病毒)的gp120蛋白(包膜蛋白),第四個片斷與HIV-1的Gag蛋白(衣殼結構蛋白)相同或非常相似;
2、上述插入片斷在自然界中不太可能偶然發生,因為在SARS等其它冠狀病毒的S蛋白中,都沒有發現上述插入片段,病毒不太可能在短時間內自然地獲得這種非常獨特的插入片段;
3、gp120蛋白可幫助HIV-1與人類受體CD4(表面抗原分化簇4糖蛋白)結合。CD4糖蛋白通常附着在某些T淋巴細胞的表面,其所附着的T淋巴細胞被稱為CD4+T淋巴細胞,是人體免疫系統的重要細胞。HIV-1可利用CD4受體感染T淋巴細胞,破壞人體免疫系統。Gag蛋白也能幫助HIV-1感染某些宿主細胞。
4、在S蛋白中插入gp120蛋白與Gag蛋白後,2019-nCoV將可能獲得與HIV-1類似的能力:感染、殺死CD4+T淋巴細胞,破壞人體免疫系統。
論文一經發表,立即招致如潮批判,反駁者聲稱:“這些插入序列能與相當多物種的序列匹配上,其中大部分甚至都不是病毒。”。這樣的反駁毫無意義。上述序列片斷在多物種、非病毒中多次出現,根本不能說明,它們出現在新冠病毒中是正常的。問題的關鍵是,這些片斷也應該出現在新冠病毒的近親病毒中。然而,如論文所指出的:“在SARS等其它冠狀病毒的S蛋白中,都沒有發現上述插入片段!”沒有人反駁這一事實,批判者們無法解釋,為什麼在其它冠狀病毒的S蛋白中,都沒有發現上述片段,而偏偏在新冠病毒中,發現了這些片斷。
試問,這些基因片斷,是怎麼來到新冠病毒中的?這些其它冠狀病毒S蛋白都不存在的片斷,新冠病毒從哪裡能夠繼承得到?其它冠狀病毒都未能自然演化出與HIV相同或相似的片斷,為什麼偏偏新冠病毒獨一無二地做到了?
在明處的輿論批判和暗處的強大壓力下,這篇今天看來非常客觀、理性,一針見血的論文,一度撤稿。
前面提到的姜世勃和復旦大學的論文也遭遇了相似的命運,他們的論文同樣涉及了新冠的免疫破壞能力,及與艾滋病病毒的相關性。2020年6月初,他們在《cellular & molecular immunology》主編的“調查”壓力下,對論文進行了大幅修改,新版本中已經看不到與艾滋病病毒有關的內容了。
註:論文早期版本的介紹可參閱如下報道:
亞洲日報:新冠病毒似艾滋 可攻擊人體主要免疫細胞
https://www.yazhouribao.com/view/20200413082809536
一個月後的7月10日,他們最終撤回了自己的論文。《cellular & molecular immunology》上的撤回理由非常牽強,無法令人信服,他們應該是在某種壓力之下被迫撤回論文的,真正的撤回原因難以對外明言。
https://www.nature.com/articles/s41423-020-0424-9
什麼力量在操縱科學期刊、學術平台?什麼力量在選擇性地暗中控制、左右新冠溯源研究成果的傳播?什麼力量在壓制科學討論、辯論,阻撓真相的揭曉?
furin蛋白酶在人體器官、組織中廣泛存在,其分布的廣度、豐度甚至超過了新冠病毒使用的主要受體ACE2,因此,furin酶切位點極大地增強、加劇了新冠病毒的泛器官、泛組織感染、侵害能力。這是furin酶切位點強大能力的第三個體現。
furin酶切位點不但能促使病毒包膜與宿主細胞膜發生膜融合,它還能誘導被感染細胞發生連續的細胞-細胞間膜融合,形成稱為Syncytia(合胞體)的多核擴大細胞。研究表明,這一細胞-細胞融合機制能有效提高病毒在組織中的感染、擴散效率;新冠還可通過這一細胞-細胞融合機制內化、殺死多種淋巴細胞(另一種與furin酶切位點有關的免疫破壞機制)。這是furin酶切位點強大能力的第四個體現。
綜上所述,S1/S2位置處的furin酶切位點對新冠病毒感染、致病、傳播能力的巨大貢獻可概括為以下三個方面:
1、極大地提高了新冠病毒的侵染效率、複製效率,體內擴散能力、體外傳播能力;
2、為新冠病毒提供了兩重殺死免疫細胞,破壞免疫系統的機制、途徑;
3、極大地增強、加劇了新冠病毒的泛器官、泛組織感染、侵害能力。
II 新冠的furin酶切位點是人為設計、插入的
為什麼新冠病毒的近親病毒都沒有furin酶切位點?為什麼在furin酶切位點這一結構上,新冠病毒與它的近親病毒無一相像,反而和艾滋病病毒(逆轉錄科慢病毒屬病毒)、埃博拉病毒(絲狀病毒科病毒)、高致病性禽流感病毒(正黏病毒科病毒)這些八杆子打不着的病毒一致?合理的解釋是:有人借鑑這些特殊病毒的強大致病能力及相應結構,在新冠病毒中設計、引入了furin酶切位點。
註:艾滋病病毒gp160蛋白中的furin酶切位點是“REKR”;埃博拉病毒GP蛋白中的furin酶切位點是“RKIR”;如前所述,新冠病毒Spike蛋白中的furin酶切位點是“RRAR”;多種禽流感病毒具有不同的furin酶切位點氨基酸組合。
為什麼新冠的近親病毒,為什麼除新冠之外的其它冠狀病毒S蛋白中都沒有gp120蛋白和Gag蛋白?為什麼唯獨新冠病毒與毫無親緣關係的艾滋病病毒共有gp120蛋白和Gag蛋白?合理的解釋是:有人借鑑艾滋病病毒的免疫破壞能力及相關結構,在新冠病毒中設計、引入了gp120蛋白和Gag蛋白。
“權威機構”、“權威人士”們要麼在撒謊,要麼在攪渾水,要麼在和稀泥,要麼在裝糊塗。但這不妨礙我們獨立思考、獨立判斷,明確得出如下結論:
新冠病毒S1/S2位置處的furin酶切位點不可能是自然演化產生的,它肯定是人為設計的。
理由如下:
1、如果新冠的furin酶切位點是自然演化產生的,它應該演化自同宗的近親病毒。至少應該存在一個近親病毒,即使它沒有完全相同的furin酶切位點,也應該具有相近的結構。然而,新冠病毒的近親病毒無一在S1/S2處存在furin酶切位點,無一在該位置處存在與“RRAR”相近(>50%的相似度)的四氨基酸組合,根本無法找到該結構的進化來源。
具體而言,
a) 冠狀病毒共有四個譜系,新冠病毒位於第二譜系的第二支系,即β譜系的B支系。β譜系B支系在S1/S2處具有furin酶切位點的冠狀病毒,只有一種,就是新冠病毒。
b) 與新冠病毒刺突蛋白序列同源性(一致性、相似度)大於40%的冠狀病毒,無一在S1/S2處具有furin酶切位點。
下圖是新冠病毒(Wuhan-Hu-1毒株)與進化樹中親緣關係較近的其它冠狀病毒在S1/S2附近氨基酸序列的對照圖。新冠病毒在S1/S2處相比其它病毒多出的四個氨基酸“PRRA”在圖中極為突兀(圖中其它病毒在S1/S2處都空缺這四個氨基酸),這四個氨基酸人為插入的跡象非常明顯。
註:圖中的FCS即furin酶切位點(Furin Cleavage Site)
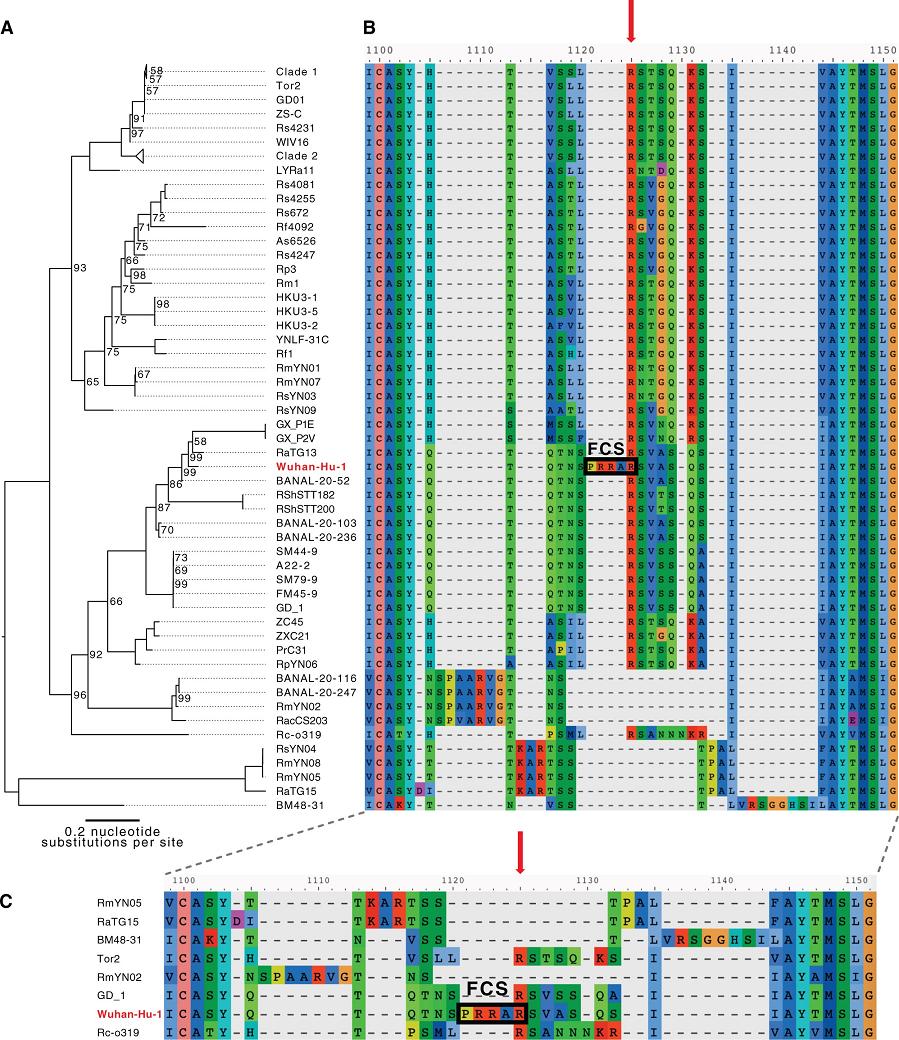
c) 與新冠病毒序列同源度最高的是蝙蝠冠狀病毒,但β譜系中的蝙蝠冠狀病毒無一具有furin酶切位點;而且,β譜系中的蝙蝠冠狀病毒亦如上圖所示,幾乎無一在S1/S2處有“增生”氨基酸,唯一在S1/S2處有“增生”氨基酸的蝙蝠冠狀病毒RmYN02的可靠性是有疑問的。RmYN02在S1/S2處的“增生”氨基酸為“P-AA”,新冠為“PRRA”。
d) 與新冠病毒受體結合域同源度最高的馬來亞穿山甲冠狀病毒也沒有上述furin酶切位點。
試問,新冠病毒從何處遺傳、繼承S1/S2處的furin酶切位點?為什麼新冠病毒的所有近親無一自然演化出S1/S2處的furin酶切位點,偏偏新冠病毒做到了?
a)、b)兩點依據摘自華中科技大學同濟藥學院李華教授、張勇慧教授等領導的團隊2020年10月5日在Cell子刊iScience上發表的如下重磅論文:
Furin A Potential Therapeutic Target for COVID-19(Furin,COVID-19的潛在治療靶點)
https://www.cell.com/iscience/fulltext/S2589-0042(20)30834-8?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS2589004220308348%3Fshowall%3Dtrue
2、新冠病毒的“RRAR”furin酶切組合在β譜系冠狀病毒中是獨一無二的,其它β譜系冠狀病毒,無一具有“RRAR”四氨基酸組合(在α譜系的貓冠狀病毒中發現過“RRAR”組合)。
試問,新冠病毒從何處遺傳、繼承了“RRAR”酶切組合?為什麼其它β譜系冠狀病毒無一自然演化出這一酶切組合,唯獨新冠病毒做到了?
++++++2022年1月13日更正++++++
此點說法有誤。β譜系A支系兩種毒性最強的小鼠肝炎病毒MHV-JHM、MHV-3在S1/S2處都含有“RRAR”furin酶切標誌。詳情參見下文:
新冠furin酶切位點實驗室探源,病毒學界的集體捂瞞
++++++更正部分結束++++++
3、由第1點中的相關內容及附圖可知,冠狀病毒在S1/S2處的基因是高度保守的,不易發生突變。冠狀病毒有約3萬個核苷酸(鹼基對)。短期內,冠狀病毒恰恰在3萬個核苷酸中高度保守的S1/S2位點自然演化出furin酶切位點的可能性極其微小。經估算,即使忽略S1/S2處的高度保守性,一百年內,新冠的近親病毒在S1/S2處自然變異出furin酶切位點“RRAR”(對應12個特定核苷酸鹼基對)的幾率,也要小於10的負10次方!詳見下文:
估算舟山蝙蝠病毒一千年內進化出酶切位點的幾率
4、新冠furin酶切位點四氨基酸組合“RRAR”中的雙精氨酸“RR”是用雙CGG密碼子(CGGCGG)表達的(精氨酸有6種密碼子表達方式,CGG是其中之一)。CGG密碼子是冠狀病毒中的罕見密碼子;雙CGG密碼子應該在自然來源的各種病毒包括冠狀病毒中從未發現或報道過,與雙CGG密碼子最接近的是一種貓冠狀病毒中的CGG-CGA 。另外,雙CGG密碼子有時在基因編輯中用來標誌人工插入片斷。
試問,新冠病毒從何處遺傳、繼承了雙CGG密碼子?為什麼其它冠狀病毒、非冠狀病毒無一自然演化出雙CGG密碼子,而偏偏又是新冠病毒獨一無二地做到了?是什麼力量讓新冠病毒總是能“人”所不能?
5、有跡象表明,新冠病毒獨有的“RRAR”酶切位點是反覆模擬、反覆實驗精心遴選出來的非常優異的furin酶切位點。前述華中科技大學同濟藥學院的iScience論文指出:新冠獨特的“RRAR”基序是一個非常高效的furin酶切組合,它很容易被furin蛋白酶識別和水解,相比經典的furin酶切位點“RVRR”,“RRAR”在furin蛋白酶作用下的水解、裂解效率是“RVRR”的2倍。
註:“RVRR”是土耳其發現的一種H7N1高致病性禽流感病毒毒株的furin酶切組合。
一窮二白的新冠祖先,不僅在S1/S2這一特殊位置處自然演化出了所有近親都不具備的致病能力極為強大的furin酶切位點,而且,不演化則已,一演化就演化出了一個比通常的furin酶切組合高效一倍的卓爾不群的furin酶切組合。這是何等牛B的自然演化,何等超自然的自然演化,何等野心勃勃、隨心所欲而又無所不能的自然演化!新冠祖先和頂級病毒學家有什麼分別?!
6、科學家能不能在(冠狀)病毒中人為設計、插入furin酶切位點?太能了!漫無目的地在S1、S2交界處精準地自然演化出furin酶切位點極難,但有目的地人為設計、插入“RRAR”則極為簡單、容易,這一定程度上是一個設計、編輯基因序列的文本工作(設計好基因序列之後,用反向遺傳平台基於基因序列合成病毒就可以了)。事實上,在(冠狀)病毒中插入furin酶切位點的實驗、研究,美國科學家早在十多年前就做過了,而且先後做過很多次。
在(冠狀)病毒中插入furin酶切位點的具體實驗、研究例證將在下篇文章中給出。
(未完待續)










