中
接續:誰設計、製造了新冠病毒(二 上)
對前文的回顧、總結與補充
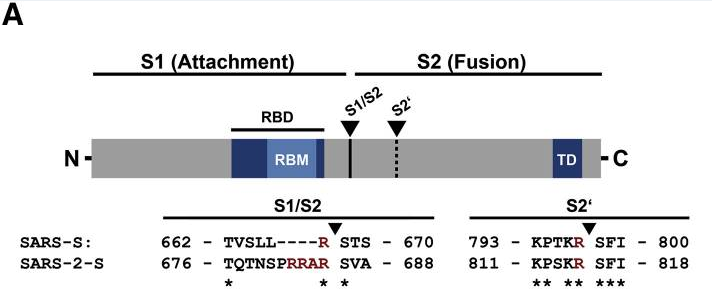
I、新冠病毒S蛋白(刺突蛋白)S1/S2處(S1/S2亞基交界處)四個(相對於其近親病毒)獨特的氨基酸插入“PRRA”(脯氨酸-精氨酸-精氨酸-丙氨酸)與其後的精氨酸
“R”(它是S1亞基的最後一個氨基酸)形成了了“PRRAR”組合,其中,後四個氨基酸“RRAR”(精氨酸-精氨酸-丙氨酸-精氨酸)就構成了新冠病毒S1/S2處的furin酶切位點。
新冠病毒S1/S2處的“PRRA”插入及“RRAR”furin酶切位點
furin酶切位點指蛋白或多肽鏈中符合“RXXR”模式(四氨基酸組合的首尾氨基酸都是精氨酸R)的氨基酸組合位點,furin蛋白酶能夠識別這一組合模式,並從最後一個R處對蛋白或多肽鏈進行切割。furin蛋白酶在人體及脊椎動物各器官、組織中廣泛存在,它分布的廣泛性和均衡性超過了新冠病毒使用的主要受體ACE2。
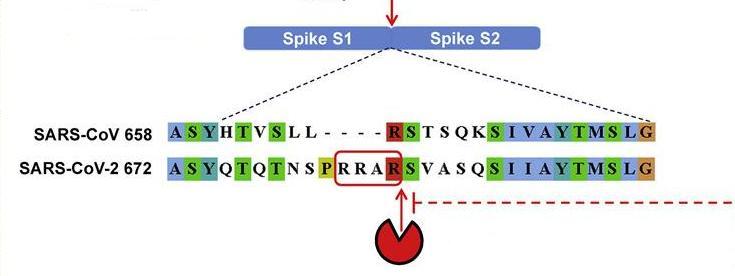
furin蛋白酶的水解切割位置
完成受體結合後,新冠病毒S蛋白在細胞膜外表被furin
蛋白酶水解切割,形成分離的S1亞基(受體結合亞基)、S2亞基(膜融合亞基)兩個部分。S1亞基切割脫落後,S2亞基得以暴露、接觸細胞膜,它的膜融合能力被激活,將介導病毒包膜與細胞膜發生膜融合。新冠病毒的RNA將在二膜融合後立即得以向細胞內釋放,病毒複製將迅速開始。為釋放病毒包膜內的RNA(RNA脫殼),冠狀病毒的病毒包膜必須在完成受體結合後與細胞膜、內體(囊泡)膜或溶酶體膜之一發生膜融合,後二者發生在內吞過程之後。不經內吞,在細胞表面與細胞膜直接融合,是最高效的脫殼、感染方式。
II、S1/S2處的“RRAR”furin酶切位點在新冠病毒致病(包括感染、致病、體內擴散、體外傳播)能力中所起的作用非常巨大,這至少體現在以下4個方面:
1、新冠病毒與細胞膜直接“膜融合”的侵染效率,是其近親病毒(如SARS)“內吞”方式的100~1000倍。
“內吞”感染的脫殼、複製比直接“膜融合”感染遲滯得多。以內吞方式進入進入細胞的SARS等病毒被隔離在內體(囊泡)中,它們要等待病毒包膜與內體膜或溶酶體膜發生融合,之後才向細胞開放環境中釋放RNA以完成感染過程並開始病毒複製。
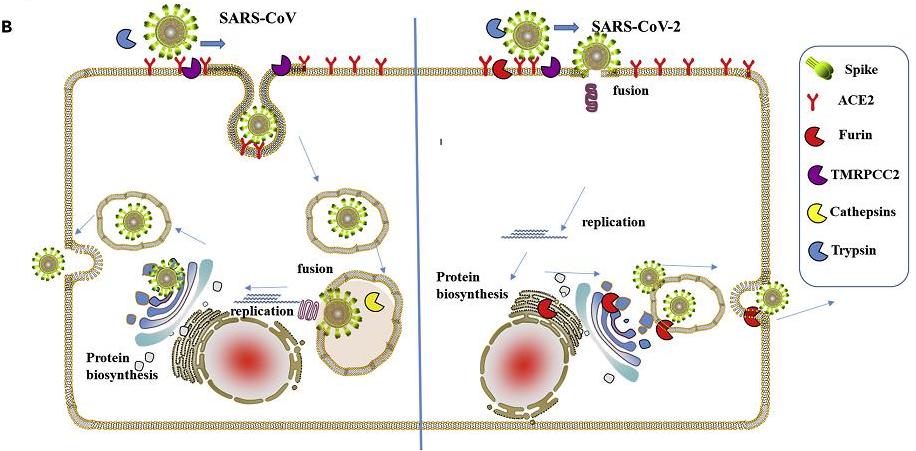
新冠與SARS細胞感染生命周期(侵入、脫殼、複製、擴散)對照圖
2、可能賦予了新冠病毒不只一重殺死免疫細胞(淋巴細胞),破壞免疫系統的機制、途徑;
3、直接膜融合的強悍侵染效率及furin蛋白酶的廣泛存在性,極大地增強、加劇了新冠病毒的泛器官、泛組織感染、擴散、侵害能力。
4、可能還賦予了新冠病毒破壞、穿透血腦屏障,感染、損傷大腦、神經系統的能力。
S1/S2處的“PRRA”四個插入氨基酸(殘基)沒有一個是多餘的。後三個氨基酸“RRA”與其後的R形成了furin酶切組合“RRAR”;第一個氨基酸-P(脯氨酸)也有特定的作用:脯氨酸P的存在很可能是為了調節融合前的構象,並降低融合的能量門檻,使新冠的病毒包膜與宿主細胞膜更容易發生膜融合。
關於脯氨酸在膜融合中的作用,可參考1998年12月英、法學者的如下論文(簡記為論文-A):
A
Proline-Rich Motif Downstream of the Receptor Binding Domain Modulates
Conformation and Fusogenicity of Murine Retroviral Envelopes
受體結合域下游富含脯氨酸的基序調節鼠逆轉錄病毒包膜的構象和融合性
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC110509/
https://journals.asm.org/doi/10.1128/JVI.72.12.9955-9965.1998
也就是說,“PRRAR”比單純的“RRAR”組合更有利於提升新冠病毒的感染效率。(這樣的組合是隨機、偶然出現的,還是精心設計的結果?)
事實上,單純的“RRAR”已經是非常優異的furin酶切組合了。華中科技大學2020年10月的Cell-iScience論文(簡記為論文-B):
Furin A Potential Therapeutic Target for COVID-19(Furin,COVID-19的潛在治療靶點)
https://www.cell.com/iscience/fulltext/S2589-0042(20)30834-8
中的一項對比實驗表明,“RARR”的水解、裂解效率是“RVRR”的2倍。“RVRR”是H7N1高致病性禽流感病毒一個土耳其毒株的furin酶切組合。
我多次強調過,新冠病毒是廣為借鑑,集多種冠狀病毒,多種非冠狀病毒致病結構、致病能力於一身的跨科屬病毒集大成者。從“PRRAR”這五個氨基酸上,我們對新冠病毒這一史無前例的特徵可略窺一斑。
論文-A的研究、實驗對象是鼠白血病病毒(MLV,Murine
Leukemia
Virus,一種逆轉錄病毒科,γ逆轉錄病毒屬病毒;著名的艾滋病病毒HIV是逆轉錄病毒科慢病毒屬病毒),“PRRAR”中的P-脯氨酸的使用可視為對鼠白血病病毒MLV結構特點的借鑑;
“RRAR”呢?它借鑑自毒性極強的小鼠肝炎病毒MHV-JHM株系、MHV-3株系,以及致死率極高的貓傳染性腹膜炎病毒FIPV某些株系S1/S2處的“RRARR”酶切組合(這一複合furin
酶切組合包含兩個基本 furin酶切組合“RRAR”和“RARR”)。
也就是說,僅S蛋白S1/S2處的“PRRAR”這五個氨基酸便存在兩處借鑑跡象:
一是借鑑了幾種特殊冠狀病毒S1/S2處的“RRAR”furin酶切組合,使新冠病毒的S蛋白可被furin蛋白酶高效率地水解切割為分離的S1亞基、S2亞基。受體結合後S蛋白的水解切割是膜融合的先決條件;
二是借鑑了非冠狀病毒--逆轉錄病毒MLV的相關結構特點,使用脯氨酸P來調節構象,降低膜融合的能量門檻,使病毒包膜與細胞膜更容易融合。
我們需要更明確地回答如下問題:新冠病毒S1/S2處的“RRAR”或“PRRAR”,是自然產生的,還是人為設計、引入的?
有很多病毒具有furin酶切位點,有不少冠狀病毒在S1/S2處存在furin酶切位點,但是,
III、新冠病毒的近親病毒都沒有S1/S2處的furin酶切位點。具體而言:
1、與新冠同譜系、同支系(冠狀病毒β譜系B支系)的新冠近親病毒全都沒有S1/S2處的furin酶切位點;
2、與新冠同譜系(冠狀病毒β譜系)的蝙蝠冠狀病毒全都沒有S1/S2處的furin酶切位點;
3、S蛋白與新冠S蛋白相似度>40%的所有冠狀病毒全都沒有S1/S2處的furin酶切位點。
IV、新冠病毒S1/S2處的furin酶切位點不是自然演化產生的,它是人為設計、引入的;而且,新冠所使用的“RRAR”或者說“PRRAR”酶切組合是一個經過精心遴選、精心設計的性能非常優異的furin酶切組合。
由我的另一篇文章:
新冠furin酶切位點探源,病毒學界的集體捂瞞
可知,毒性(致病、致死能力)最強、對白變種實驗室小鼠致死率接近100%的小鼠肝炎病毒MHV-JHM株系(Mouse
Hepatitis Virus John Howard Mueller
strain,亦稱MHV-4),毒性次強的小鼠肝炎病毒MHV-3株系,以及一年內致死率幾乎100%的貓傳染性腹膜炎病毒FIPV(Feline
infectious peritonitis virus)的某些病毒株,這三種(類)病毒S蛋白S1/S2處都具有複合furin
酶切組合“RRARR”,其前四個氨基酸,恰恰就是新冠病毒的furin 酶切組合“RRAR”。
MHV-JHM、MHV-3都有很強的大腦和神經系統毒性(大腦和神經系統的感染、破壞能力),新冠病毒也有一定的大腦和神經系統毒性。這應該都與它們S1/S2處的“RRARR”或“RRAR”furin酶切位點有關。
新冠病毒為什麼會和某些鼠肝炎病毒、貓傳染性腹膜炎病毒具有相同的S1/S2處的“RRAR”furin酶切組合?
新冠病毒可能是這些病毒自然演化而來的嗎?由“探源-捂瞞”一文第IV、V兩部分可知,新冠病毒與它們親緣關係極遠,結構差異巨大,根本不存在進化可能;由文章第VI部分還可知,新冠的“RRAR”也幾乎不可能是新冠的“近親”病毒與MHV-JHM、MHV-3或FIPV自然重組獲得的。
因此,新冠病毒S1/S2處的“RRAR”furin酶切位點不是自然演化(自然變異或自然重組)的結果,它是借鑑某些高毒性病毒的致病結構,人為設計、引入的。
小鼠是使用最廣泛的實驗室動物,小鼠肝炎病毒是人類研究最多的動物病毒;在小鼠肝炎病毒的20多個株系中,MHV-JHM和MHV-3不僅毒性最強,而且,它們與MHV-A59是最受關注、被研究最頻繁的三大MHV株系。然而,對新冠病毒S1/S2處“RRAR”與MHV-JHM、MHV-3
S1/S2處“RRARR”之間顯而易見的重大關聯,病毒學界從未有人將之告知公眾。
在(冠狀)病毒中設計、引入furin酶切位點的研究、實驗例證
在冠狀病毒或其它病毒中設計、引入furin酶切位點,對科學家們來說,這不是一個高難度的病毒改造問題。不晚於1995年,已有人開始實施furin酶切位點的構建或改造研究,二十多年來,病毒學界做過許多相關研究、實驗,包括以下幾種情況:
1、在沒有furin酶切位點的(冠狀)病毒中插入一個或多個furin酶切位點;
2、在已有furin酶切位點的(冠狀)病毒中插入新的furin酶切位點;
3、改造(冠狀)病毒中既有furin酶切位點的furin酶切組合,對照研究不同酶切組合的水解、切割效率,促進病毒-細胞融合能力或促進細胞-細胞融合能力,以及與之相關的致病能力、致病效果等等;
自疫情發生至今,病毒學界從未有人向公眾指出如下事實:“病毒學家們二十多年來做過許多的furin酶切位點插入研究、實驗”。
病毒學界這一集體性的刻意迴避、刻意捂瞞有力地配合了對“自然來源論”的鼓吹和對“實驗室來源論”的大力污名、壓制,使數十億萬世人至今不能意識到:新冠病毒S1/S2處的“RRAR”furin酶切組合完全有可能是人為設計、插入的。
新冠病毒必定源自從事冠狀病毒功能增益改造的實驗室,它不可能源自沒有做過功能增益改造研究的武漢病毒研究所,這是溯源調查的第一個基本邏輯;
新冠疫情不是武漢病毒研究所泄漏造成的,長江南岸的武漢所實驗室假設的泄漏不可能造成如下的實際疫情狀況:新冠早期病例密集地集中於長江北岸以華南海鮮市場為中心的江漢區。這是溯源調查的第二個基本邏輯。
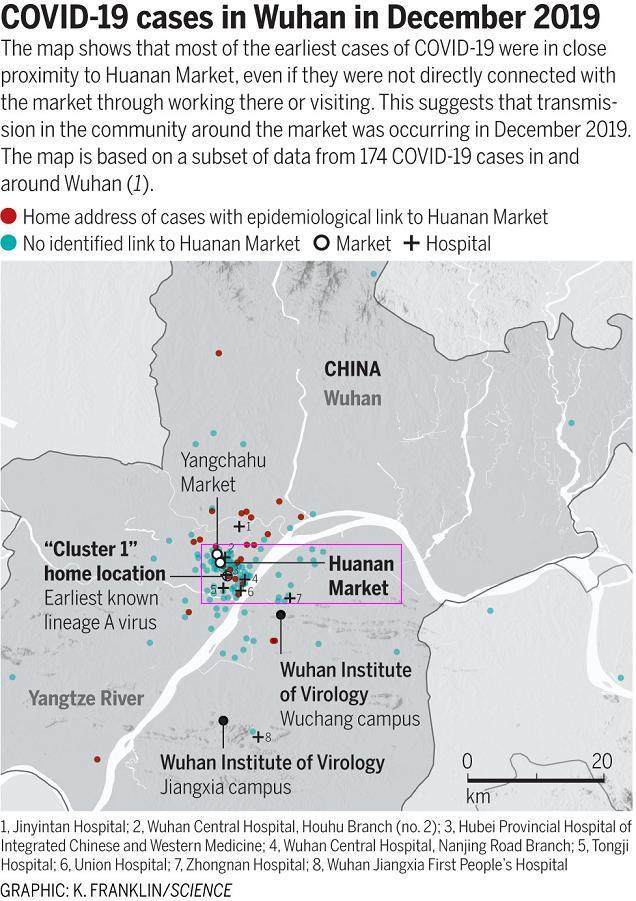
武漢新冠早期病例分布圖
武漢病毒研究所沒有泄漏新冠病毒,但新冠疫情卻偏偏“選擇”在武漢爆發,這一巧合的內在玄機非常值得我們深思。
捂蓋集團(包括開展舉國性質危險病原體功能增益改造研究的新冠病毒製造方集團,和新冠疫情製造方集團,這二大集團恰恰是秘密政治盟友。)至今仍在用“實驗室泄漏論”閹割、篡改、偷換“實驗室來源論”,用未做過功能增益改造研究,未泄漏新冠病毒的武漢本地實驗室(主要是武漢病毒研究所)來轉移視線,營造假相,隱匿新冠病毒的真正實驗室來源,掩蓋新冠大災難產生的真正原因。
本文整理出了8篇“furin酶切位點插入”研究論文,3篇出自美國科學家,4篇分別出自荷蘭、西班牙、日本、中國科學家,一篇是荷蘭、瑞士、美國科學家的聯合研究(以荷蘭科學家為主);我開始準備的6篇論文都是2009年(含)前發表的,意識到它們有點偏“老”,我後來補充納入了2014、2019年發表的論文各一篇。
我的願望是,把每篇論文的要點細節(如研究了什麼病毒,在病毒基因組的什麼位置插入或構建了什麼樣的furin酶切組合,改造前後的實驗現象、實驗效果如何等)儘可能清楚地展現在大家面前,這不可避免地使本文的總體篇幅大大拉長。身為作者,寫好每一篇文章,為您奉獻清晰、準確、全面,沒有重大遺漏的參考信息是我的責任和使命;而作為讀者,您可以選擇適當的閱讀方式,不讓篇幅成為您的閱讀負擔。您可對不同內容或精讀或跳讀,您可以只看論文標題、插圖,對每篇論文會意即可,當然,如果您有興趣和需要,您也可以深入了解、研究某一論文中的相關技術細節。即使您的閱讀到這裡為止,我相信,您的閱讀、我的寫作仍然是富有價值的。
8篇論文總體篇幅雖然很長,但反映的事實非常簡單:在(冠狀)病毒中構建furin酶切位點,不是什麼稀罕事,而是時有發生的“尋常事”。
論文一
1995年12月20日,荷蘭萊頓大學醫學院微生物學院病毒學系的四位科學家在Elsevier-Virology上發表了如下論文:
Mutational Analysis of the Murine Coronavirus Spike Protein: Effect on Cell-to-Cell Fusion
鼠冠狀病毒刺突蛋白的突變分析:對細胞間融合的影響
https://www.sciencedirect.com/science/article/pii/S0042682285700566
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7131709/pdf/main.pdf
https://coke.mml.unc.edu/highlight?paper=5feb92f2b38534fffa4575de8a13e46483fc1481&term1=CORONAPROT%23P0DTC2&term2=DRUG%23CHEMBL1536
這是一項改造冠狀病毒中既有酶切位點的研究。
論文指出:
MHV-A59(S1/S2處)的切割信號為“RRAHR”,MHV-JHM(S1/S2處)的切割信號為“RRARR”,它們的切割信號只有一個氨基酸差異(H~R)。如果將A59切割信號中的組氨酸(H)替換為精氨酸(R),那麼,得到的(切割信號與JHM相同的)A59變異體S蛋白的切割效果將顯著提高(將有更高比例的S1、S2亞基被水解切割,裂解分離)。這表明,JHM切割信號中的倒數第二個精氨酸R對其S蛋白的切割效果非常重要。
上圖是論文配圖。圖中的wt(wild-type)指未改造的MHV-A59。論文對“RRAHR”施以不同的氨基酸替換或刪除,設計了7個A59人工變異體m1~m7。變體行中出現的字母(氨基酸縮寫)表示用之替換對應位置原有的氨基酸,*表示刪除對應位置原有的氨基酸);
7個變異體中,切割信號包含基本furin酶切組合,可被furin蛋白酶水解切割的變異體有3個:m3(GRAHR)、m5(RRAQR)、m7(RRARR)。這3個變異體最右邊有+號表示可切割。
最下方的m7是用精氨酸(R)替換組氨酸(H)得到的,切割信號與JHM相同,S蛋白水解切割效果最佳的變異體。
作幾點補充說明:
1、MHV-JHM的複合furin酶切組合“RRARR”倒數第二個精氨酸R之前的四個氨基酸“RRAR”就是新冠病毒S1/S2處的furin酶切組合。
2、MHV-A59的複合furin酶切組合“RRAHR”中只含一個基本furin酶切組合“RAHR”。將其中的H替換為R後,複合furin酶切組合變為“RRARR”。原有的“RAHR”變為“RARR”,同時,另外增加了一個基本furin酶切組合“RRAR”。這可能是水解切割效果顯著提升的原因。
3、單獨的精氨酸(R)是胰蛋白酶(trypsin)的切割位點。問題是,胰蛋白酶通常只存在於哺乳動物的小腸中,因此,單獨的精氨酸發揮作用的場合極為有限。相比之下,furin蛋白酶則在脊椎動物的各種器官、組織中廣泛存在,因此,furin酶切位點處處皆有用武之地。
4、小鼠肝炎病毒(MHV,Mouse Hepatitis Virus),屬於冠狀病毒β譜系的A支系(新冠病毒屬於β譜系的B支系)。MHV病毒有超過25個株系,MHV-A59是其中毒性較強的一個株系,毒性最強的株系就是論文中的對照株系--MHV-JHM株系(即MHV-4)。
MHV-JHM有很強的大腦、神經毒性,其感染引發的強烈腦炎能使小鼠高比例癱瘓、死亡;
MHV-A59也有一定大腦、神經毒性,但比MHV-JHM要弱得多。這一差異的主要決定因素應該就是它們S1/S2處furin酶切組合的不同。
5、MHV-JHM S1/S2處的複合furin酶切組合“RRARR”包含新冠病毒S1/S2處的furin酶切組合“RRAR”。新冠病毒的大腦、神經系統感染、侵害能力很可能與“RRAR”有關。
論文二
2005年1月8日,北卡羅來納州立大學分子與結構生物化學系教授Dennis T. Brown領導的一個四人研究小組在Elsevier-Virology期刊上發表了如下論文:
In
vivo processing and isolation of furin protease-sensitive alphavirus
glycoproteins: a new technique for producing mutations in virus assembly
弗林蛋白酶敏感的甲病毒糖蛋白的體內加工和分離:一種在病毒組裝中產生突變的新技術
https://www.sciencedirect.com/science/article/pii/S0042682204008451
這是一項在非冠狀病毒中引入furin酶切位點的研究,論文的研究、改造對象是辛德畢斯病毒。
辛德畢斯病毒(Sindbis
virus)是披膜病毒科(Togaviridae)甲病毒屬(Alphavirus)的一種典型病毒,可感染齧齒動物、鳥類、家禽、家畜、人類等脊椎動物的神經元,誘發人類腦脊髓炎、腦膜炎、腦炎,並引發其它症狀。辛德畢斯病毒的主要傳播媒介是蚊子。
辛德畢斯病毒有三種結構蛋白:C蛋白(capsid protein,核衣殼蛋白),兩種包膜蛋白(envelope protein)E1、E2。C蛋白包裹保護病毒RNA;E2蛋白負責受體識別,E1蛋白促成膜融合或(細胞)膜穿孔,以向靶細胞釋放RNA;同時,E1、E2共同構成病毒包膜。成熟完整的辛德畢斯病毒三種結構蛋白皆為240 個拷貝。
Sindbis 病毒長啥樣?看圖:
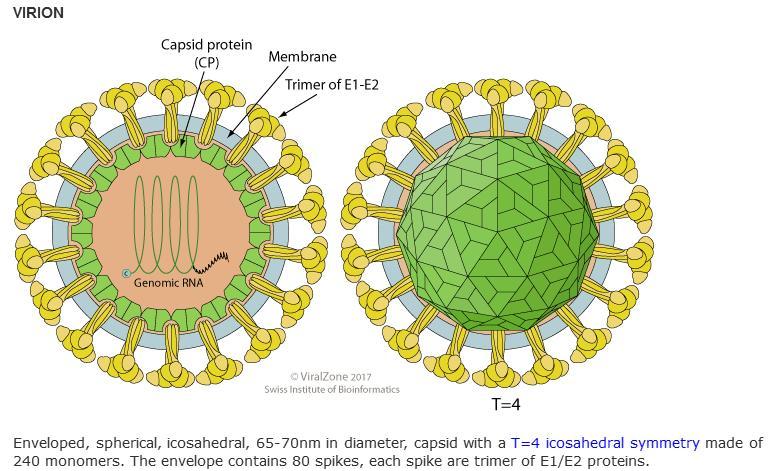
甲病毒屬病毒(Alphavirus)結構、外觀示意圖
https://viralzone.expasy.org/625
這個圖和冠狀病毒有點像。再看個圖(樣子有點噁心):
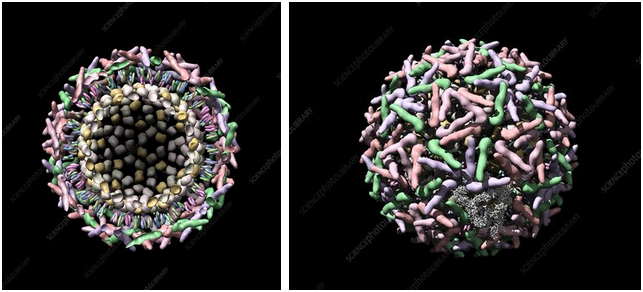
sindbis病毒透視和外觀圖
https://www.sciencephoto.com/media/249062/view/sindbis-virus-computer-model
回歸論文。
該研究在辛德畢斯病毒E1蛋白(促成膜融合或膜穿孔以釋放RNA的包膜蛋白)結構域編碼區的五個不同位置(E1 aa 130、133、139、392、393)分別插入furin酶切位點,構建了五個辛德畢斯病毒的突變體(人工改造體)。
前三個插入位置(130、133、139)位於E1蛋白功能域、結構域邊界附近,被設計用於切割E1蛋白功能域,它們對應的三個突變體統稱為功能域突變體;
後二個插入位置(392、393)位於病毒包膜外表附近,被設計用於切割E1蛋白胞外域(E1蛋白在包膜外的突出部分),它們對應的突變體稱為胞外域突變體。
aa即amino acid(氨基酸),E1 aa 130代表E1蛋白aa序列的第130個氨基酸。參見下圖:
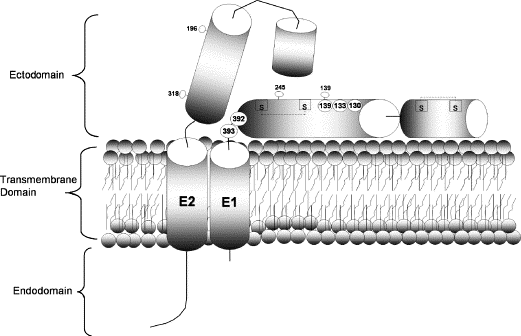
Sindbis 病毒 E1、E2 膜糖蛋白示意圖及furin酶切位點插入位置
圖中,
棒棒糖形狀代表共同締合、構成病毒包膜的E1、E2蛋白,各240個,每三對E1、E2構成一個E1、E2三聚體,病毒包膜由80個E1、E2三聚體締合而成;
標有S 的空心方塊代表對締合病毒包膜、穩定其構象極為重要的二硫鍵。
標有數字的空心圓圈代表E1蛋白內工程化弗林蛋白酶切位點的插入位置,五個空心圓圈都在E1蛋白結構域內,130空心圓圈右邊是預計將被切割掉的E1蛋白功能域,392、393圓圈大致位於E1蛋白結構域與E1蛋白胞外域的交界處。
五個位置引入的furin酶切位點的氨基酸組合包括兩種模式:RXRR或RXLR。R代表精氨酸,L代表亮氨酸,X代表相應位置處某個既有的氨基酸。furin酶切位點的引入遵循“儘可能少改動既有氨基酸,儘可能利用序列中既有的氨基酸”的原則,在每一位點處,基於這一原則選擇RXRR、RXLR 其中之一。
實驗證明,在furin蛋白酶陽性(存在正常的furin蛋白酶)的BHK-21細胞(BHK細胞,Baby Hamster Syrian Kidney cell,敘利亞幼倉鼠腎細胞)培養液中:
1、在病毒複製過程中,在暴露的E1蛋白結構域中插入的furin酶切位點可導致部分E1蛋白功能域、胞外域在病毒組裝前被furin蛋白酶水解切割掉;
2、被切割、截短的E1蛋白仍可被複製過程用於病毒包膜的組裝,這使得複製過程組裝出了結構不完整的病毒包膜;
3、包膜中不完整的E1蛋白可能不具備促成膜融合或膜穿孔的能力,由一定數量不完整E1蛋白組裝出的病毒將失去感染能力。包含furin酶切位點的五個變異體複製產生感染性病毒的能力均大幅降低。相比未改造的野生型病毒,五個變異體在BHK-21 細胞培養液中感染性病毒的複製滴度都至少降低了三個數量級(野生型病毒複製滴度為6.50 × 109pfu/ml,而五個變異體的複製滴度都小於6.00 × 106pfu/ml);
(這表明,furin酶切位點並非總是對病毒有利,過早發生的水解切割會破壞病毒的複製、組裝。)

pfu:plaque forming unit,空斑形成單位;病毒形成的空斑數代表活性病毒粒子的相對數量;單位體積(ml)病毒形成的空斑數代表活性病毒粒子的相對濃度。
4、furin酶切位點引入位置恰好位於功能域、結構域交界處的130突變體的切割效率最高(129氨基酸是功能域的最後一個氨基酸,130氨基酸是結構域的第一個氨基酸),造成的感染性病毒的降低最顯著(產生的非感染性病毒的數量也最多),它的感染性病毒複製滴度相比野生病毒降低了五個數量級。見Table 1。
5、另一組實驗表明,在furin蛋白酶陰性(furin蛋白酶天生缺乏或被抑制)的CHO RPE.40 細胞(CHO細胞,Chinese hamster ovary cell,源自中國倉鼠卵巢的上皮細胞系)培養液中,五個突變體的生長複製情況,,產生的感染性病毒的滴度情況都與野生型病毒大致相同,沒有出現在BHK-21細胞中觀察到的前述現象。仍見Table 1。
論文的通訊作者,北卡羅來納州立大學分子與結構生物化學系教授Dennis T. Brown是Arbovax 公司的創始人之一,他曾就論文中的相關技術在各國申請了如下專利:
Insertion of furin protease cleavage sites in membrane proteins and uses thereof
在膜蛋白中插入弗林蛋白酶切割位點及其用途
https://patents.google.com/patent/AU2004238843B2/en
https://patents.google.com/patent/US7521209B2/en?inventor=Dennis+T.+Brown
https://patents.google.com/patent/CN1809643A/zh
論文三
2006 年3月7日,Montana大學生物科技中心的Jack Nunberg領導的一個三人小組在Elsevier-Virology期刊上發表了如下論文:
Furin cleavage of the SARS coronavirus spike glycoprotein enhances cell–cell fusion but does not affect virion entry
SARS病毒刺突(糖)蛋白的弗林切割增強了細胞-細胞融合,但不影響病毒進入
https://www.sciencedirect.com/science/article/pii/S0042682206000900
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7111780/
該研究對SARS病毒(SARS-CoV)Spike蛋白(S蛋白,刺突蛋白)S1/S2位點附近的氨基酸序列進行了有關改造,構建了三個帶有furin酶切位點的S蛋白人工變異體,見下圖。

SARS-CoV(wild-type)及其三個人工變異體在S1/S2附近的氨基酸序列對照圖
最上方(wild-type)一行是未改造的SARS病毒S蛋白氨基酸序列。
標有數字667的黑色菱形方塊指示的R667(S蛋白的第667氨基酸R,R代表精氨酸)是SARS S蛋白S1亞基的最後一個氨基酸(殘基);
另一個黑色菱形方塊指示的K672(S蛋白的第672氨基酸K,K代表賴氨酸)是改造區域的右邊界,它是S2亞基的第5個氨基酸。
三個S蛋白變異體分別命名為HTR、HTVR、SLLR。
HTR是將HT與R之間的五個氨基酸VSLLR替換為RRSRR得到的;
HTVR是將HTV與R之間的四個氨基酸SLLR替換為RRSRR得到的;
SLLR是將SLLR之後的STSQK替換為RSRR得到的。
在三個變異體中都構建出了複合furin酶切組合“RRSRR”(在上圖中用下劃線標出),它包含兩個基本furin酶切組合“RRSR”和“RSRR”;
“RRSRR”在三個變異體中的起始、終止位置不同,因而它們的furin蛋白酶水解切割位點有所不同(furin蛋白酶的切割位置是RXXR的最後一個R)。HTR的切割位點應是R666和R667,HTVR的切割位點是R667(S1亞基的最後一個氨基酸)和R668(S2亞基的第一個氨基酸),SLLR的切割位點則應是R670和R671。
註:RRSRR借鑑自一種牛冠狀病Mebus毒株S1/S2處的furin酶切組合,牛冠狀病毒屬於β譜系A支系,SARS和新冠病毒屬於β譜系B支系。
主要實驗結論如下:
1、S1/S2處的R667(S1亞基的最後一個氨基酸)是S蛋白的一個重要氨基酸,將它替換為絲氨酸S將使S蛋白促進細胞-細胞融合的能力下降40%,預測R667可能是一個易受蛋白酶水解裂解影響的位點;
2、HTVR的水解裂解效果最顯著,HTR的水解裂解不如HTVR那麼明顯,SLLR的水解裂解非常微弱;
3、在表達HTVR-S蛋白的COS-7細胞培養物,和表達HTR-S蛋白的COS-7細胞培養物中,很容易分離到水解切割脫落下來的S1亞基,表達SLLR-S蛋白的COS-7細胞培養物中也能分離出少量脫落的S1亞基,而表達wild-type SARS S蛋白(未經改造)的COS-7細胞培養物中則不能分離出獨立存在的S1亞基;
註:COS-7細胞是含有SV40病毒基因組的非洲綠猴腎成纖維細胞,SV40病毒即猿猴空泡病毒40。表達S蛋白的COS-7細胞是將S蛋白基因添加入(轉染)COS-7細胞DNA得到的。
4、三種變異體S蛋白的(ACE2)受體結合能力與野生型S蛋白不存在明顯差異;
5、在表達S蛋白(野生型或變異體S蛋白)的COS-7細胞與表達人類ACE2的COS-7細胞的混合培養物中,HTVR-S蛋白和HTR-S蛋白表現出更強的促進細胞-細胞融合,形成合胞體的能力(合胞體是細胞-細胞融合產生的多核擴大細胞)。HTVR-S蛋白誘發產生的合胞體數量比野生型S蛋白多3到8倍;HTR-S蛋白誘發產生的合胞體數量是野生型S蛋白的1.8倍;相比之下,SLLR-S蛋白的促進融合能力反而比野生型S蛋白要弱;
6、用HTVR-S蛋白、野生型S蛋白分別與去毒性HIV-1病毒嵌合製成假病毒,用兩種假病毒感染293T細胞(插入SV40病毒 T-抗原基因的人胚腎細胞株293 ),未發現它們感染能力的明顯差異,攜帶HTVR-S蛋白的假病毒感染能力僅僅略強於攜帶野生型S蛋白的假病毒。
對第6點作一些補充說明。該論文未發現HTVR變異體假病毒感染能力的明顯提升,可能有兩個原因。
第一個可能的原因是,假病毒實驗有時是失真的,不能真實反映被模擬病毒的實際感染能力;
第二個可能的原因是,HTVR-S蛋白的水解切割可能發生得過早(比如可能有大量S1亞基尚未完成受體結合就被切割掉了)。
荷蘭烏得勒支大學(Utrecht University)2008年6月的一篇Journal of Virology 論文對第二個可能原因專門作出過說明:
Cathepsin L Functionally Cleaves the Severe Acute Respiratory Syndrome Coronavirus Class I Fusion Protein Upstream of Rather than Adjacent to the Fusion Peptide
組織蛋白酶 L 對SARS病毒的功能性切割(發生在)I 類融合蛋白上游而不是與融合肽相鄰(的部位)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2519682/
https://journals.asm.org/doi/10.1128/JVI.00415-08
論文尾部對某些研究未能提升病毒感染能力給出的解釋是:
...Such a scenario might explain the results of earlier attempts to enhance (pseudo)virion infectivity by exogenous spike cleavage or by engineering a furin cleavage site in the S protein, which may have failed due to premature loss of S1 (8, 12).
。。。這種情況可以解釋早期嘗試通過外源刺突切割(添加外源性胰蛋白酶從R667處對S蛋白水解切割)或通過在 S 蛋白中設計furin切割位點來增強(偽)病毒粒子感染性,這(些嘗試)可能由於 S1(亞基)的過早丟失而失敗 (8, 12)。
上述解釋內容針對兩篇相關論文 (8, 12),其中的論文8,就是本文當前正在介紹的論文三。
論文四
2008年4月2日,西班牙卡洛斯三世健康研究所國家微生物學和CIBER 呼吸系統疾病中心的José A. Melero等三位科學家在Journal of Virology(病毒學雜誌)在線發表了如下論文:
Insertion
of the Two Cleavage Sites of the Respiratory Syncytial Virus Fusion
Protein in Sendai Virus Fusion Protein Leads to Enhanced Cell-Cell
Fusion and a Decreased Dependency on the HN Attachment Protein for
Activity
在仙台病毒融合蛋白中插入呼吸道合胞病毒融合蛋白的兩個(furin)切割位點可增強細胞-細胞融合併降低對 HN 附着蛋白活性的依賴性
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2395136/
https://journals.asm.org/doi/full/10.1128/JVI.00078-08
論文的研究對象是兩種病毒:仙台病毒和(人或牛)呼吸道合胞病毒。這兩種病毒同屬副黏液病毒科(Paramyxoviridae,也稱為副黏病毒科)但分屬不同亞科,仙台病毒(Sendai Virus,縮寫為SeV)屬於副黏液病毒亞科(Paramyxivirinae),人呼吸道合胞病毒(Respiratory Syncytial Virus,RSV)屬於肺炎病毒亞科(Pneumovirinae)。
仙台病毒(SeV)也稱為鼠呼吸道病毒(Murine Respirovirus)、鼠副流感病毒1型或日本血凝病毒 (HVJ,Hemagglutinating virus of Japan),它通常感染齧齒動物;它也有人類、家畜感染能力但沒有致病性(有人類、家畜細胞進入能力,但不會造成臨床疾病症狀)。
呼吸道合胞病毒(RSV)的致病能力比仙台病毒(SeV)強得多,它能引發人類、家畜不同程度的肺部、呼吸道感染及其它症狀。
人呼吸道合胞病毒在成人和大齡兒童中通常引起感冒樣症狀;它有時可引發感染性肺炎、細支氣管炎、入肺小氣道通道發炎;它還可能導致早產兒、患有慢性心臟或肺部疾病的嬰兒和成人、及免疫能力低下者發生重度感染甚至危及生命。
有一種牛呼吸道合胞病毒致病能力更強,它能使成年牛死亡或流產。
仙台病毒(SeV)、呼吸道合胞病毒(RSV),這倆病毒長啥樣呢?
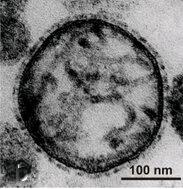
電子顯微鏡下的仙台病毒外觀
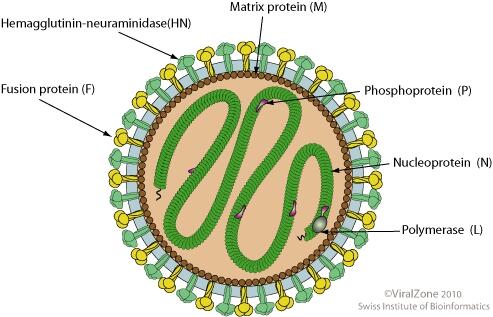
仙台病毒結構示意圖
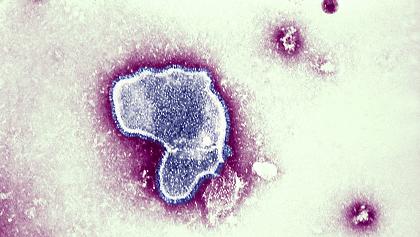
電子顯微鏡下的呼吸道合胞病毒(RSV)
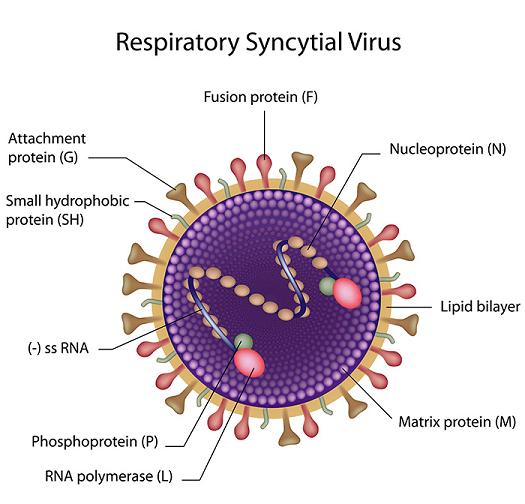
呼吸道合胞病毒結構示意圖
副粘病毒進入細胞需要病毒包膜與靶細胞膜融合(與新冠的感染方式類似),融合是由病毒F糖蛋白(fusion蛋白,融合蛋白)介導的,通常還需要某個(負責受體結合的)附着糖蛋白(G、H 或 HN,取決於具體病毒)的共同參與。比如,仙台病毒(SeV)病毒包膜與細胞膜的融合過程必須絕對依賴其附着蛋白--HN蛋白(Hemagglutinin-neuraminidase ,血凝素-神經胺酸酶)與F蛋白的共同參與(並且還需要細胞環境中存在胰蛋白酶);呼吸道合胞病毒(FSV)是副粘病毒中一個獨有的特例,它的F蛋白可以不依賴其附着蛋白—G蛋白獨立介導病毒包膜與靶細胞膜的膜融合(SeV的附着蛋白是HN蛋白,而FSV的附着蛋白是G蛋白) 。
呼吸道合胞病毒(FSV)的獨特能力源自它F蛋白的獨特結構:它的F蛋白有兩個furin酶切位點。而大多數副粘病毒的F蛋白則沒有furin酶切位點,包括仙台病毒(SeV),它的F蛋白只有一個單鹼基酶切位點(精氨酸R116,胰蛋白酶切位點)。
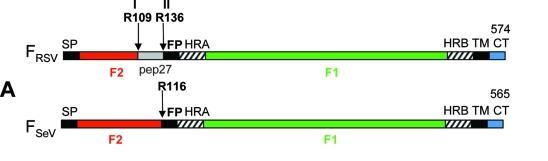
RSV、SeV F蛋白結構對照圖
如上圖所示,F_RSV(RSV的F蛋白)在R109(F蛋白的第109氨基酸,精氨基酸R)處和R136處各有一個furin酶切位點;F_SeV(RSV的F蛋白)沒有furin酶切位點,它在R116處有一個單鹼基胰蛋白酶切位點(單一精氨酸R116)。
F_RSV R109處、R136處的furin酶切組合分別為RARR、RKRR,見下圖:

F_RSV R109、R136處的兩個furin酶切位點
為研究F_RSV的兩個furin酶切位點在病毒感染和膜融合中的作用,論文參照F_RSV結構,構建了6個F_SeV(SeV的F蛋白)的變異體,其中兩個變異體中各包含一個furin酶切位點,另外四個各包含兩個furin酶切位點,見下圖:
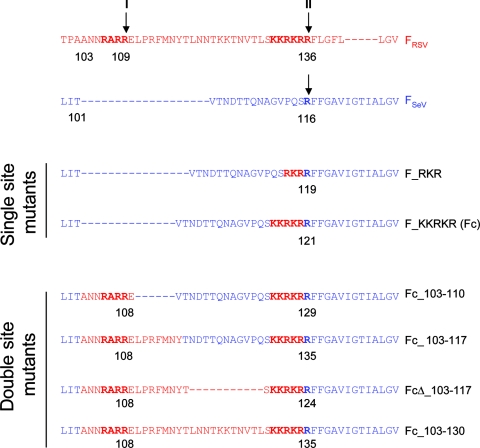
F_SeV的六個furin酶切位點變異體
如上圖,兩個F_SeV的單furin酶切位點突變體分別插入了F_RSV R109、R136處的furin酶切組合;
四個F_SeV的雙furin酶切位點突變體同時插入了F_RSV R109、R136處的furin酶切組合,但它們第二個furin酶切組合的具體插入位置不同,兩個furin酶切組合之間的氨基酸序列也不相同;
圖中所有藍色氨基酸都來自F_SeV,所有紅色氨基酸都來自F_RSV;
雙位點突變體名稱中的Fc代表fusion (protein)cleavage(mutants),“Δ”表示突變體刪除了FSeV中原有的若干氨基酸;
雙位點突變體第二個位點的插入都是KKRKR;它們在第一個位點插入了不同長度的F_RSV氨基酸序列片斷,比如,Fc_103-110插入了序號介於第103-110之間的8個F_RSV氨基酸“ANNRARRE”。
最後一個突變體Fc_103-130包含完整的F_RSV的pep27序列,pep27序列指F_RSV的兩個切割位點之間的27個氨基酸(殘基)(E110~R136)。RSV需要furin蛋白酶水解切割掉兩個furin酶切位點之間的pep27區域以激活F蛋白的病毒-細胞膜融合能力及細胞-細胞膜融合能力。
實驗證明:
1、只有當SeV的附着蛋白HN和外源性胰蛋白酶同時存在時,F_SeV才能促成細胞-細胞融合形成合胞體;
當不存在(RSV的)附着蛋白G,且沒有胰蛋白酶時,F_RSV 仍然能有效促成細胞-細胞融合形成合胞體;不過,附着蛋白G和胰蛋白酶的存在能更顯著地增進FRSV 的細胞-細胞融合能力並形成更大的合胞體。見下圖:
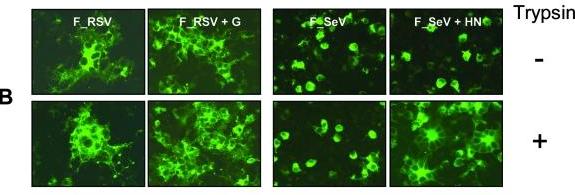
F_RSV、F_SeV細胞-細胞融合能力對附着蛋白和Trysin的依賴情況
2、兩個F_SeV單furin酶切位點突變體的細胞-細胞融合能力仍然依賴附着蛋白HN的存在。其中,F_RKR的細胞-細胞融合能力還同時依賴胰蛋白酶,而F_KKRKR(Fc)的細胞-細胞融合能力則不必依賴胰蛋白酶。見下圖:
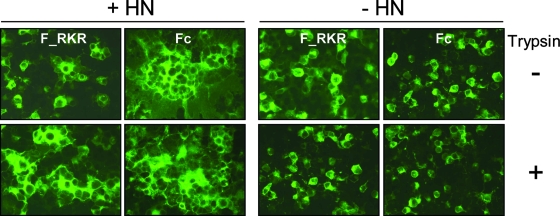
F_SeV單furin酶切位點突變體細胞-細胞融合能力對HN和Trysin的依賴情況
如上圖所示,在沒有HN蛋白存在時,無論細胞環境中有無胰蛋白酶,兩種單furin變異體都不能顯著促成細胞-細胞融合(右側四圖);在有HN蛋白共同存在時,F_RKR的細胞-細胞融合能力仍然依賴於胰蛋白酶的同時存在(第一列兩圖),而F_KKRKR(Fc)即使在沒有胰蛋白酶存在時,也能促成產生很大的多核合胞體(圖中的黑點對應細胞核),它的這一能力會因胰蛋白酶的存在而進一步加強(第二列兩圖)。
3、所有F_SeV雙furin酶切位點突變體都具有非常強的細胞-細胞融合能力。
3-A) 當有HN蛋白共同存在時,所有F_SeV雙furin突變體的細胞-細胞融合能力均不依賴於胰蛋白酶,不論有無胰蛋白酶存在,它們都能形成了極大的合胞體,見下圖:
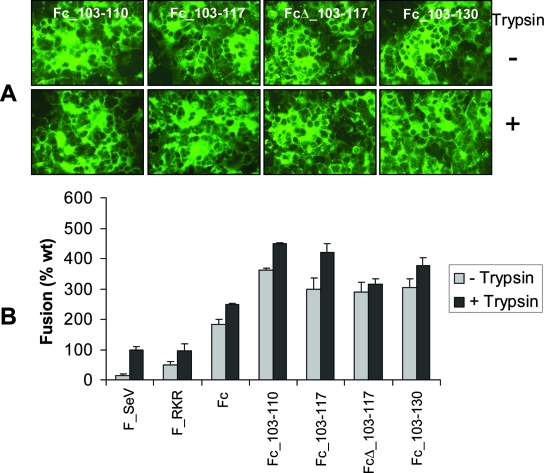
HN蛋白存在時的細胞-細胞融合實驗結果
圖A是四種雙furin突變體的細胞-細胞融合促成情況;圖B是未改造的F_SeV(wt:wild type)及六種突變體的細胞-細胞融合能力對比情況,以F_SeV(wt)在有HN和Trypsin存在時的融合能力為100% 對照基準。A、B兩圖的實驗均有HN蛋白存在;
3-B)F_SeV雙furin酶切位點突變體對HN蛋白的依賴顯著降低,即使HN蛋白及胰蛋白酶都不存在時,雙furin突變體也具有不同程度的的細胞-細胞融合能力,除FcΔ_13-117外,其它三種雙furin突變體都能形成很大的合胞體,見下圖:
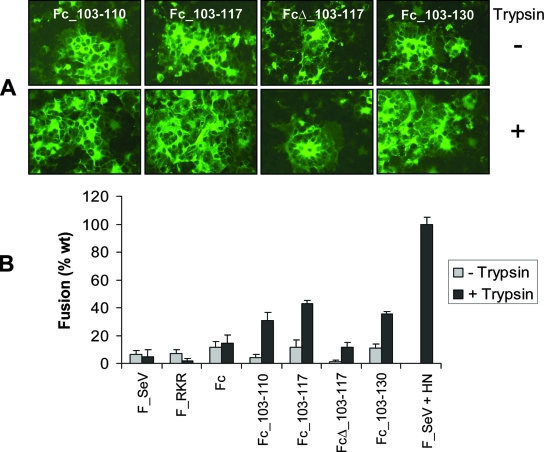
HN蛋白不存在時的細胞-細胞融合實驗結果
限於篇幅,餘下四篇論文將另文貼出。
(未完待續)


























