新冠病毒的来源真相是捂不住的,它不会成为长期悬案。信息控制、舆论操纵终将因破绽百出而决堤、崩溃,谎言、假相终将败露,不作为、假作为,装聋、扮瞎、作哑、演戏,身披皇帝新装掩耳盗铃、欲盖弥彰,欺瞒、愚弄世人者终将在众目睽睽下现出原形,真相和众多铁证人尽皆知之日不会被推迟太久。
接续:“万能”受体适配器--新冠S蛋白 4
笔者坚信,自己的系列溯源文章有难得的展示、研究、借鉴、反思、讨论、争鸣价值,不应被忽略、搁置、回避。这些文章所披露、介绍、剖析的未获宣传、不为公众所知的大量论文和研究成果,不仅关乎新冠病毒的来源真相,关乎类似的天灾/人祸会否重演,关乎某些人会不会一再错上加错,而且,一些科学发现,如SARS-CoV-2 S蛋白(Spike蛋白,刺突蛋白)致血栓性、其它血液毒性、致癌性、铁代谢毒性、神经毒性等致病能力,与我们每个人的现实健康、个人选择、自我保护和长期生活也息息相关。
如果您认为笔者的文章不可信,不值得称道,不值得推广,如果您认为笔者在撒谎、造谣、编造、哗众取宠,那么,尊敬的读者、媒体人、科技界人士,我可否肯请你们,在笔者所有溯源文章,包括当前这篇文章中指出任意三处错误,或者,指出任意一处存在杜撰、捏造嫌疑的内容?这不会是一件有难度的事情吧?
新冠病毒的来源真相、新冠疫情的发生真相对我们是否重要?对真相的渴望是否还留存在我们心中?对新冠病毒、新冠疫情的真相都无所谓的人,是否还在乎其它事实、真相?
对笔者的溯源文章,可否多给予一些展示、讨论,以及接受批驳的机会?如果您认同笔者的溯源文章专业、高质量,依据充分、逻辑严谨、内容可靠,富有价值、不可多得、意义深远,那么,可否请您给这些文章,给文章作者逆境中前行的坚持、勇气和付出多一些支持、鼓励,多一些赞誉和掌声?
笔者相信,有良知、责任感、有道义、公平公正的媒体人不会视若不见,不会冷漠对待,回避、冷处理对真知、真相的探索、发现,他们会坚决支持讲真话的文章,会积极展示、大力宣传新冠溯源的重大证据、重要线索,会热情鼓励对真知、对重大事件真相的挖掘、揭示、讨论、辩论和观点对撞。
10、Hemoglobin(血红蛋白)、Heme(血红素)、Porphyrin(卟啉)
先谈谈SARS-CoV-2中的跨物种基因。
SARS-CoV-2中的跨物种基因
一种来自动物的病毒为什么刚刚出现在人群中,就以人类为最佳感染、致病对象?一种来自动物的病毒,为什么不经适应性变异,就已具备史无前例的,令所有病毒、病原体望尘莫及的,几十种人体蛋白、多肽、酶、激素的结合、摄取、降解、改变、利用、模仿能力?一种来自动物的病毒,为什么在接触人类之初,就对人体的组织结构、生理机能了如指掌,在人体中轻车熟路、游刃有余,能够无所不至地感染、损害几乎所有的人体组织、器官(泛组织、器官感染能力),并造成涉及各个组织、器官的,五花八门、不胜枚举的后遗症?
SARS-CoV-2是在动物宿主中自然演化产生的,还是专门针对人类设计的?
SARS-CoV-2是广泛借鉴、参考,广泛模仿、引入的宏大转基因“杰作”、“巨制”,是披着冠状病毒外壳的跨物种基因集大成者。SARS-CoV-2具有大量其近亲病毒无一具有,甚至大量其它冠状病毒无一具有的基因、蛋白结构,这是一些跨物种基因(基因、蛋白结构),它们使SARS-CoV-2将各种来源的感染、致病、免疫对抗能力汇集于一身。SARS-CoV-2中的跨物种基因,不仅来自各科属病毒,而且来自非病毒微生物、动物和植物;SARS-CoV-2中的跨物种基因,不仅来自非近亲冠状病毒、各科属非冠状病毒,不仅来自致病细菌、寄生虫、动物、人类和植物,而且来自细菌毒素、动物毒素、医疗药剂。或者说,SARS-CoV-2具有大量非近亲病毒、非冠状病毒来源的跨物种基因、蛋白结构,这些跨物种基因、蛋白结构,分别在各科属病毒、致病细菌、寄生虫、动物、人类、植物、细菌毒素、动物毒素、医疗药剂中存在相同或高度相似的结构来源。
产生一种近亲和同科病毒皆不具备的基因、蛋白结构,对自然变异、自然重组来说是极低概率事件。在同一种病毒中居然汇集了如此之多的极其反常的基因、蛋白结构,一种病毒不仅含有大量极其反常的基因、蛋白结构,而且这些基因、蛋白结构居然与众多非冠状病毒,与众多细菌,与寄生虫、动物、人类、植物,与细菌毒素、动物毒素、医疗药剂都存在结构巧合,它们会是自然突变、自然重组的结果吗?不会,它们一定出自人为的设计、引入、集成。
笔者之前多次指出过SARS-CoV-2中的跨物种基因、蛋白结构(包括抗原结构),一部分此类结构的论文依据也已在以下文章
谁设计、制造了新冠病毒(四)匪夷所思
及其它文章中给出,现在,我们作一个更全面的小结。
SARS-CoV-2含有大量非冠状病毒的各科属病毒来源的基因、蛋白、抗原结构。
SARS-CoV-2中不仅汇集了许多非近亲冠状病毒的基因、蛋白结构,而且,它还含有大量在其它冠状病毒中未发现过,但与别的科属病毒(包括RNA病毒、DNA病毒,包括动物病毒和植物病毒)相同或相似的基因、蛋白结构,例如:
SARS-CoV-2与HIV(艾滋病病毒,逆转录科慢病毒属)有着惊人的关联和相似性:
SARS-CoV-2 S蛋白含有四个与HIV gp120蛋白(包膜蛋白)、Gag蛋白(衣壳结构蛋白)相同或相似,与免疫破坏能力有关的短基因片断,二种病毒都能够以相应蛋白结合CD4受体,感染、破坏CD4+T淋巴细胞;
SARS-CoV-2 S蛋白还含有其它HIV基因片断。S蛋白S1亚基含有一段Gag_p17 基序,S2亚基含有两段Gag_p17基序、三段Gag_p24基序,Gag_p17、Gag_p24是HIV Gag基因/GAG蛋白中的结构域;
SARS-CoV-2 S蛋白、HIV gp120蛋白都含有蛇神经毒素样区域(snake-toxin like region),都具备神经元受体结合能力,都具有多重神经系统损害机制;
两种病毒都具有furin酶切位点和高效的直接膜融合感染能力;
两种病毒都具有O-Link聚糖结构和相应的免疫屏蔽、免疫逃避能力;
两种病毒都能够通过结合CD4和CD147/Basigin(BSG,基础免疫球蛋白)等受体感染、破坏T(淋巴)细胞、巨噬细胞、单核细胞等免疫细胞,二者还共有多种其它感染受体或细胞附着因子,如CD169(Siglec-1)、CD209(DC-SIGN)等等;
两种病毒都能够结合血红素的核心构件卟啉并引起卟啉症(卟啉代谢紊乱);SARS-CoV-2 能够感染红细胞和红细胞祖细胞,HIV能够感染骨髓造血细胞,二者都具有血细胞和血液系统损害能力和铁代谢干预能力;
SARS-CoV-2 S蛋白含有一个能够与红细胞膜上的补体受体1(complement receptor 1)结合的C1q结构域,而HIV的感染机制也与细胞补体组件C1q(Complement Component C1q) 有关;
二种病毒可能都具有不通过受体结合,直接穿透细胞膜的能力;
SARS-CoV-2具有类似艾滋病病毒(但尚不健全)的逆转录自身RNA(片断)为cDNA(RNA的互补DNA),并将cDNA整合入人体被感染细胞DNA的能力/特性;
等等;
多种艾滋病传统药物已被用于治疗COVID-19;SARS-CoV-2的“小艾滋”之称名副其实;
SARS-CoV-2 S蛋白含有来自登革热病毒(Dengue Viruse,黄病毒科黄病毒属)的抗原结构,计算机分析表明,SARS-CoV-2 S蛋白S2亚基HR2(Heptad Repeat 2,七肽重复序列2)结构域与登革热病毒包膜蛋白可能存在相似的抗原位点;二者都具有VSR (viral suppressor of RNA interference,RNAi的病毒抑制)免疫抑制机制;二者有多种相同的感染受体,如波形蛋白(Vimentin,VIM)、肾损伤分子-1(Kidney injury molecule-1,KIM-1)、FcR类蛋白等,其中FcR(fragment crystallizable region,可结晶片断区域)类蛋白是登革热病毒等黄病毒科病毒的典型感染受体,黄病毒科病毒使用FcR类蛋白感染细胞的机制被称为抗体依赖性增强感染。FcR类蛋白子类FcγR中的CD16、CD64是SARS-CoV-2感染单核细胞和巨噬细胞等免疫细胞的受体。
SARS-CoV-2 S蛋白含有来自甲型流感病毒(Influenza A virus ,IAV,正黏液病毒科)的一些抗原结构,二者也都具有VSR免疫抑制机制,二者有多种相同的感染受体,如β-连环蛋白(β-Catenin,β-CAT)、KIM-1等;
SARS-CoV-2 S蛋白和狂犬病病毒(Rabies Virus,RABV,弹状病毒科)糖蛋白G都含有结合nAChR(nicotinic acetylcholine receptor,烟碱型乙酰胆碱受体,一种神经元受体)的蛇神经毒素样区域。在狂犬病病毒约五种感染受体中,和SARS-CoV-2共同的感染受体/内化因子就有三种:TfR1(transferrin receptor 1,转铁蛋白受体1)、nAChR、mGluR2(metabotropic glutamate receptor subtype 2,代谢型谷氨酸受体亚型2),nAChR、mGluR2都是神经元受体,SARS-CoV-2和RABV都有神经毒性;
SARS-CoV-2 S蛋白含有来自丙型肝炎病毒(hepatitis C virus ,HCV,黄病毒科肝炎病毒属)capsid protein(衣壳蛋白)的两段结构域基序HCV_capsid A、HCV_capsid B;二者都具有furin酶切位点;二者都具有O-Linked聚糖结构及免疫屏蔽机制;二者有多种相同的感染受体,如HS/HSPG(heparan sulfate/heparan sulfate proteoglycans,硫酸乙酰肝素/硫酸乙酰肝素蛋白聚糖)、TfR1 、ASGR1/CLEC4H1(asialoglycoprotein receptor 1,去唾液酸糖蛋白受体1,肝脏特有的糖蛋白,乙肝、丙肝病毒的共同感染受体)、Basigin/CD147 (BSG,基础免疫球蛋白)等;二者都能感染肝细胞、造成肝损伤;二者都能感染巨噬细胞、单核细胞等免疫细胞;二者都能干预铁代谢并造成铁代谢失调、紊乱;二者都能作用于血红素的核心构件卟啉(porphyrin)并引发卟啉症(卟啉代谢紊乱);
SARS-CoV-2 S蛋白含有乙型肝炎病毒(hepatitis B virus,SARS-CoV-2,嗜肝DNA病毒科)core protein(核心蛋白,即HBcAg)的锌结合结构域(zinc-binding domain)--Hep core N,锌结合功能可能用于对抗、反制宿主对病毒转录的抑制,各种哺乳动物嗜肝DNA病毒(如土拨鼠肝炎病毒)都具有锌结合基序/锌结合结构域;SARS-CoV-2与HBV有共同的感染受体Basigin/CD147、ASGR1/CLEC4H1(asialoglycoprotein receptor 1,去唾液酸糖蛋白受体1);二者都能感染肝细胞、造成肝损伤;二者都可能二者都能干预铁代谢并造成铁代谢失调、紊乱;二者都能引发卟啉症;二者都能将自身的基因组或基因组片断整合到人类细胞DNA中;
SARS-CoV-2 S蛋白含有来自昆虫多角体病毒(杆状病毒科)中的几丁质结构域(Chitin-binding type-2),SARS-CoV-2可通过这一结构域吸附红细胞,搭乘红细胞“便车”在人体内扩散,迷惑并逃避免疫攻击;
SARS-CoV-2中跨物种基因的非冠状病毒各科属病毒来源或借鉴对象还包括或可能包括:埃博拉病毒(Ebola virus,丝状病毒科)、寨卡病毒(Zika virus)、尼帕病毒(Nipah virus,副黏液病毒科亨尼巴病毒属)、Nepovirus(神经病毒,豇豆花叶病毒科的一个病毒属)、picornaviruse(微小核糖核酸病毒,包括脊髓灰质炎病毒、甲型肝炎病毒、口蹄疫病毒、脑心肌炎病毒等等)、parvovirus(细小病毒,细小病毒中的parvovirus B19 入侵儿童骨髓中的红细胞前体细胞,导致纯红细胞再生障碍性贫血 (PRCA) 和皮疹)、Rhabdovirus(弹状病毒)、rotavirus(轮状病毒)等等。maltose-binding protein
部分跨物种基因的论文依据在本系列之前的文章以及上面刚刚提到的文章中已经给出,本文稍后的“论文依据一”也将指证多种SARS-CoV-2跨物种基因,其它论文依据还将在后续文章中陆续提供。
SARS-CoV-2中含有大量来自(致病)细菌的基因、蛋白、抗原结构。
SARS-CoV-2 S蛋白含有来自12种致病细菌的几十个抗原位点(抗原短序列),这些细菌中的部分知名细菌是:结核分枝杆菌、麻风分枝杆菌、炭疽杆菌、破伤风梭菌、幽门螺杆菌、金黄色葡萄球菌、化脓性链球菌、霍乱弧菌、鼠疫耶尔森氏菌;
SARS-CoV-2的非结构蛋白ORF3a等蛋白含有发现于淋病奈特氏菌、流感嗜血杆菌和致病性大肠杆菌中的肽酶S6结构域(Peptidase S6 domain),该结构域能够催化血红蛋白降解,释放其中的血红素;
SARS-CoV-2的S、ORF3a等蛋白含有金黄色葡萄球菌的NEAT结构域,NEAT结构域的作用是定位、结合血红蛋白,结合、摄取其中的血红素。ORF3a的NEAT结构域由紧密堆积的IsdA、IsdC 和IsdH 子域组成,这些子域的氨基酸序列来自金黄色葡萄球菌的IsdA、IsdC和IsdH蛋白,金黄色葡萄球菌的IsdA、IsdC 和IsdH/IsdB等Isd蛋白能够完成血红蛋白定位和血红素结合/捕获等活动;
SARS-CoV-2 的结构蛋白S(Spike,刺突)、N(Nucleocapsid,核衣壳)、E(Envelope,包膜)及非结构蛋白ORF3a、ORF7b、ORF10、nsp2、nsp3 和RdRP 均具有细菌和真核生物线粒体来源的Haem_bd 结构域,其中E、ORF3a的Haem_bd结构域中含有可结合血红素(Heme)和卟啉(porphyrin)的基序。Haem_bd 结构域存在于大多数细胞色素C 氧化酶(cytochrome C oxidases)中,而细胞色素C 氧化酶存在于细菌和真核生物细胞线粒体中。
ORF3a蛋白还含有存在于金黄色葡萄球菌血红素降解酶中,以及结核分枝杆菌血红素降解单加氧酶中的ABM 结构域,ORF3a蛋白同时含有存在于汉赛巴尔通体(Bartonella henselae,一种可导致猫抓病的革兰氏阴性杆菌)、小肠结肠炎耶尔森氏菌等革兰氏阴性杆菌或球杆菌中的HemS结构域。ABM 结构域和HemS结构域都具有血红素裂解/降解能力,可将血红素裂解/降解为铁和卟啉;
SARS-CoV-2 ORF3a蛋白能以不只一种方式裂解/降解血红素,其中之一与金黄色葡萄球菌非常相似,二者都能在NADPH-细胞色素P450还原酶存在的情况下,裂解血红素的四吡咯环结构,将血红素降解为卟啉和铁,并摄取所释放的亚铁离子;
稍后还将说明,SARS-CoV-2 S蛋白含有与肠毒素B高度相似的,可强烈结合T细胞受体的基序(肠毒素B是金黄色葡萄球菌的代谢、分泌物)以及与肉毒杆菌神经毒素高度相似,同样可结合T细胞受体的基序;
SARS-CoV-2 S蛋白中含有存在于哺乳动物和细菌(如一些肠道细菌)中的硫酸酯酶(sulfatase)结构域。硫酸酯酶在硫循环、溶酶体中硫酸化糖胺聚糖和糖脂的降解以及细胞外空间硫酸化糖胺聚糖的重塑中发挥重要作用(S蛋白两种结合受体硫酸乙酰肝素/HS和肝素/HP都是硫酸化的糖胺聚糖),硫酸酯酶和磺基转移酶是硫酸酯合成、分解的主要催化物。硫酸酯酶与激素依赖性癌症、溶酶体贮积症、发育异常等多种疾病的发生及细菌发病机制有关;
SARS-CoV-2 S蛋白中还含有一种多见于放线菌(包括链霉菌和分枝杆菌)铁硫蛋白(Actinomyces iron-sulfur protein)中的铁硫结合结构4Fe-4S Wbl-type,该结构因对一氧化氮 (NO) 极其敏感而具有亚硝化监测作用,可帮助病原体逃避免疫细胞或红细胞的RNS(reactive nitrogen species,活性氮类/活性氮)自由基攻击。
SARS-CoV-2含有借鉴、抄袭自寄生虫的基因、蛋白、抗原结构。
SARS-CoV-2与疟原虫的惊人关联和相似性不亚于它与HIV的关联和相似性。
SARS-CoV-2 多种蛋白含有来自恶性疟原虫(Plasmodium falciparum)、诺氏疟原虫(Plasmodium knowlesi)、三日疟原虫(Plasmodium malariae)等疟疾寄生虫的基因、蛋白、抗原结构。其中,
S蛋白中的7 氨基酸基序 (439NNLDSKV445) 与三日疟原虫保守的膜结合表面蛋白 (membrane bound-surface protein)100%相似,该基序替换了蝙蝠冠状病毒中的相应基序(该基序两侧的序列与蝙蝠冠状病毒相同);
S蛋白、ORF3a蛋白中含有富含色氨酸和苏氨酸的疟原虫抗原;
耶鲁大学Bei 教授(Amy K. Bei)领导的一个国际小组证明,急性疟疾感染产生的抗体可与SARS-CoV-2 Spike蛋白发生交叉反应,急性疟疾抗体特异性识别SARS-CoV-2 Spike蛋白S1亚基N 连接聚糖上的唾液酸部分(the sialic acid moiety on N-linked glycans)并与之相互作用;
SARS-CoV-2能利用与恶性疟原虫(Plasmodium falciparum)类似的结构感染红细胞(erythrocyte)。ORF3a 蛋白含有恶性疟原虫抗原EBA-175 结构域,能够结合红细胞膜上的Glycophorin A(血型糖蛋白A/唾液酸糖蛋白A),SARS-CoV-2 S蛋白则含有一个能结合红细胞膜上的complement receptor 1(补体受体1)的C1q结构域。S和ORF3a组成红细胞攻击复合体,二者分别与受体蛋白结合并锚定在红细胞膜骨架上,而后ORF3a 使用硫醇激活的溶细胞素结构域(thiol-activated cytolysin domain)在红细胞膜上产生溶血孔(hemolytic pores),将病毒RNA注入成熟的红细胞中;由于含有疟原虫抗原,A型和Knops血型者的血细胞可能更容易受到SARS-COV-2多种蛋白的攻击;
SARS-CoV-2的S蛋白等蛋白能结合多种红细胞(及红细胞祖细胞)表面受体,其中,CD147/Basigin、Band3/AE1(带3蛋白)、sialic acid(唾液酸)也是疟原虫感染红细胞的结合受体;SARS-CoV-2 S蛋白能够结合Acyclophilin A(亲环蛋白A),而恶性疟原虫的裂殖子表面蛋白(merozoite surface protein)能够结合Acyclophilin B(亲环蛋白B);
一组非洲科学家总结了已有的论文发现并指出,COVID-19在临床、病理(包括先天免疫和适应性免疫反应)、感染途径/受体使用、基因蛋白抗原结构上都与疟疾惊人相似;他们还指出,撒哈拉以南非洲国家由于之前流行疟疾(感染疟疾能够获得对SARS-CoV-2的有效免疫力),并广泛使用抗疟药物,因此,尽管健康、卫生状况不佳,医疗系统脆弱,但这些国家的COVID-19病例数量仍然很低;
众所周知,抗疟药物--氯喹(chloroquine,CQ) 、羟氯喹(hydroxychloroquine,HCQ)都已被用于COVID-19治疗。
SARS-CoV-2含有多处与人类相同或相似的基因、蛋白结构。
SARS-CoV-2 S蛋白S1/S2处的长furin切割序列原样抄袭、复用了人类ENaC-α(上皮钠离子通道α亚基)的长furin切割序列,二者皆为RRAR'SVAS,S蛋白以此模拟、伪装人体ENaC的水解激活;
SARS-CoV-2 S蛋白含有一段与ICAM-1子序列高度相似的基序。ICAM-1 (Intercellular Adhesion Molecule 1,细胞间粘附分子1 )也叫做CD54 (Cluster of Differentiation 54,分化簇54),是一种细胞表面跨膜糖蛋白,通常在内皮细胞和免疫系统细胞的细胞膜上表达,对于免疫和炎症反应的介导至关重要。SARS-CoV-2 S蛋白中的ICAM-1样基序与TCRVα相互作用,以进一步稳定S-TCR复合物。这一结构及其作用与后面“SARS-CoV-2含有与细菌毒素高度相似的基因结构”小节及SARS-CoV-2 S蛋白的TCR(T细胞受体)结合能力紧密相关,可能也与T细胞的过度激活、免疫风暴-过度炎症反应有关。值得注意的是,ICAM-1也在中枢神经系统(central nervous system,CNS)中表达,如在人类前脑的白质和灰质中的小胶质细胞和星形细胞以及内皮细胞中表达,它具有血脑屏障的关键功能,在精神疾病的发病机制中也具有重要作用。SARS-CoV-2 S蛋白中的ICAM-1样基序继承自SARS-CoV-1,后者S蛋白含有两段与ICAM-1子序列高度相似的基序。
SARS-CoV-2 S蛋白中结合人体NRP1(Neuropilin-1,神经纤毛蛋白-1)受体的Cendr多肽,与NRP1在人体内的天然结合配体—VEGF-A(Vascular Endothelial Growth Factor-A,血管内皮生长因子-A/血管通透因子/血管调理素,一种人体内的二聚体糖蛋白),二者在空间结构、形态,与NRP1的结合细节上都非常相似;
SARS-CoV-2 S蛋白不仅能够结合人类铁代谢的关键因子之一--铁调素(Hepcidin),而且,S蛋白尾部区域与人类铁调素存在氨基酸序列相似性,这一尾部区域可能能够模仿铁调素的分子作用和生理功能。计算机模拟研究表明,SARS-CoV-2 S蛋白的尾部片断—Covidin多肽能够模仿铁调素,结合人体唯一的细胞铁输出蛋白--铁转运蛋白(ferroportin,FPN),抑制细胞铁输出、铁释放,这是铁调素的核心生理功能之一,Covidin多肽很可能也具备铁调素的铁转运蛋白降解能力;
SARS-CoV-2 S蛋白能够模仿人体血红素加氧酶(heme oxygenase)对血红素(Heme)的氧化活性,在抗坏血酸(即维生素C)存在时,催化血红素缓慢转化/降解为胆绿素(biliverdin),这意味着,S蛋白中存在与人体血红素加氧酶相似或等效的结构;
SARS-CoV-2及其S蛋白有高度致癌性。
SARS-CoV-2的S蛋白等蛋白具有黑色素瘤结构域(melanoma domain),许多恶性肿瘤,包括肺癌,都具有包含黑色素瘤结构域的致病蛋白;
SARS-CoV-2的S蛋白等蛋白质含有来自人类p53蛋白的p53结构域,p53蛋白也被称为p53肿瘤蛋白,是导致人类肿瘤的最常见的突变基因,其突变发生频率高达50%;
SARS-CoV-2 S蛋白还含有存在于哺乳动物和细菌(如一些肠道细菌)中的硫酸酯酶(sulfatase)结构域,该结构域与激素依赖性癌症的发病机制有关;
大量已发表的研究表明,癌症患者感染COVID-19 后,癌症恶化的总体风险会增加;大量临床研究已证实,COVID-19 患者表现出与氧化应激损伤(oxidative stress damage)一致的症状。在严重氧化应激的情况下,患者的ROS(reactive oxygen species,活性氧/活性氧类)控制机制变得紊乱。活性氧(ROS)失调、紊乱是致癌的关键因素。
SARS-CoV-2含有来自动物,特别是低等动物的基因、蛋白结构。
SARS-CoV-2 S蛋白含有来自软体动物、节肢动物血蓝蛋白的多个血蓝蛋白结构域,S蛋白因这些结构域而具有血蓝蛋白的氧分子结合、运输的能力,以及酚氧化酶和酪氨酸酶活性。酪氨酸酶和酚氧化酶的共同作用可将酪氨酸和多巴胺等酚类物质转化为苯醌,SARS-CoV-2 S蛋白的酪氨酸酶、酚氧化酶活性(S蛋白对血蓝蛋白和两种酶的模仿)可使COVID-19患者醌中毒,全身剧烈疼痛,并出现色素过度沉着症状(皮肤变暗,重症患者皮肤明显变黑)。血蓝蛋白是大部分软体动物(如章鱼、鱿鱼、贝类、蜗牛)和部分节肢动物(如蝎子、蜘蛛、甲壳虫、鲎、虾、蟹)体内的呼吸蛋白及多功能蛋白,人类的呼吸蛋白是血红蛋白,人类和几乎所有哺乳动物,包括蝙蝠和穿山甲,都只有血红蛋白,没有血蓝蛋白(可能有例外,如犰狳);
SARS-CoV-2 的S蛋白、N蛋白等多种蛋白含有来自环节动物、节肢动物巨血红蛋白(Erythrocruorin)接头亚基的C 端域(Eryth_link_C)。巨血红蛋白(Erythrocruorin)是由连接器链(linker chain)连接的若干个细胞外血红蛋白/球蛋白的复合物,也叫巨型细胞外血红蛋白/球蛋白呼吸复合体(giant extracellular hemoglobin /globin respiratory complex),连接血红蛋白/球蛋白的连接器链就是复合体的连接器亚基/接头亚基(The linker subunit)。SARS-CoV-2 可能利用此结构连接/结合人类血红蛋白(Hemoglobin)及其它球蛋白,如肌红蛋白(myoglobin)。SARS-CoV-2 S蛋白、N蛋白等蛋白所含的Eryth_link_C结构域,S蛋白、ORF3a等蛋白所含的NEAT结构域都与血红蛋白连接/结合有关。巨血红蛋白存在于大多数环节动物(如水蛭、蚯蚓)、许多节肢动物(如昆虫)和一些软体动物(如肺蜗牛/陆地蜗牛)中,具有这种蛋白的动物(通常)没有红细胞。
如前所述,SARS-CoV-2 S蛋白中含有存在于哺乳动物和细菌(如一些肠道细菌)中的硫酸酯酶(sulfatase)结构域。
SARS-CoV-2含有来自植物的基因结构。
SARS-CoV-2 S蛋白含有存在于植物质体/色素体(一类植物细胞器,叶绿体就是一种质体或色素体)中的多酚氧化酶PPO1 KFDV结构域。多酚氧化酶可氧化多酚,使S蛋白释放其吸附、构建,用以附着红细胞的Fe-多酚复合物(Fe-polyphenol complexes),从红细胞表面脱落。在“搭乘”红细胞“便车”扩散至某处人体组织后,SARS-CoV-2通过这一机制“到站下车”,以感染抵达地的组织细胞。S蛋白所含多个血蓝蛋白结构域中的血蓝蛋白N端域Hemocyanin_N A也具有酚氧化酶活性。
SARS-CoV-2含有与细菌毒素高度相似的基因结构。
SARS-CoV-2 S蛋白能够强烈结合T细胞受体(T Cell Receptor,TCR),决定这一结合能力的是紧邻S1/S2位点(S1、S2亚基分界处)的氨基酸基序680SPRR683,这一3氨基酸基序同时紧邻S1/S2处的基本furin切割序列682RRAR685。SARS-CoV-2 S蛋白包含680SPRR683基序在内的氨基酸序列片断(Q677~Q690)是SARS-CoV-2 所特有的,除SARS-CoV-2外,这一序列片断在所有β 谱系B支系冠状病毒中都不存在(可能在所有β 谱系冠状病毒,甚至所有冠状病毒中都未报告过),但它在序列和空间结构上与葡萄球菌肠毒素B高度相似,并且二者兼有回文(palindromic)相似性,即这一S蛋白子序列与SEB同一子序列(T150~D161)的正向、反向序列都存在相似性。SARS-CoV-2 S蛋白强力结合TCR的TCRVβ(the variable β-domain of TCR,TCR的可变β 域)和CD28(一种TCR),SEB同样能结合TCRVβ和CD28。肠毒素B(Staphylococcal enterotoxin B,SEB)是金黄色葡萄球菌的代谢、分泌产物,是一种超级抗原(Superantigens,SAgs)毒素,是公认的毒素类生物、化学战剂,生物恐怖制剂;
SARS-CoV-2 S蛋白还含有2段分别与两种肉毒杆菌神经毒素(Botulinum neurotoxin type D or G precursors)高度相似的基序,其中S蛋白中位于T299 至Y351之间,与G型肉毒杆菌神经毒素前体(Botulinum neurotoxin type G precursors)高度相似的基序同样具有预测的TCR结合高亲和力和强烈的T细胞反应触发能力。这2段肉毒杆菌神经毒素样基序继承自SARS-CoV-1,后者S蛋白含有3段与肉毒杆菌神经毒素高度相似的基序。
SARS-CoV-2 S蛋白中具有SAg能力的SEB样基序和肉毒杆菌神经毒素样基序可能是重症患者T细胞大规模激活、增殖,引发细胞因子风暴,造成多器官损伤的关键因素。
SARS-CoV-2含有来自动物毒素的基因结构。
SARS-CoV-2 S蛋白S1/S2位点附近含有一个与眼镜蛇属和银环蛇属的神经毒素同源的蛇神经毒素样区域(snake-toxin like region),蛇神经毒素通过该区域与一种神经元受体--烟碱型乙酰胆碱受体(nAChR)相互作用、结合。HIV的gp120蛋白、狂犬病病毒(Rabies Virus,RABV)的糖蛋白G(狂犬病病毒的Spike)也具有相似的蛇神经毒素样区域。SARS-CoV-2的大脑、神经毒性可能同时与S蛋白的furin切割序列RRAR'SVAS、蛇神经毒素样区域及其它结构有关。SARS-CoV-2 S蛋白的蛇神经毒素样区域(Y674~R685)与上面刚刚谈到的SEB样区域高度重合。
SARS-CoV-2含有借鉴自医疗药剂的基因、多肽结构。
SARS-CoV-2 S蛋白结合人类GRP78(Glucose Regulating Protein 78,葡萄糖调节蛋白78)受体的四个多肽区域(四段基序),与肿瘤化疗的药物载体Pep42在序列、空间环状性质、物理、化学性质上都具有相似性。环状小分子多肽(寡肽)pep42是2006年从人类黑色素瘤癌细胞中筛选、鉴定出来的,它是GRP78的特异性结合配体,具有独特的GRP78结合能力。GRP78广泛存在于各种细胞的细胞膜上和细胞质中,被称为细胞伴侣蛋白,通过结合GRP78,pep42可被后者搭载、输送到各种癌细胞中,是极佳的化疗药物载体。
汇集众多跨物种基因,使SARS-CoV-2拥有以下两组卓越非凡、史无前例的超级能力。
集大量人体因子作用能力于一身。
如本系列文章正在披露、介绍的,SARS-CoV-2集几十种人类蛋白、多肽、酶、激素的结合、摄取、降解、改变、干预、利用、模仿能力于一身,其中,SARS-CoV-2的S蛋白具有超过30种人类细胞表面受体蛋白的结合能力。SARS-CoV-2如此众多、广泛的人体因子作用能力令其它所有病毒瞠目结舌、难望颈背、望尘莫及。凭借极其广泛的细胞膜受体和其它人体因子结合、附着能力,以及其它机制,SARS-CoV-2能够感染几乎所有的人体组织、器官。
周到、完备的免疫对抗能力。
SARS-CoV-2被赋予了极其周到、完备的人类免疫系统对抗机制,它兼具多方位、立体化的免疫破坏、免疫屏蔽和免疫逃避、免疫干扰和免疫抑制能力,它的每一项免疫对抗能力都包含两种以上的实现机制或途径。比如,SARS-CoV-2能够感染、杀死或破坏T(淋巴)细胞、巨噬细胞、单核细胞等多种免疫细胞,再比如其中,通过S蛋白的O-Linked聚糖结构,N-糖基化装饰,三关节式铰链结构(可能是SARS-CoV-2独有的结构),S蛋白的构象屏蔽(在闭合构象下将RBD隐藏在刺突蛋白三聚体头部内),S蛋白与ORF3a蛋白的血红素结合、捕获和氧化活性,S蛋白对红细胞的附着和SARS-CoV-2对红细胞的搭乘,以及S蛋白中放线菌来源的铁硫结合结构4Fe-4S Wbl-type的亚硝化监测功能,SARS-CoV-2至少具有七种免疫屏蔽和免疫逃避机制或途径。
以上内容,都有论文依据。笔者没有做什么创造、发明,但笔者是第一个从众多论文中把上述科学发现汇总在一起的人。这些重要的科学研究成果不被宣传,一直“沉睡”,不为公众所知。这些科学发现不只是匪夷所思,它们不只令人震撼和怵目惊心,更令人无比愤怒。
下面我们转入正题。聚焦、总结一下SARS-CoV-2与红细胞-血红蛋白-血红素-卟啉的关系。
SARS-CoV-2与红细胞
SARS-CoV-2能利用与恶性疟原虫(Plasmodium falciparum)类似的结构感染红细胞(erythrocyte)。SARS-CoV-2的S蛋白含有一个能结合红细胞膜上的complement receptor 1(补体受体1)的C1q结构域,ORF3a 蛋白含有恶性疟原虫抗原EBA-175 结构域,能够结合红细胞膜上的Glycophorin A(血型糖蛋白A/唾液酸糖蛋白A)。S和ORF3a组成红细胞攻击复合体,二者分别与受体蛋白结合并锚定在红细胞膜骨架上,之后ORF3a 使用硫醇激活的溶细胞素结构域(thiol-activated cytolysin domain)在红细胞膜上产生溶血孔(hemolytic pores),然后将病毒RNA注入成熟的红细胞中。SARS-CoV-2对红细胞的感染、入侵(可能)不会有明显的溶血或缺氧反应。
SARS-CoV-2的S蛋白等蛋白能够结合CD147/Basigin、Band3/AE1(带3蛋白)、sialic acid(唾液酸)、complement receptor 1、Acyclophilin A(亲环蛋白A)、CD26 /DPP4、ACE2等众多红细胞表面受体,这些受体中,至少前三种也是(恶性)疟原虫感染红细胞的结合、利用受体;SARS-CoV-2 S蛋白能够结合Acyclophilin A(亲环蛋白A),而恶性疟原虫的裂殖子表面蛋白(merozoite surface protein)能够结合Acyclophilin B(亲环蛋白B);
SARS-CoV-2还能感染红细胞的祖细胞;
SARS-CoV-2也可以不进入、感染红细胞而只是附着在红细胞的细胞膜表面。SARS-CoV-2 S蛋白利用杆状病毒/多角体病毒来源的几丁质(chitin,也叫甲壳素)结合域在S蛋白表面构建铁-多酚复合物(Fe-polyphenol complexes),并通过该复合物吸附到红细胞的细胞膜上,从而使SARS-CoV-2 “搭乘”红细胞的“便车”在人体中扩散,并迷惑、逃脱免疫细胞的侦测、攻击(SARS-CoV-2 众多免疫逃避途径中的一种)。
SARS-CoV-2 S蛋白中的22个N-糖基化位点(N-glycosylation sites)能够与红细胞唾液酸糖蛋白涂层上的聚糖结合,诱发红细胞聚集/团聚(Aggregate/Rouleaux,异常聚集形成轮状/硬币堆叠状团块),引发血栓/血凝(血栓的成因之一)、缺氧(低氧血症),严重时可能造成致命后果。
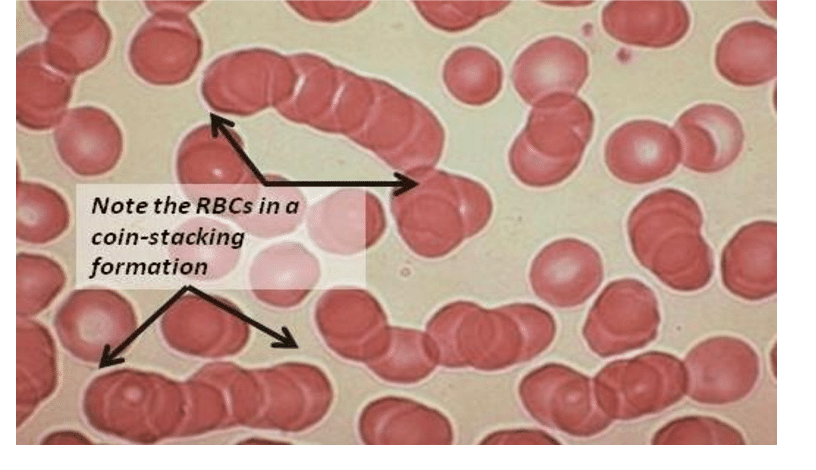
红细胞Aggregate/Rouleaux 形成“硬币”堆栈
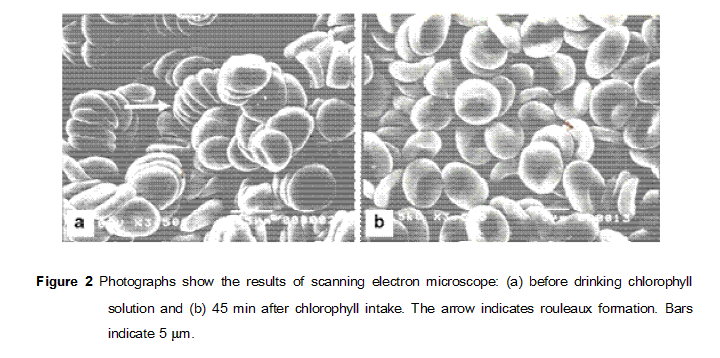
使用水溶性叶绿素(chlorophyll)可缓解红细胞rouleaux formation

可能是一种严重的红细胞rouleaux状态
本图摘自:https://wellcomecollection.org/works/yaf2m8yw
不同PH值下的正常红细胞
实验证明,无须使用全病毒,将SARS-CoV-2 S(Spike)蛋白与人全血混合即可引起红细胞聚集。已知的,另外二种Spike可诱发血凝(hemagglutination,HA)的冠状病毒是牛冠状病毒(bovine coronavirus,BCoV)和血凝性脑脊髓炎病毒(haemagglutinating encephalomyelitis virus,HEV/PHEV )。
注: HEV即猪血凝性脑脊髓炎病毒(porcine haemagglutinating encephalomyelitis virus,PHEV ),BCoV和HEV都属于冠状病毒β谱系A支系,SARS-CoV-2属于β谱系B支系。
论文原文:
Indeed, SARS-CoV-2 spike protein mixed with human whole blood caused RBC aggregation [40], while spike protein from two other coronavirus strains also induced HA [41,42].
SARS-CoV-2 Spike Protein Induces Hemagglutination: Implications for COVID-19 Morbidities and Therapeutics and for Vaccine Adverse Effects
SARS-CoV-2 刺突蛋白诱导血凝:对COVID-19 发病、治疗以及疫苗不良反应的影响
https://www.mdpi.com/1422-0067/23/24/15480
这表明,单独存在的SARS-CoV-2 Spike自身即具有致血凝、致血栓能力。
致血栓、致血凝性应该只是SARS-CoV-2 S蛋白血液毒性的冰山一角。SARS-CoV-2 S蛋白能够结合多种红细胞表面受体,能够与ORF3a蛋白协同作用穿孔、感染、侵袭红细胞,能够利用杆状病毒/多角体病毒来源的几丁质结合域构建铁-多酚复合物吸附红细胞;SARS-CoV-2 S蛋白还能结合红细胞中的血红蛋白,能够结合血红蛋白中的血红素,能够结合血红素的核心构件卟啉;SARS-CoV-2 能够模仿人体血红素加氧酶(heme oxygenase )对血红素的氧化活性,在抗坏血酸(即维生素C)存在时,催化血红素缓慢转化/降解为胆绿素(biliverdin)。S蛋白的这些特性,将使其具有潜在的多方面的血液毒性,而不只限于致血栓/血凝性。当然,部分S蛋白的血液毒性需要其它病毒蛋白的配合。在S蛋白与其它SARS-CoV-2 蛋白(如ORF3a蛋白,ORF3a蛋白能够利用两种病菌来源的结构域—HemS、ABM将血红素裂解/降解为铁和卟啉)协同作用下,SARS-CoV-2的血液毒性可能参与、加剧重症患者的肺损伤和多器官功能障碍。
笔者在上上篇文章(“万能”受体适配器--新冠S蛋白 3)中曾指出,SARS-CoV-2 Spike,包括疫苗中使用的SARS-CoV-2 Spike,及疫苗编码产生的SARS-CoV-2 Spike具有多重毒性,并指出了S(即Spike)蛋白的致血栓性和铁代谢毒性(导致铁代谢紊乱,引发众多关联病症)。
除了致血栓性、血液毒性、铁代谢毒性,SARS-CoV-2 S蛋白还具有或可能具有高度致癌性、肠毒素B超抗原(superantigens,SAg)毒性和神经毒性。
前面已经指出,SARS-CoV-2 S蛋白具有黑色素瘤结构域(melanoma domain)、p53肿瘤蛋白结构域,及与激素依赖性癌症发病机制有关的硫酸酯酶(sulfatase)结构域,具有高度致癌性。
SARS-CoV-2 S蛋白含有与肠毒素B(Staphylococcal enterotoxin B,SEB)高度相似,可强烈结合T细胞受体(T cell receptor,TCR)的基序,SEB是金黄色葡萄球菌的代谢、分泌物,是一种强大的超抗原毒素,是公认的化学战剂、毒素类生物战剂、生物恐怖制剂。
SARS-CoV-2具有多重神经毒性。
SARS-CoV-2 S蛋白具有能够结合神经元受体—烟碱型乙酰胆碱受体(nAChR)的蛇神经毒素样结构域。nAChR是对神经递质乙酰胆碱做出反应的受体多肽,存在于许多生物体的中枢和周围神经系统、肌肉、许多其他组织和免疫系统中;
SARS-CoV-2 S蛋白含有2段与两种肉毒杆菌神经毒素高度相似的基序;
SARS-CoV-2 S蛋白含有一段与ICAM-1/CD54(细胞间粘附分子1 ,一种跨膜糖蛋白)高度相似的基序,这一基序参与S蛋白对T细胞受体的强烈结合。ICAM-1除在普通内皮细胞、免疫系统细胞的细胞膜上表达外,也在中枢神经系统中人类前脑的白质和灰质中的小胶质细胞、星形细胞以及内皮细胞中表达,它具有血脑屏障的关键功能,在精神疾病的发病机制中也具有重要作用。
S蛋白是SARS-CoV-2多重神经毒性,对神经元细胞、神经系统多方位感染、侵袭、损害的关键参与者,S蛋白自身也很可能具有神经毒性。
由于SARS-CoV-2 S蛋白能够作用、模仿众多人体细胞、蛋白、酶、激素、代谢调节因子、免疫调节因子,仅S蛋白可结合的细胞膜表面受体蛋白就超过30种,因此,SARS-CoV-2 S蛋白可能具有更多其它毒性,包括症状明显的致病能力和潜在的长期的人体组织、人体机能损害能力。
SARS-CoV-2与血红蛋白、血红素、卟啉
人类血红蛋白(hemoglobin,Hb)是由2对(4条)血红蛋白单体—珠蛋白聚合成的异源四聚体,每个珠蛋白(globin)由一条肽链和一个血红素(Heme)连接构成;血红素由卟啉(porphyrin)和位于卟啉吡咯环中央的亚铁离子(Fe2+)构成,Heme中央的亚铁离子能够可逆地结合1个氧分子;卟啉是一种广泛存在于动植物、真菌、细菌中的四吡咯环(tetrapyrrole ring)结构,它同时是动物血红素和植物叶绿素(Chlorophyll)的核心构件。人类血红蛋白主要存在于红细胞中。
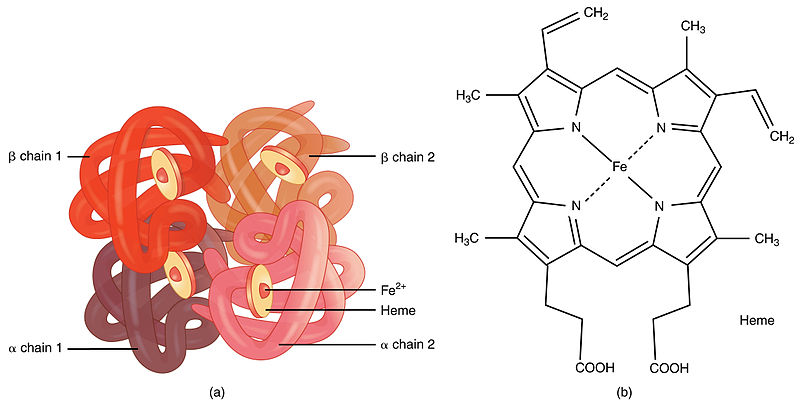
血红蛋白的简易结构(a);血红蛋白中血红素(Heme)的分子结构(b)。
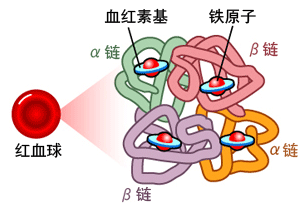
另一个血红蛋白简明结构示意图
SARS-CoV-2能够以包括S蛋白(spike protein)、N蛋白(nucleoprotein,核衣壳蛋白)、ORF3a蛋白在内的多种结构和非结构蛋白/多肽结合人类血红蛋白(hemoglobin,Hb),包括红细胞中的血红蛋白和游离在血浆中的血红蛋白;SARS-CoV-2对Hb的结合及其它作用导致重症COVID-19患者Hb水平降低,RBC(Red blood cell,红血球,即红细胞)计数降低,RDW升高。
注:RDW,red blood cell distribution width,红细胞分布宽度,也叫red cell volume distribution width,红细胞体积分布宽度,是红细胞体积异质性参数,反应红细胞大小不均、形态差异化的程度。
SARS-CoV-2能以N蛋白、S蛋白、M蛋白(membrane protein,膜蛋白)、ORF3a 、Nsp3、Nsp7等多种蛋白、多肽结合血红素(Heme)、卟啉(porphyrin)及血红素的前体--原卟啉IX(Protoporphyrin IX,PpIX)。
其中,S蛋白和ORF3a蛋白可通过小核糖核酸病毒/杯状病毒来源的衣壳结构域结合血红蛋白、血红素和卟啉。
SARS-CoV-2的ORF3a蛋白含有金黄色葡萄球菌来源的,可结合、吸收血红素的NEAT(near iron transporter)结构域,以及相同来源的,负责血红蛋白定位(锚定,即绑定、结合),血红素结合/捕获、吸收的IsdA、IsdC 和IsdH等Isd蛋白(Iron-Regulated Surface Determinant protein铁调节表面决定蛋白)序列。SARS-CoV-2 ORF3a蛋白的NEAT结构域由紧密堆积的IsdA、IsdC、IsdH 域组成。
SARS-CoV-2能以ORF3a 蛋白靶向攻击/结合血红蛋白的1-β 链促使血红蛋白释放血红素,ORF3a还能够将血红素降解为卟啉和铁,并摄取从血红素中解离、释放的亚铁离子。ORF3a蛋白能够通过细菌来源的HemS结构域将血红素直接分离为铁和卟啉;也能够通过HemS结构域或另一种细菌来源的ABM结构域先裂解血红素的四吡咯环结构(cleaving the heme tetrapyrrole ring structure),而后在NADPH-细胞色素P450还原酶存在的情况下降解血红素并释放铁。
SARS-CoV-2的上述机制与金黄色葡萄球菌极为相似,金黄色葡萄球菌首先以几种Isd 蛋白(IsdA、IsdC 和IsdH/IsdB)靶向结合1-β 链降解血红蛋白、释放血红素,继而,在NADPH 细胞色素P450 还原酶存在的情况下,以两种血红素加氧酶IsdG 和IsdI裂解血红素-卟啉的四吡咯环结构,使金黄色葡萄球菌得以摄取所释放的亚铁离子。
SARS-CoV-2 ORF3a蛋白兼具金黄色葡萄球菌几种Isd蛋白的血红蛋白降解能力和两种Isd血红素加氧酶的血红素、卟啉裂解/降解能力。
能降解血红素的不只ORF3a蛋白。SARS-CoV-2 S蛋白能够模仿人体血红素加氧酶(heme oxygenase )对血红素的氧化活性,在抗坏血酸(ascorbic acid/ascorbate,即维生素C/Vitamin C)存在时,催化血红素缓慢转化/降解为胆绿素(biliverdin)。
SARS-CoV-2 Spike的血红素捕获/结合和氧化活性可能会限制抗体效力,并有助于SARS-CoV-2的免疫逃避(SARS-CoV-2的另一种免疫逃避途径)。
论文依据一
COVID-19 :Attacks the 1-Beta Chain of Hemoglobin to Disrupt Respiratory Function and Escape Immunity by Capsid-Like System
COVID-19:攻击血红蛋白的1-β链,通过衣壳样系统破坏呼吸功能并逃避免疫
https://chemrxiv.org/engage/chemrxiv/article-details/63d134df6bc5ca30b61a9d64
https://www.researchgate.net/publication/367468145_COVID-19_Attacks_the_1-Beta_Chain_of_Hemoglobin_to_Disrupt_Respiratory_Function_and_Escape_Immunity_by_Capsid-Like_System
论文第一版发表于06 March 2020,当前最新版本是第12版,发布于27 January 2023。论文篇幅相当长,涉及广泛,内容丰富、深刻。以下论文要点基于最新版本。
1、利用MEME Suite(一个序列分析套件)和UniProt数据库进行序列/基序搜索、匹配、分析,结果表明,SARS-CoV-2 S蛋白含有多种用于多酚结合和硝化监测的结构域,这些结构域包括the metallophos(金属磷)、PPO1 KFDV(一种存在于植物质体/色素体中的多酚氧化酶)、PPO1 DWL(an intermediate domain of polyphenol oxidase.,一种多酚氧化酶的中间结构域)、sulfatase(硫酸酯酶,一种催化多种硫酸酯水解的磺酶,存在于动物和细菌中)、sulfotransfer 1 domains(苯酚磺基转移酶结构域1);
S 蛋白中还存在Chitin-binding type-2(几丁质结合-2 型)、4Fe-4S Wbl-type(一种铁硫结合结构,多见于放线菌的铁硫蛋白,放线菌包括链霉菌和分枝杆菌)、Sulf translocation domains(硫易位结构域)等结构域。
Chitin-binding type-2(几丁质结合-2 型)是结合几丁质(chitin,又叫甲壳质或甲壳素)的结构域,该结构域主要存在于动物和杆状病毒的蛋白质中。
注:杆状病毒(baculovirus)是一类双链环状DNA病毒,属于杆状病毒科,杆状病毒以昆虫为感染对象,其基因改造产品被广泛用作杀虫剂或昆虫防制剂。
SARS-CoV-2 S 蛋白中的Chitin-binding type-2 结构域来自杆状病毒中的多角体病毒(polyhedrosis viruse)。Chitin-binding type-2结合几丁质,几丁质又能吸附单宁等多酚,而多酚是多角体病毒/杆状病毒衣壳蛋白构建病毒载体以附着细胞的关键分子。后面将说明,S蛋白的几丁质结合域(即Chitin-binding type-2)使SARS-CoV-2能够附着到红细胞表面,由红细胞搭载在人体内扩散。
2、序列/基序搜索、匹配、分析还表明,SARS-CoV-2 S 蛋白的S1亚基、S2亚基都包含大量衣壳样结构域(Capsid-like domains)基序(motif)。
这些衣壳样结构域基序分别来自adenoviruses(腺病毒)、baculovirus (杆状病毒)、RHDV(rabbit hemorrhagic disease virus,兔出血热病毒,一种calicivirus/杯状病毒)、flavivirus (黄病毒,丙型肝炎病毒、寨卡病毒、登革热病毒都是黄病毒科病毒)、一些dsDNA病毒(双链DNA病毒)、retroviruses(逆转录病毒)/HIV(human immunodeficiency virus,人类免疫缺陷病毒,即艾滋病病毒)、HCV(hepatitis C virus,丙型肝炎病毒)、hepatitis B virus(HBV,乙型肝炎病毒)、Nepovirus(神经病毒,豇豆花叶病毒科的一个病毒属)、picornaviruses(微小核糖核酸病毒,包括脊髓灰质炎病毒、甲型肝炎病毒、口蹄疫病毒等等)、parvovirus(细小病毒)、Rhabdovirus(弹状病毒)、rotavirus(轮状病毒)及多种植物二十面体正链RNA 病毒(plant icosahedral positive-strand RNA virus)等众多动物、植物病毒;
S 蛋白S1、S2亚基所包含的大量衣壳样结构域基序,分别来自上述病毒的capsid protein(衣壳蛋白)、coat protein(外壳蛋白)、envelope PEP protein(囊膜PEP蛋白)、nucleocapsid protein(核衣壳蛋白)、nucleocapsid Gag protein(核衣壳GAG蛋白)、hemagglutinin outer capsid protein(血凝素外衣壳蛋白)、core protein(核心蛋白)、fiber protein(纤维蛋白)及其它蛋白或基因。
SARS-CoV-2 S蛋白通过S1亚基中的某些衣壳样结构域构建病毒载体(应该是配合几丁质结合域的载体构建功能);S2蛋白的衣壳样结构域主要位于富含半胱氨酸的区域,该区域和附近位点主要参与膜融合。
3、SARS-CoV-2 的非结构蛋白ORF3a同样含有很多上述病毒来源的衣壳样活性结构域基序,它具有与小核糖核酸病毒类似的衣壳蛋白活性;ORF3a缺乏几丁质结合结构/功能,它的衣壳蛋白活性不用于构建病毒载体,ORF3a 通过衣壳蛋白活性来伪装自己,误导、迷惑血液细胞或免疫细胞。
4、SARS-CoV-2 的结构蛋白S(Spike,刺突)、N(Nucleocapsid,核衣壳)、E(Envelope,包膜),非结构蛋白ORF3a、ORF7b、ORF10、nsp2、nsp3 和RdRP 均具有细菌和线粒体来源的Haem_bd 结构域,其中E和ORF3a的Haem_bd 结构域中含有Heme(血红素)、卟啉(porphyrin)结合基序CXXC。Haem_bd 结构域存在于大多数细胞色素C 氧化酶(cytochrome C oxidases)中,而细胞色素C 氧化酶存在于细菌和真核生物线粒体中。
注,ORF:Open Reading Frame,开放阅读框;
RDRP:RNA-dependent RNA polymerase, RNA依赖的RNA聚合酶。
S、ORF3a 的Haem_bd 结构域与衣壳结构域存在(部分)重叠,与Heme 的结合可能会抑制它们的衣壳活性;
E 和ORF3a 以相对稳定的方式与Heme结合,其他(含Haem_bd结构域的)SARS-CoV-2 蛋白与Heme的结合可能不稳定。
5、SARS-CoV-2的多种结构、非结构蛋白含有节肢动物(Arthropod)、环节动物(annelid)来源的Eryth_link_C结构域,以及金黄色葡萄球菌(Staphylococcus aureus)来源的NEAT结构域。其中, S、N、ORF6、ORF7b、ORF8、ORF10、nsp6、nsp10和RdRP含有Eryth_link_C 结构域,S、E、N、ORF3a、ORF6、ORF7a、ORF7b、ORF8、ORF10、2'-O-ribose methyltransferase(2'-O-核糖甲基转移酶)含有NEAT结构域,S、N、ORF6、ORF7b、ORF8、ORF10同时含有Eryth_link_C结构域和NEAT结构域。这两种结构域都与血红蛋白连接/结合有关,它们使SARS-CoV-2具有攻击血红蛋白的能力。
注:Eryth_link_C即erythrocruorin linker subunit, C-terminal domain,巨血红蛋白接头亚基的C 端域。巨血红蛋白(Erythrocruorin)是若干个细胞外血红蛋白/球蛋白由连接器链(linker chain)连接而成的复合物,也叫巨型细胞外血红蛋白/球蛋白呼吸复合体(giant extracellular hemoglobin /globin respiratory complex),连接血红蛋白/球蛋白的连接器链就是复合体的连接器亚基/接头亚基(The linker subunit)。SARS-CoV-2 可能利用Eryth_link_C结构域连接/结合人类血红蛋白(Hemoglobin)及其它球蛋白,如肌红蛋白(myoglobin)。巨血红蛋白(Erythrocruorin)存在于大多数环节动物(如水蛭、蚯蚓)、许多节肢动物(如昆虫)和一些软体动物(mollusc/mollusk,如肺蜗牛/陆地蜗牛)中,具有这种蛋白的动物(通常)没有红细胞。
NEAT(near transporter/near iron transporter,近铁转运蛋白)结构域存在于金黄色葡萄球菌的与血红素吸收有关的多个isd蛋白(Iron-regulated surface determining protein,铁调节表面决定蛋白)中,负责编码人类血红蛋白受体。金黄色葡萄球菌的IsdA、IsdC 和IsdH/IsdB等Isd 蛋白能够结合人类红细胞中的血红蛋白(hemoglobin,Hb)、血浆中游离的血红蛋白、人类血浆中的触珠蛋白(haptoglobin,Hp,也叫结合珠蛋白)以及Hb和Hp的复合体,还能降解血红蛋白,释放、结合/捕获血红素。
SARS-CoV-2 E蛋白中的NEAT结构域较短,具有血红素捕获功能;S、N、ORF3a、ORF6、ORF7b、ORF8 和 ORF10 等蛋白具有较长的NEAT结构域,可以结合并捕获血红蛋白。
S和ORF3a 蛋白的NEAT结构域与其衣壳结构域存在(部分)重叠,类似与血红素的结合,与血红蛋白的结合也可能抑制S和ORF3a的衣壳活性。
注:由其它论文可知,SARS-CoV-2 S蛋白还含有金黄色葡萄球菌的致病抗原结构;SARS-CoV-2 特有的,其S蛋白强烈结合T细胞受体(T cell receptor,TCR)的序列基序(序列片断),在序列和空间结构上与金黄色葡萄球菌的代谢、分泌物—肠毒素B(SEB)高度相似。肠毒素B是一种强大的超抗原毒素,是公认的化学战剂、毒素类生物战剂、生物恐怖制剂。
6、使用MEME Suite比较血红蛋白降解相关序列与SARs-CoV-2病毒各蛋白序列,结果表明,SARS-CoV-2 的E、ORF3a、ORF7a、ORF7b、ORF8和ORF10 含有致病细菌来源的肽酶S6结构域(Peptidase S6 domain),不过,只有ORF3a中的肽酶S6结构域含有与Gly-Xaa-Ser-Gly-Xaa-Pro基序相似的C-R-S-K-N-P(CRSKNP)基序。
注:Gly-Xaa-Ser-Gly-Xaa-Pro基序在肽酶S6和其它几个丝氨酸肽酶(serine peptidase)家族,如肽酶S1、S2、S7、S29、S30 中高度保守。
肽酶S6结构域发现于淋病奈特氏菌(Neisseria gonorrhoeae)的IgA(immunoglobulin A,免疫球蛋白A)特异性丝氨酸内肽酶自转运蛋白(IgA-specific serine endopeptidase autotransporter)、流感嗜血杆菌(Haemophilus influenzae)的IgA1蛋白酶自转运蛋白(immunoglobulin A1 protease autotransporter),和致病性大肠杆菌(pathogenic Escherichia coli)的血红蛋白结合蛋白酶自转运蛋白(hemoglobin binding protease autotransporter)中。
肽酶S6结构域能够催化血红蛋白降解,释放其中的血红素。
人类 IgA1 蛋白在铰链区被细菌IgA1 蛋白酶切割,细菌IgA1 蛋白酶可能通过裂解人类IgA1蛋白破坏组织粘膜表面的特异性免疫;致病性大肠杆菌的血红蛋白结合蛋白酶(hemoglobin binding protease ,Hbp)附着在血红蛋白上,将其破坏,然后与释放的血红素结合。
如前所述,ORF3a还具备血红素结合基序CXXC,同时充当致病细菌的IgA1肽酶和和血红蛋白结合蛋白酶(Hbp),它通过Hbp 的肽酶S6结构域作用于血红蛋白,然后通过催化基序C-R-S-K-N-P直接寻找并结合血红素(这意味着ORF3a兼具血红蛋白结合、催化血红蛋白降解、血红素结合能力)。
ORF3a 蛋白的血红蛋白蛋白酶结构域(肽酶S6结构域)与其衣壳结构域重叠。
注。目前论文内容的小结:
S蛋白的Eryth_link_C结构域,S、ORF3a蛋白的NEAT结构域,ORF3a蛋白的肽酶S6结构皆可结合血红蛋白;ORF3a蛋白的肽酶S6结构域可攻击(催化降解)血红蛋白;ORF3a蛋白的肽酶S6结构域、Haem_bd 结构域皆可结合血红素。
7、SARS-CoV-2 ORF3a蛋白既能够结合、降解血红蛋白,也能结合、摄取血红素,ORF3a在收集血红素之前结合并降解血红蛋白。ORF3a蛋白具有IsdA、IsdC和IsdH等金黄色葡萄球菌Isd蛋白的血红素摄取活性。
金黄色葡萄球菌所有参与血红素结合、吸收(摄取)的Isd蛋白(Iron-Regulated Surface Determinant protein,铁调节表面决定蛋白)都包含NEAT 结构域,ORF3a也含有NEAT 结构域;金黄色葡萄球菌具有IsdA、IsdC 和IsdH/IsdB等Isd蛋白,它们能够完成血红蛋白定位和血红素结合/捕获等活动,ORF3a中含有3段分别来自金黄色葡萄球菌IsdA、IsdC和IsdH蛋白的基序。
ORF3a中的IsdH结构域负责定位、连接血红蛋白,IsdA结构域负责攻击/降解血红蛋白并将血红素从血红蛋白转移到IsdC结构域,IsdC结构域负责结合、摄取从血红蛋白中释放出的血红素。
ORF3a 的(几个)Isd 结构域与其衣壳结构域重叠。ORF3a将在结合血红蛋白α链后以Isd 结构域攻击血红蛋白(1-β 链)。
8、SARS-CoV-2 ORF3a蛋白还能够将血红素降解为铁和卟啉。ORF3a具有存在于金黄色葡萄球菌的两种血红素降解酶(heme-degrading enzyme)IsdG 和IsdI之中,以及结核分枝杆菌(Mycobacterium tuberculosis)的血红素降解单加氧酶(heme-degrading monooxygenase)之中的ABM 结构域;ORF3a还同时具有来自HemS/ChuX蛋白的HemS结构域,HemS/ChuX是一种可降解血红素的蛋白质。
注:HemS/ChuX蛋白存在于汉赛巴尔通体(Bartonella henselae ,一种可导致猫抓病的革兰氏阴性杆菌)、小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)等革兰阴性杆菌或球杆菌中。同为耶尔森氏菌的鼠疫耶尔森氏菌(Yersinia pestis)的血红素摄取蛋白为HmuX。
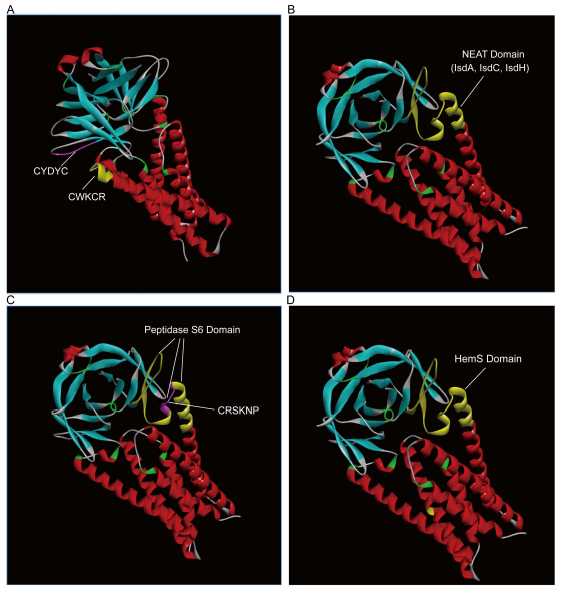
Figure 1. SARS-CoV-2 ORF3a三维晶体结构中Hb、Heme结合、降解相关结构域的分布
a:ORF3a 中两个相邻的血红素结合基序“CWKCR”和“CYDYC”;
b:由紧密堆积的IsdA、IsdC、IsdH 域(基序)组成,定位、结合Hb,摄取Heme的ORF3a NEAT 结构域;
c:催化Hb降解,释放血红素的ORF3a 肽酶S6结构域及其中的CRSKNP基序;
d:催化Heme降解为铁和卟啉的HemS结构域。
在ORF3a蛋白中,肽酶S6结构域与NEAT结构域存在重叠区域;HemS 结构域与NEAT、肽酶S6 和ABM 3个结构域都存在重叠;
金黄色葡萄球菌血红素降解酶IsdG 和IsdI 中的ABM 结构域在NADPH 细胞色素P450 还原酶(NADPH cytochrome P450 reductase)存在时裂解血红素四吡咯环结构,并从血红素中释放铁;相关细菌中的HemS/ChuX蛋白催化血红素中铁的释放,而不会破坏四吡咯结构骨干。不过,在抗坏血酸(ascorbic acid/ascorbate,即维生素C/Vitamin C)或NADPH-细胞色素P450 还原酶等电子供体存在的条件下,HemS 与血红素结合后,也能在释放铁的同时破坏血红素的四吡咯环结构。
ORF3a蛋白能够通过HemS结构域将Heme直接分离为铁和卟啉(保持卟啉的四吡咯环结构);也能在NADPH-细胞色素P450还原酶存在的情况下,通过ABM结构域或HemS结构域以裂解Heme四吡咯环的方式降解Heme并释放铁。
ORF3a 的血红素降解域(ABM、HemS)与其衣壳域存在(部分)重叠。ORF3a 将在结合血红素后降解血红素。
9、SARS-CoV-2 ORF3a蛋白的攻击会降低Hb的氧气运输能力,损害人体呼吸功能。
ORF3a 通过类似于Plasmodium falciparum(恶性疟原虫)中发现的结构域感染红细胞,并 与红细胞膜中的血影蛋白(spectrin)等细胞骨架蛋白结合形成离子通道。ORF3a 的HemS、NEAT、肽酶S6和ABM 结构域在邻近细胞质的红细胞内膜中发挥作用。
笔者注:ORF3a 含有恶性疟原虫抗原EBA-175 结构域,恶性疟原虫通过该结构域结合红细胞膜上的Glycophorin A(血型糖蛋白A/唾液酸糖蛋白A)。
ORF3a 可能通过NEAT 结构域的IsdH 域(基序)与1-α-Hb 连接,继而通过肽酶S6结构域改变、降解β-Hb,从1-β-Hb 中释放血红素;ORF3a的IsdA 域(基序)负责捕获脱落的血红素并将其运输至IsdC区域(IsdC基序负责结合、摄取从血红蛋白中释放出的血红素);接下来,ORF3a 通过HemS 结构域将血红素解离成铁和卟啉(保持卟啉的四吡咯环结构),或者,在NADPH-细胞色素P450 还原酶存在的情况下,ORF3a 通过HemS 或ABM 结构域裂解血红素的四吡咯环并释放铁。受到ORF3a 攻击的血红蛋白可能会保留其大部分天然结构域,但氧气运输能力降低。
10、SARS-CoV-2 S蛋白含有多个存在于某些低等动物血蓝蛋白(Hemocyanin)中的结构域,具体包括:一个Hemocyanin C端域(Hemocyanin_C A)、一个Hemocyanin N端域(Hemocyanin_N A)、三个Hemocyanin 活性域(Hemocyanin_M A、E、F)。S蛋白三个Hemocyanin 活性域中的Hemocyanin_M E、F 中还含有三个铜结合酪氨酸酶区域(Tyrosinase_Cu-bd A-C)。
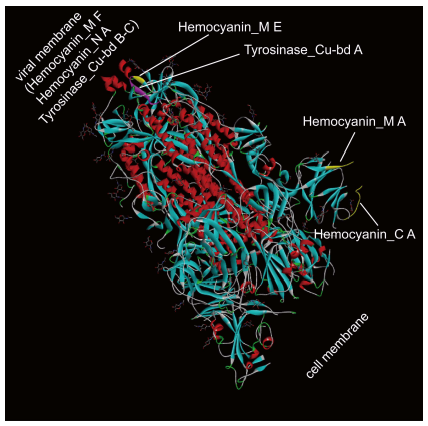
Figure 2. SARS-CoV-2 S蛋白晶体结构中的血蓝蛋白结构域分布
血蓝蛋白是大部分软体动物(如章鱼、鱿鱼、贝类、蜗牛)和某些节肢动物(如蝎子、蜘蛛、鲎、龙虾)的氧气运输蛋白及呼吸蛋白。血红蛋白主要存在于红细胞中,而血蓝蛋白则游离存在于类似血液的血淋巴中;血红蛋白的氧结合金属是铁,血蓝蛋白是铜。人类和绝大多数哺乳动物只有血红蛋白,没有血蓝蛋白(SARS-CoV-2 来自蝙蝠、穿山甲,还是软体动物、节肢动物?)。
位于跨膜区域的Hemocyanin_N A具有酚氧化酶活性,能够氧化多酚;Hemocyanin_N A的酚氧化酶活性与3个Tyrosinase_Cu-bd的铜结合活性相互依赖。位于病毒包膜外部的Tyrosinase_Cu-bd A首先与Cu 结合,使S 构象发生改变,暴露出跨膜区域,这时Hemocyanin_N A才有机会发挥酚氧化酶活性;暴露出的Hemocyanin_N A随后充当Tyrosinase_Cu-bd B、C的Cu结合位点,促成二者与Cu结合(进而利用Cu结合氧分子)。Hemocyanin_N A与Tyrosinase_Cu-bd 的协作使S蛋白兼具血蓝蛋白的酚氧化酶活性和氧气结合、运输能力。
11、SARS-CoV-2原型病毒(早期病毒株)、Delta变体、Omicro变体S蛋白中的血蓝蛋白结构域存在差异。
三种S蛋白都具有酪氨酸酶Cu结合位点,因此它们均可充当氧气载体运输氧分子。
Delta S 的铜结合位点(包括Tyrosinase_Cu-bd A)高度暴露,因此具有更强的酚氧化酶活性(这可能是Delta毒力更强的原因之一);Delta S的S1亚基易于接近铜结合位点,因此Delta S同时具有更强的氧运输能力。这也许可以解释,为什么(Delta毒力更强,)Delta 患者比原型SARS2患者病毒载量更高,但呼吸窘迫程度却反而较低;
Omicro S 发展成为一种血蓝蛋白样蛋白,它能够携带氧分子,但由于只具有两个酪氨酸酶_Cu-bd结构域(缺少Tyrosinase_Cu-bd C)而无法完全实现细胞凝集和酚氧化酶活性,这或许可以解释为什么Omicro 患者严重症状较少且没有明显的呼吸窘迫。
12、依前所述,SARS-CoV-2 ORF3a蛋白中参与Hb、Heme结合、捕获、攻击、降解/分解的结构域包括haem_bd、NEAT、peptidase S6、IsdA、IsdC、IsdH、ABM、HemS等。
Omicro的ORF3a蛋白内没有突变位点;Delta的ORF3a蛋白只有两个单点突变,这两个单点突变都在上述结构域之外,因此,Omicro、Delta与SARS-CoV-2 原型病毒在ORF3a蛋白的Hb、Heme结合、捕获、攻击、降解/分解能力方面应当没有差异。
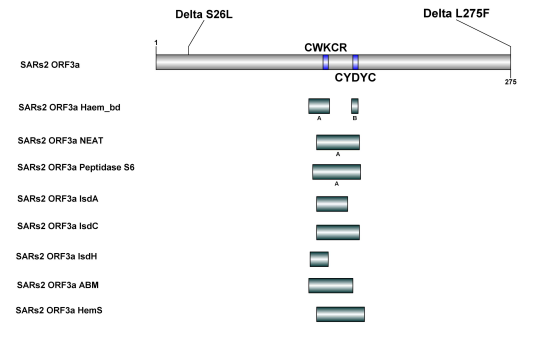
Figure 4. SARS-CoV-2原型病毒及Delta、Omicro变体中作用于Hb、Heme的结构域
13、SARS-CoV-2 S蛋白的S1亚基通过几丁质结合域(Chitin-binding type-2)结合几丁质(甲壳质/甲壳素),而后利用几丁质吸附多酚和铁,并通过多酚结合域构建铁-多酚络合物(Fe-polyphenol complexes),再以铁-多酚络合物为介质附着到红细胞的细胞膜上。这一过程在Figure 5中对应标记“Get On”(上车)的“虚线框”。
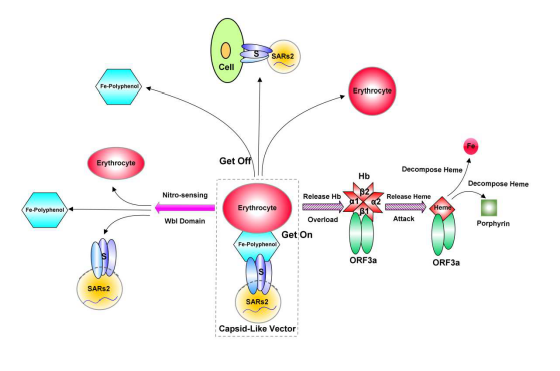
Figure 5. SARS-CoV-2 S、ORF3a 协同工作,延迟免疫反应并损害呼吸系统机制示意图。
附着到红细胞细胞膜上的SARS-CoV-2 搭乘红细胞的“便车”到达机体各组织。在组织细胞附近,S蛋白通过所含的血蓝蛋白N端域(Hemocyanin_N A)或植物质体/色素体来源的PPO1 KFDV结构域的多酚氧化活性氧化多酚,将铁-多酚络合物降解、释放,SARS-CoV-2从红细胞细胞膜上脱落。“到站下车”后,SARS-CoV-2将感染周边组织细胞。这一过程在Figure 5 中以“Get Off”(下车)指示。
搭乘红细胞“便车”使SARS-CoV-2 得以在人体内高效、广泛扩散并欺骗、逃避免疫系统侦测(SARS-CoV-2多种免疫逃避机制/途径之一)。
过多SARS-CoV-2颗粒的粘附(Overload)会导致红细胞释放血红蛋白(Release Hb),释放的Hb与NO(一氧化氮)结合,以RNS(reactive nitrogen species,活性氮类/活性氮)自由基攻击S蛋白。
SARS-CoV-2 S蛋白中放线菌铁硫蛋白(Actinomyces iron-sulfur protein)来源的4Fe-4S Wbl-type铁硫结合结构域对一氧化氮 (NO) 极其敏感,其亚硝化监测、硝基传感(Nitro-sensing)功能使SARS-CoV-2 能够逃避免疫细胞及红细胞的RNS自由基攻击(SARS-CoV-2另一种免疫逃避机制/途径)。
为保护S 蛋白,ORF3a蛋白主动与Hb结合(可能通过ORF3a中的NEAT、IsdH、肽酶S6等结构域),然后通过isd(IsdA)结构域和血红蛋白酶(hemoglobinase)攻击血红蛋白1-β链,释放其中的血红素(Release Heme)。(以IsdC结构域结合、摄取释放出的血红素后,)ORF3a继而通过hemS结构域将血红素并将其分解为铁和卟啉(保持四吡咯环结构),或在NADPH-细胞色素P450 还原酶存在的情况下,通过HemS 或ABM 结构域裂解血红素的四吡咯环并释放铁。ORF3a对血红蛋白、血红素的攻击、破坏会损害呼吸功能,不过,S蛋白血蓝蛋白功能域的氧输送能力可以缓解感染者的呼吸功能障碍。
14、SARS-CoV-2 S蛋白具有脊髓灰质炎病毒(poliovirus)等小核糖核酸病毒(picornavirus)的衣壳蛋白活性,SARS-CoV-2 可能和这些病毒一样,也能直接穿透细胞膜(无须通过受体结合)。能够直接穿透宿主细胞膜的病毒还有HIV。
SARS-CoV-2可能通过结合卟啉(porphyrin)或血红素穿透细胞膜,直接进入人体细胞。卟啉能够产生破坏细胞膜的活性氧(reactive oxygen species,ROS),卟啉化合物(porphyrin compounds)具有很强的细胞膜定位和穿透能力。卟啉化学物质,例如合成卟啉光敏剂,经常用于治疗癌症,卟啉产生的活性氧(ROS)可以杀死肿瘤细胞。卟啉在人体内主要存在于血红蛋白内的血红素中(血红素是结合亚铁离子的卟啉)。
15、血红蛋白水平越高,发病率越高。正常男性的血红蛋白含量明显高于正常女性,糖尿病患者的糖化血红蛋白(即脱氧血红蛋白,是血红蛋白和血糖的结合体)较高,这可能是男性和糖尿病患者COVID-19患病(和重症)风险更高的原因之一。ORF3a协同(S蛋白)攻击血红蛋白β链上的血红素,含氧血红蛋白和脱氧血红蛋白都会受到病毒攻击,但后者(可能)更容易受到攻击。
16、现有记录表明,COVID-19危重患者体内存在过多的游离铁,这可能是SARS-CoV-2与铁竞争卟啉,抑制血红素合成代谢所造成的。
体内卟啉代谢紊乱引起卟啉症,HIV、丙型肝炎病毒(hepatitis C virus,HCV)都能引起卟啉症。大量临床观察显示,COVID-19患者也存在与卟啉症一致的皮肤和神经系统症状。SARS-CoV-2 病毒蛋白可能具有尿卟啉原III 合酶(uroporphyrinogen III synthase)活性,并通过产生类血红素(comparable heme)来促进感染。尿卟啉原III 合酶是一种血红素生物合成酶,它的遗传异常会导致先天性红细胞生成性卟啉症(congenital erythropoietic porphyria)。
17、SARS-CoV-2具有高度致癌性。
我们发现,SARS-CoV-2的S蛋白等蛋白质具有黑色素瘤结构域(melanoma domain),许多恶性肿瘤,包括肺癌,都具有包含黑色素瘤结构域的致病蛋白;SARS-CoV-2的S蛋白等蛋白质还含有p53结构域,当P53 蛋白突变时,正常细胞可能会发展成癌细胞。
大量已发表的研究表明,癌症患者感染COVID-19 后,癌症恶化的总体风险会增加;大量临床研究已证实,COVID-19 患者表现出与氧化应激损伤(oxidative stress damage)一致的症状。在严重氧化应激的情况下,患者的ROS(reactive oxygen species,活性氧/活性氧类)控制机制变得紊乱。活性氧(ROS)失调是致癌的关键因素。
COVID-19死者的肺部充满粘液,恶化的肺组织(形态)类似于腺癌样改变。
基于这些综合特征,我们认为 SARs-CoV-2 病毒具有高度致癌性。
18、COVID-19患者可能表现出醌中毒和色素过度沉着症状
如前所述,SARS-CoV-2 S蛋白含有植物质体/色素体来源的多酚氧化酶PPO1 KFDV结构域;S蛋白还含有软体动物、节肢动物血蓝蛋白(Hemocyanin)来源的,同样具有酚氧化酶活性的Hemocyanin N端域(Hemocyanin_N A)和三个铜结合酪氨酸酶区域(Tyrosinase_Cu-bd A-C)。
酪氨酸酶(Tyrosinase)和酚氧化酶(Phenoloxidase)可将酪氨酸和多巴胺等酚类物质转化为苯醌。苯醌是一种高刺激性的生化物质,吸入后会引起中毒,导致烧灼感、咳嗽、气短、头痛及全身疼痛症状。COVID-19/Omicron 患者喉咙、肌肉和关节的剧烈疼痛,很大程度上就是苯醌造成的,而苯醌则是S 蛋白酪氨酸酶活性和酚氧化酶活性的产物。
一些受病原体感染的低等物种也会出现色素沉着。血蓝蛋白的胞外酚氧化酶(extracellular phenoloxidase)或酚氧化酶活性是导致贝类(shellfish)、褐藻(brown algal)?、挪威龙虾(Nephrops norvegicus/Norway lobster)色素过度沉着/黑变病(hyperpigmentation/melanosis)的主要原因。
接受 ECMO 抢救的COVID-19 患者皮肤明显变黑。COVID-19的众多皮肤病症状包括:荨麻疹、融合性红斑/斑丘疹/麻疹样皮疹、丘疹性皮疹、冻疮样皮损、网状青斑/葡萄状样斑和紫癜“血管炎”。与某些严重皮肤病相关的红斑可能会转化为色素沉着过度。COVID-19眼部感染患者会出现单侧急性后多灶性板层色素上皮病。 COVID-19患者存在双侧角膜内皮色素沉着、前房色素分散、虹膜色素脱失伴虹膜透照异常。
黑色素通过影响宿主细胞因子/趋化因子的产生直接或间接影响炎症反应。
笔者注:COVID-19 患者的色素沉着也可能与其它因素,如急性肾损伤(Acute kidney injury ,AKI)有关。
19、现有血氧检测方法存在缺陷,仅考虑和高估了血红蛋白的供氧状态,忽略了SARS-CoV-2 S蛋白类似血蓝蛋白的氧气结合、携带能力。
(未完待续)















