和笔者一同溯源吧,和笔者一起破案吧。我们共同揭开、展示、宣传那些被捂盖、被封锁的重大溯源证据、线索、疑点,共同查明SARS-CoV-2的真正来源,锁定其设计、制造者;我们共同破解SARS-CoV-2远涉重洋进入中国、抵达武汉、出现在人群中的曲折过程,还原疫情发生的隐秘真相,锁定疫情的制造者;我们共同戳破诸如SARS-CoV-2来自动物、来自自然界,以及疫情源自武汉所事故泄漏之类的弥天大谎;我们共同侦破、揭穿其它来自实验室的病毒,揪出、斩断隐藏多年、不只一次作案、至今逍遥法外的邪恶黑手。
感谢平台,让笔者有机会发声,有机会发表研究所得、研究见解,让笔者的文章有容身之所。在一些地方,笔者的溯源文章不能发表,不能存活,不能得见天日。
肯请平台,对这些研究了大量科学论文,披露了大量SARS-CoV-2研究成果,挖掘、披露了大量溯源证据、线索、疑点的溯源文章,对这些贡献了独创性的、可能意义深远的溯源发现的溯源文章,对这些论据确凿、扎实、丰富,逻辑严谨、周密,内容真实、可靠,信息全面、透明、无遮掩的优秀溯源文章,对这些凝聚了笔者大量心血、全网独一无二的原创溯源文章,肯请平台,请不要压制、消音或冷漠对待它们,请不要让它们困处一隅,鲜有人知,请不要让它们悄然埋没、湮灭,如同未存在过;肯请平台,请给这些文章多一些关注、温暖和支持,请给这些文章多一些展示、传播的机会,请给这些文章多提供一些讨论、交流的机会,请给这些文章多提供一些接受批驳、批判的机会。这些溯源文章不只是笔者的作品,它们也是世人的财富,它们也是平台的财富。
偏听则暗,兼听则明。聪明的人目光长远、视野开阔,眼观六路、耳听八方,不会以沙埋头、闭目塞听。除了溯源证据、线索、疑点,对笔者总结、披露的,挖掘自众多科学论文的其它信息,如SARS-CoV-2的隐性或长期的危险致病能力(包括但不限于高度致癌性),或许您也应该了解它们,而不是一无所知。
广大网友,请不要回避笔者的作品,它们配得上您关注的目光,它们值得您驻足停留,它们值得您仔细审视、深入思考。如果您并不仇视笔者的文章,如果您和笔者一样,主张以是非定立场,而非以阵营定立场、定是非,如果您不是象某些人那样,在用不留言、不讨论,不质疑、不建议,不批评、不驳斥的方式冷冻笔者的文章,压低它们的热度,那么,我诚挚地肯请您,请展现您对真相的渴望,请释放您追求真相的热忱,请留下您的宝贵意见!不要让笔者心灰意冷,不要让笔者失去坚持的勇气和力量。
人类需要阳光,人类需要真相;我们需要知道SARS-CoV-2的来源真相,我们需要知道这次疫情的发生真相。
接续:
新冠中的跨物种、跨生物界、超生物基因 5
SARS-CoV-2与一些非“近亲”冠状病毒,与多种非冠状病毒(包括但不限于艾滋病病毒、狂犬病病毒、流感病毒、乙肝病毒、丙肝病毒),
与多种致病细菌(包括但不限于炭疽杆菌 、霍乱弧菌、鼠疫耶尔森氏菌、幽门螺杆菌、破伤风梭菌、结核分枝杆菌、麻风分枝杆菌),
与某些寄生虫(如恶性疟原虫),
与某些人体结构元件(如ENaC-α/上皮钠离子通道的α亚基),
与某些人类蛋白(包括但不限于p53肿瘤蛋白、Hermansky-Pudlak syndrome protein/ 赫曼斯基-普德拉克综合症蛋白、RhoGEF蛋白、ICAM-1/细胞间粘附分子-1、VEGF-A/血管内皮生长因子-A、MSH3/错配修复蛋白同源物3、多种恶性肿瘤中的致病蛋白所共有的melanoma domain /黑色素瘤结构域),
与某些人类蛋白酶(如腺苷脱氨酶/ADA、血红素加氧酶/heme oxygenase),
与某些人类激素(如铁调素/Hepcidin),
与一些低等动物特有的结构元件、蛋白(如某些软体动物、节肢动物特有的血蓝蛋白/Hemocyanin,某些环节动物、节肢动物特有的巨血红蛋白/Erythrocruorin),
与某些植物特有的成分(如存在于植物质体/色素体中的多酚氧化酶),
与某些细菌毒素(如葡萄球菌肠毒素B/SEB、肉毒杆菌神经毒素/Botulinum neurotoxin),
与某些动物毒素(如眼镜蛇属和银环蛇属蛇神经毒素),
与某些医疗药剂(如肿瘤化疗的极佳药物载体Pep42),
与某些生物医学专利(如莫德纳公司February 4, 2016 Filed的一项名为“用于生产肿瘤相关蛋白质和多肽的修饰多核苷酸”的专利US 9587003),都存在离奇、惊人的结构、能力巧合!
SARS-CoV-2是广为参照、借鉴,广为模仿、植入,集众多跨物种基因、跨生物界基因、超生物基因于一身的基因工程/转基因集大成者,致病能力、致病因素集大成者;SARS-CoV-2出自长期从事病原体G-o-F(gain-of-function)研究,功能增益改造经验极其丰富,技术积淀极其深厚的资深病毒学家、实验室、研究团队之手。
SARS-CoV-2具有高度致癌性,其致癌途径异常丰富、多样。笔者之前的文章已经介绍过多种SARS-CoV-2致癌机制、途径,未来还将介绍SARS-CoV-2的其它致癌机制、途径。SARS-CoV-2的核心设计者很可能身兼资深病毒学家和资深癌症/肿瘤专家双重身份(当然,也有可能其某个团队成员是资深癌症/肿瘤专家),身兼资深病毒学家和资深癌症/肿瘤专家双重身份的科学家很容易锁定。笔者之前的文章多次聚焦这个人,或许您已经知道他是谁了。
I SARS-CoV-2对冠状病毒基因的继承、借鉴、模仿、优化、集成(续五)
在SARS-CoV-2的众多巧合对象中,有一种冠状病毒。这种冠状病毒不是SARS-CoV-2“近亲”,它与SARS-CoV-2进化距离非常遥远,基因组差异非常巨大,它的发现地,也与SARS-CoV-2的发现地远隔重洋、相距万里。然而,这两种天差地远的冠状病毒,偏偏在感染、致病的关键环节、关键位点,存在多项极低概率的,极其反常、极为离奇的结构、能力巧合,如同它们是心有灵犀的跨时空灵魂知己,又如同它们是无比默契的同门师兄弟。这种冠状病毒就是2012年9月现身于沙特的MERS-CoV(Middle East Respiratory Syndrome Coronavirus,中东呼吸综合症冠状病毒)。
本文是SARS-CoV-2与MERS-CoV结构、能力巧合的第二部分。两篇文章报告、指出的众多反常、离奇、诡异巧合铁证如山地揭示、证明:不只SARS-CoV-2来自实验室,MERS-CoV也是人造的!这两种人类严重致病冠状病毒设计思路高度一致、高度契合、一脉相承,它们极有可能出自同一团队或同一团伙之手。
上一篇文章报告、指出了SARS-CoV-2、MERS-CoV、人类腺苷脱氨酶(ADA)之间的一组DPP4(dipeptidyl peptidase IV,二肽基肽酶4 )结合、利用巧合,这组巧合包括以下四项具体巧合:
1、SARS-CoV-2 Spike、MERS-CoV Spike都具有DPP4结合能力;
2、SARS-CoV-2、MERS-CoV都能以DPP4为受体感染人体细胞;
3、SARS-CoV-2 Spike、MERS-CoV Spike、人类腺苷脱氨酶(ADA)三者在结合DPP4时锚挂的4个DPP4关键氨基酸位点相同;
4、MERS-CoV在结合DPP4时共锚挂了14个DPP4氨基酸位点,巧合的是,DPP4在人体内的结合伴侣--人类腺苷脱氨酶(ADA)在结合DPP4时也锚挂了共14个DPP4氨基酸位点;令人震惊的是,而MERS-CoV、人类腺苷脱氨酶(ADA)所锚挂的14个DPP4氨基酸位点居然完全相同、一个不差!
### 2024-03-18 补充 ###
人类DPP4共有766个氨基酸个氨基酸位点。MERS-CoV、人类腺苷脱氨酶(ADA)锚挂的14个共同的DPP4氨基酸位点,按照论文依据指出它们时的顺序依次是:1-R336、2-Q286、3-T288、4-R317、5-Q344、6-K267、7-L294、8-Y322、9-A291、10-L294 、11-I295、12-V341、13-I346、14-N229。
###### end ######!
以DPP4为感染受体,或具有DPP4结合能力的病毒(包括冠状病毒和非冠状病毒)非常罕见(蛋白结合能力是以该蛋白为感染受体的先决条件)。截止2020年,具有DPP4结合能力的病毒可能只有4种:艾滋病病毒HIV-1、扁颅蝠冠状病毒HKU4、MERS-CoV、SARS-CoV-2 。SARS-CoV-2的“近亲”病毒,同支系的众多冠状病毒(包括同支系的众多蝙蝠冠状病毒,众多其它动物冠状病毒),无一具有DPP4结合能力,更无一以DPP4为感染受体。
### 2024-03-23补充 ###
HIV-1能以gp120蛋白(HIV-1的包膜蛋白—gp160蛋白的受体结合亚基)结合DPP4,但笔者未见有论文将DPP4称为HIV-1的感染受体;HKU4适宜结合蝙蝠DPP4,对人类DPP4结合能力微弱,它只能感染蝙蝠细胞,不能感染人体细胞。因此,在大千世界不计其数的病毒(包括冠状病毒和非冠状病毒)中,能以DPP4为受体感染人体细胞的病毒可能仅有两种,就是SARS-CoV-2和MERS-CoV。
###### end ######
SARS-CoV-2是β谱系B支系(即乙型冠状病毒属Sarbe亚属)冠状病毒,MERS-CoV 是β谱系C支系(即乙型冠状病毒属Merbe亚属)冠状病毒,虽然隶属同一谱系(属),但两者基因组差异非常巨大,进化距离非常遥远。SARS-CoV-2、MERS-CoV全基因组序列(核苷酸序列)仅28%可比对(Blast比对结果中的Query Cover值为28%),可比对部分相似度为67.06%;两者Spike蛋白aa序列(amino acid sequence,氨基酸序列)76%可比对,可比对部分相似度仅为34.91%;两者Spike蛋白决定受体结合能力的RBD(receptor binding domain,受体结合域)部分的aa序列相似度同样非常之低,仅为19.1%。不可思议的是,全基因组、Spike蛋白、RBD相似度如此之低的两种病毒,不仅都能结合DPP4,不仅都能以DPP4为感染受体,而且,这两种病毒结合DPP4时锚挂的4个DPP4关键氨基酸位点,还是相同的。更匪夷所思的是,人类DPP4共有766个氨基酸个氨基酸位点,而MERS-CoV结合DPP4时锚挂的14个DPP4氨基酸位点,与人类腺苷脱氨酶(ADA)锚挂的14个DPP4氨基酸位点,竟然完全相同、一个不差!这实在是太过于巧合了!
上述巧合是随机性、无目的自然变异、自然演化的奇迹吗?笔者不这么认为。合乎情理的解释是:
SARS-CoV-2、MERS-CoV都参照、借鉴、模仿了人类腺苷脱氨酶(ADA)的DPP4结合机制。MERS-CoV完全复用了ADA的14个DPP4结合/锚挂位点,SARS-CoV-2可能作了一些变通、调整,只复用(或至少复用)了ADA14个DPP4结合/锚挂位点中的4个最关键位点。SARS-CoV-2、MERS-CoV都是来自实验室的人为设计、制造的病毒。
DPP4结合、利用巧合不是SARS-CoV-2 、MERS-CoV巧合的全部。这两种病毒还存在其它多项巧合,您将看到,这些巧合的离奇程度、匪夷所思程度,并不逊色于DPP4结合、利用巧合。
MERS-CoV (下)
S1/S2位点处氨基酸序列模式巧合
S1/S2表示冠状病毒Spike蛋白S1亚基、S2亚基的交界处。S1/S2位点是冠状病毒感染、致病能力的关键位点。
SARS-CoV-2、MERS-CoV这两种病毒全基因组、Spike蛋白、RBD的差异都非常巨大,然而,在S1/S2这一感染、致病的关键位点处,二者的氨基酸序列却反常地高度相似。如以下两图所示。

4种病毒S1/S2(箭头指示处)位点附近的氨基酸序列
配图论文来源:
The sequence at Spike S1_S2 site enables cleavage by furin and phospho-regulation in SARS-CoV2 but not in SARS-CoV1 or MERS-CoV
S1/S2位点处的序列使SARS-CoV-2 能够被furin切割和磷酸化调节,SARS-CoV-1或MERS-CoV则不然。
https://www.nature.com/articles/s41598-020-74101-0
注:SARS-CoV-1没有furin切割位点(即furin酶切位点,FCS),MERS-CoV在S1/S2处存在furin切割位点(furin切割序列为RSVR),但其切割效率远低于SARS-CoV-2 。

SARS-CoV-2、MERS-CoV S1/S2位点附近的氨基酸序列
配图论文来源:
Structures and dynamics of the novel S1_S2 protease cleavage site loop of the SARS-CoV-2 spike glycoprotein
SARS-CoV-2刺突糖蛋白新型S1/S2蛋白酶切割位点环的结构和动力学
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7534663/
如以上两图所示,SARS-CoV-2、MERS-CoV S1/S2位点左侧氨基酸序列的高度相似性体现在以下3个方面:
1)、SARS-CoV-2 S1/S2位点左侧存在“近亲”皆无的独特四氨基酸插入PRRA,非常巧合的是,MERS-CoV S1/S2位点左侧恰恰存在与PRRA对应的四氨基酸PRSV。
2)、PRRA、PRSV皆以PR(脯氨酸-精氨酸)开头,皆以非极性氨基酸结尾(A-丙氨酸、V-缬氨酸都是非极性氨基酸)。
3)、PRRA、PRSV之后同为精氨酸R,前者促成了SARS-CoV-2的furin切割序列RRAR,后者则促成了MERS-CoV的furin切割序列RSVR。SARS-CoV-2、MERS-CoV在S1/S2处都有furin酶切位点/furin切割位点(furin cleavage site,FCS)。
对比鲜明而极为反常的是,SARS-CoV-2的所有“近亲”病毒,SARS-CoV-2同支系的所有冠状病毒,无一例外,在S1/S2处全都空缺与PRRA 对应的氨基酸,无一例外,全都没有furin切割序列/furin酶切位点。如以下两图所示。
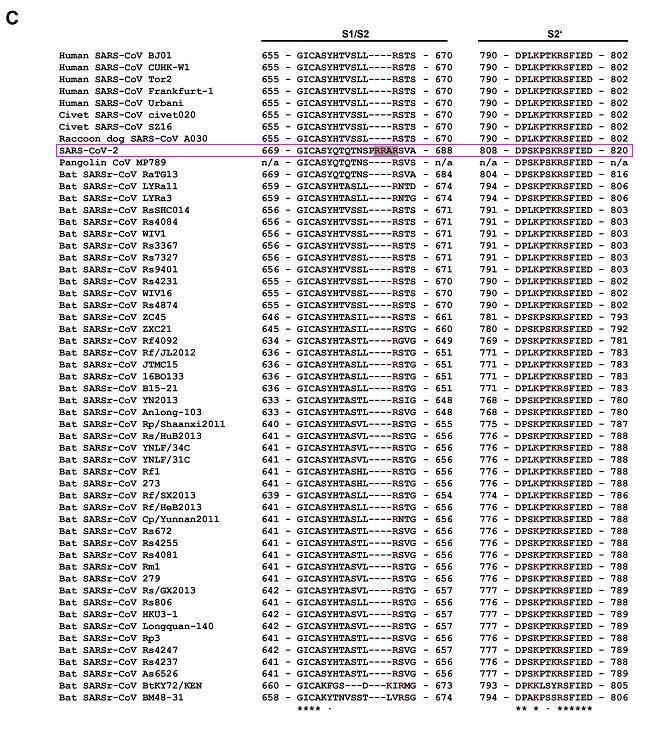
β谱系B支系部分人类、果子狸、貉、穿山甲、蝙蝠冠状病毒局部氨基酸序列比对
配图论文来源:
A Multibasic Cleavage Site in the Spike Protein of SARS-CoV-2 Is Essential for Infection of Human Lung Cells
SARS-CoV-2刺突蛋白的多碱基切割位点对感染人肺细胞至关重要
https://www.cell.com/molecular-cell/fulltext/S1097-2765(20)30264-1
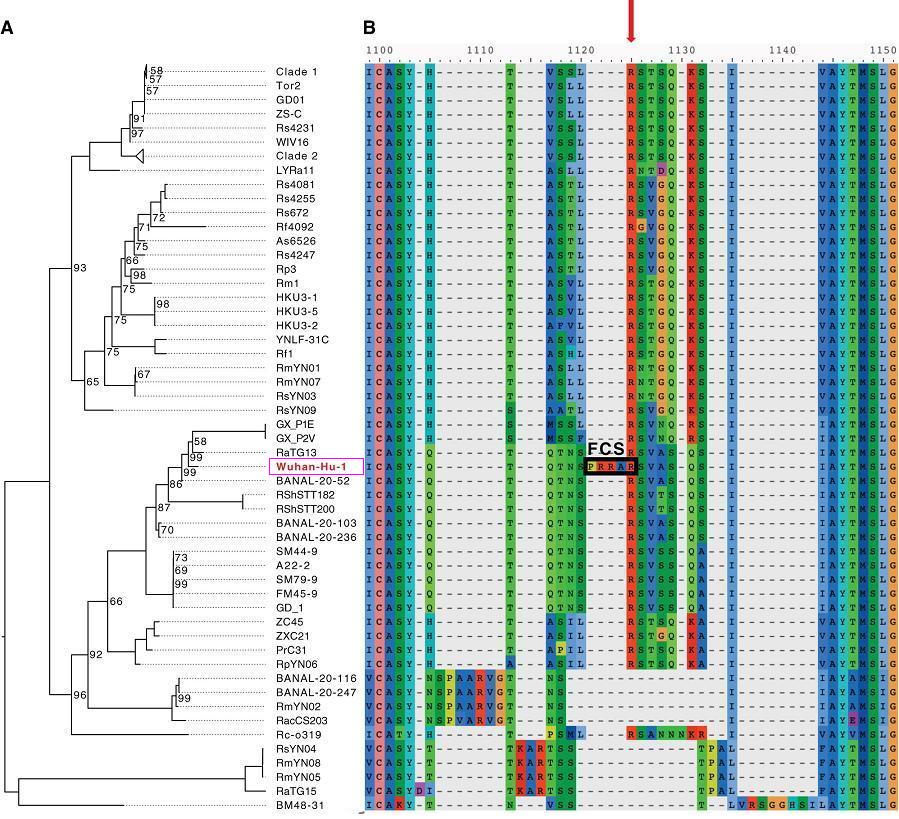
SARS-CoV-2(Wuhan-Hu-1毒株)与进化树中冠状病毒S1/S2位点附近的aa序列比对
配图论文来源:
Emergence of the Spike Furin Cleavage Site in SARS-CoV-2
SARS-CoV-2中刺突弗林切割位点的出现
https://academic.oup.com/mbe/advance-article/doi/10.1093/molbev/msab327/6426085
由以上两图可见,SARS-CoV-2 S1/S2位点左侧独特的PRRA插入在图中极为醒目、突兀,两图中的其它病毒全都空缺与PRRA对应的氨基酸。
事实上,
1)、SARS-CoV-2 是β谱系B支系(乙型冠状病毒属Sarbe亚属)唯一具有furin 酶切位点的冠状病毒;
2)、所有Spike与SARS-CoV-2 spike同源性(相似度)大于40%的冠状病毒都不具有furin 切割位点(当然更不具有S1/S2处的furin切割位点或furin切割序列)。
第1点是众所周知的事实,第2点的论文依据是:
Furin: A Potential Therapeutic Target for COVID-19
弗林:COVID-19的潜在治疗靶点
https://www.cell.com/iscience/fulltext/S2589-0042(20)30834-8
论文原文:
We
performed furin digestion site prediction on the sequence of each type
of coronavirus Spike through online software. It was found that all
Spike with a SARS-CoV-2 Spike sequence homology greater than 40% did not
possess a furin cleavage site (Figure 1, Table 1), including Bat-CoV
RaTG13 and SARS-CoV (with sequence identity as 97.4% and 78.6%,
respectively). The furin cleavage site “RRAR” of SARS-CoV-2 is unique in
its family, rendering by its unique insert of “PRRA.” The furin
cleavage site of SARS-CoV-2 is unlikely to have evolved from MERS,
HCoV-HKU1, and so on. From the currently available sequences in
databases, it is difficult for us to find the source.
We aligned
1,000 Spike sequences and found that all Spikes with sequence homology
greater than 40% of SARS-CoV-2 Spike did not have a furin cleavage site,
but its possible evolutionary source cannot be found currently, and
more novel viruses are needed to be discovered.
本小节指出的巧合远不是SARS-CoV-2、MERS-CoV最反常、最不可思议的巧合。我们接着往下看。
P5位点脯氨酸巧合
SARS-CoV-2、MERS-CoV furin切割序列P5位点皆为脯氨酸(P)。无比神奇、极度不可思之处在于,在大千世界难计其数的大量病毒(包括冠状病毒、非冠状病毒)中,具有furin切割位点,且furin切割序列P5位点为脯氨酸(P)的病毒仅有两种,这两种病毒恰巧就是SARS-CoV-2、MERS-CoV。
基本furin切割序列(也叫最小furin切割序列)“RXXR”(如RRAR、RSVR)的四个氨基酸位点从右至左依次被称为P1位点、P2位点、P3位点、P4位点,P4位点左侧紧邻的氨基酸位点称为P5位点,P5位点就是“RXXR”左侧的第一个氨基酸位点。下图示范了这种标记方式:
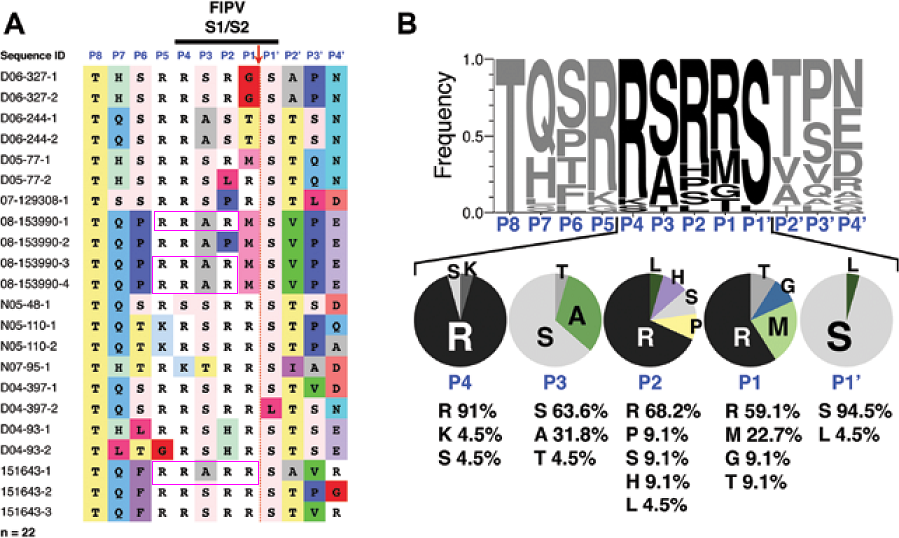
某些FIPV病毒株S1/S2处的RRARR、RRAR切割序列
说明一下,PRRA、PRSV中的P表示脯氨酸(proline,P),P1、P2、P3、P4、P5中的P则表示位点(position),同为字母P,含义并不相同。

SARS-CoV-2 、MERS-CoV furin切割序列P5位点皆为脯氨酸(P)
如上图所示,SARS-CoV-2基本furin切割序列RRAR,MERS-CoV基本furin切割序列RSVR左侧的第一个氨基酸位点,也就是P5位点的氨基酸皆为脯氨酸(P)。
furin切割序列P5位点为脯氨酸(P)的病毒仅有两种,这两种病毒就是SARS-CoV-2、MERS-CoV,除了SARS-CoV-2、MERS-CoV,再没有其它P5位点为脯氨酸(P)的病毒了!
这一惊人事实的论文依据是:
Structures and dynamics of the novel S1_S2 protease cleavage site loop of the SARS-CoV-2 spike glycoprotein
SARS-CoV-2刺突糖蛋白新型S1_S2蛋白酶切割位点环的结构和动力学
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7534663/
论文由瑞士苏黎世DS3Lab的Thomas Lemmin等人发表。
论文原文:
From a structural point of view, the SARS-CoV-2 S protein proline residue (P681; Figs. 1d and 3c) in the insertion is eye-catching, because of the special and unique structural properties of this proteinogenic amino (imino) acid. MERS-CoV S protein is one of the other rare CoV spike proteins, that also contains a proline residue at the corresponding position in the S1/S2 protease cleavage site (Fig. 1e). When searching the database FurinDB (Tian et al., 2011) (http://www.nuolan.net/substrates.html), which includes experimentally verified furin cleavage sites, it appears that a proline residue at position P5, i.e., the 5th residue prior to the furin cleavage site, is rare and appears in only 5 out of 132 sequences (three mammalian and two viral sequences).
如论文所述,P5位点为脯氨酸的furin切割序列很罕见,在FurinDB 数据库中的132个序列中,仅有5个序列P5位点为脯氨酸。这5个P5位点为脯氨酸的furin切割序列3个是哺乳动物序列,2个是病毒序列,2个病毒序列一个来自SARS-CoV-2,另一个来自MERS-CoV。
furin切割序列P5位点为脯氨酸的病毒仅有两种,这两种病毒恰恰就是2012年9月出现的MERS-CoV和2019年11、12月出现的SARS-CoV-2。这实在于太过于巧合、太过于诡异、太过于幽默了!这又是无目的、随机性自然变异、自然演化的神迹吗?
为什么SARS-CoV-2、MERS-CoV furin切割序列的P5位点都要使用脯氨酸(P)呢?这个设计颇有深意,P5位点的脯氨酸对于感染、致病能力(可能)有以下多重作用:
1)、与P6位点的丝氨酸(S)或苏氨酸(T)构成脯氨酸定向激酶作用基序和磷酸化位点,通过干预、改变人体正常的磷酸化,扰乱、破坏正常生理过程,导致种种疾病。病毒还可通过磷酸化有关蛋白质使细胞处于有利于病毒复制、病毒生存的周期阶段。详情见下一巧合;
2)、脯氨酸有特殊的构象刚性,可将furin切割序列对应的多肽与Spike蛋白的其他结构元件分开,使前者更好地暴露于furin(等)蛋白酶,提升Spike蛋白切割、激活的效率,进而提升感染效率;
3)、脯氨酸产生的转角预计(可能未得到确认)会导致PRRA插入两侧的2个丝氨酸(S673、S686)、1个苏氨基酸(T678 )形成O-连接聚糖(O-linked glycans),O-Linked聚糖能与人体细胞表面的某些蛋白质相互作用,形成一个可逃避免疫打击的糖链屏障,是SARS-CoV-2众多可能的免疫逃避/免疫屏蔽途径之一。
2)、3)两点都是刚刚提到的Thomas Lemmin等人的论文所指出的。
4)、P5位点的脯氨酸还可能有助于调节Spike蛋白及病毒包膜的融合前构象,降低膜融合的能量门槛,使病毒包膜与细胞膜更容易发生膜融合,使病毒的感染(即细胞进入)更便捷、高效。这一推测基于英法两国科学家1 December 1998发表的以下论文:
A
Proline-Rich Motif Downstream of the Receptor Binding Domain Modulates
Conformation and Fusogenicity of Murine Retroviral Envelopes
受体结合域下游富含脯氨酸的基序调节鼠逆转录病毒包膜的构象和融合性
https://journals.asm.org/doi/10.1128/jvi.72.12.9955-9965.1998
P6、P5位点脯氨酸定向激酶作用基序巧合
SARS-CoV-2、MERS-CoV furin切割序列P6、P5位点恰好分别使用了脯氨酸定向激酶的两个作用基序(SP、TP)。furin切割序列P6、P5位点使用脯氨酸定向激酶作用基序的病毒依然仅有两种,还是SARS-CoV-2、MERS-CoV!
脯氨酸定向激酶(proline-directed kinases)有两个二元(双氨基酸)作用基序:SP、TP。SARS-CoV-2的furin切割序列RRAR P6位点的丝氨酸S、P5位点的脯氨酸P组成的双氨基酸短序列SP(丝氨酸-脯氨酸)恰好是两个二元作用基序之一;而MERS-CoV的对应位点恰好使用了脯氨酸定向激酶的另一个二元作用基序TP(苏氨酸-脯氨酸,P11、P10位点存在另一个TP基序)。如下图所示。

MERS-CoV、SARS-CoV-2 P6、P5位点的脯氨酸定向激酶作用基序TP、SP
论文依据:
The sequence at Spike S1_S2 site enables cleavage by furin and phospho-regulation in SARS-CoV2 but not in SARS-CoV1 or MERS-CoV
https://www.nature.com/articles/s41598-020-74101-0
论文原文:
Further, we describe a surprising finding that the two serines at the edges of the insert SPRRAR↓SV can be efficiently phosphorylated by proline-directed and basophilic protein kinases. Both phosphorylations switch off furin’s ability to cleave the site.
Intriguingly, besides the RxxR motif, the sequence of the loop SPRRAR↓SV contains two serines that match the consensus of proline-directed kinases (SP), and basophilic protein kinases (RxxS), the two largest subfamilies of mammalian kinases21,22.
Spike S680 matches the consensus of proline-directed kinases (SP) and S686 forms a consensus for basophilic kinases (RxxS), two large subfamilies of mammalian kinases21,22.
The SARS-CoV1 S1/S2 segment does not contain a consensus site for proline-directed kinases, and while the MERS-CoV segment contains two potential proline-directed TP sites,
读及此处,您是否和笔者一样震惊、叹服:远隔重洋、相距万里、差异巨大、进化距离遥不可及的SARS-CoV-2、MERS-CoV,是何等的默契!是何等的心心相印、心有灵犀!
由于furin切割序列P5位点为脯氨酸(P)的病毒仅有两种,因此,P6、P5位点为脯氨酸定向激酶作用基序(SP、TP)的病毒同样仅有两种,依然是MERS-CoV、SARS-CoV-2。
为什么MERS-CoV、SARS-CoV-2要使用脯氨酸定向激酶作用基序?因为脯氨酸定向激酶作用基序(SP、TP)中的丝氨酸S或苏氨酸T可被脯氨酸定向激酶磷酸化。病毒可通过磷酸化基序干预、改变人体自身的磷酸化机制,扰乱、破坏正常的生理过程,制造各种疾病;病毒还可通过磷酸化有关蛋白质使细胞处于有利于病毒复制、病毒生存的周期阶段。磷酸化(Phosphorylation),指在蛋白质的丝氨酸-S或苏氨酸-T或酪氨酸-Y(残基)上加入一个磷酸基团。
哺乳动物激酶家族两个最大的亚家族(子家族),一是脯氨酸定向激酶(proline-directed kinases),二是嗜碱性蛋白激酶(basophilic kinases)。
MERS-CoV在S1/S2位点附近只使用了脯氨酸定向激酶的磷酸化作用基序(如前图所示,两次使用了相同的TP基序);
SARS-CoV-2在S1/S2位点附近同时使用了两种激酶的磷酸化作用基序。SARS-CoV-2 S1/S2处的长furin切割序列RRAR'SVAS中的第2至第5氨基酸RARS还符合嗜碱性激酶发挥作用的RXXS 基序模式,RARS中的丝氨酸S可被嗜碱性激酶有效磷酸化。
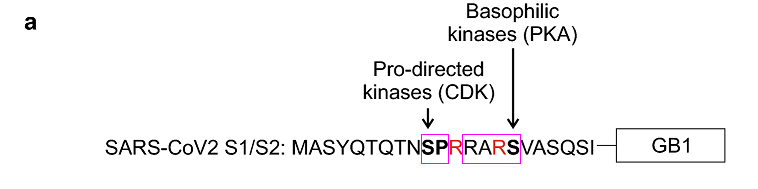 SARS-CoV-2 S1/S2位点附近的的脯氨酸定向激酶作用基序SP及嗜碱性激酶作用基序RARS
SARS-CoV-2 S1/S2位点附近的的脯氨酸定向激酶作用基序SP及嗜碱性激酶作用基序RARS
此配图摘自刚刚提到的论文。
SARS-CoV-2 Spike蛋白上有十几个磷酸化位点(phosphorylation sites),在其N、M、S(Spike)、nsp3a、nsp9b等蛋白中共有约 70个磷酸化位点。SARS-CoV-2感染会强力干预、改变人体自身正常的磷酸化机制,导致宿主蛋白显著、严重的磷酸化改变,并显著增加某些生理过程(如碳代谢,carbon metabolism)中的磷酸化,SARS-CoV-2感染会导致人体增加2000 多种磷酸肽,在SARS-CoV-2感染的细胞中观察到超过15,000个宿主磷酸化位点。SARS-CoV-2感染还会改变(上调或下调)参与磷酸化的多种激酶的活性,并通过磷酸化与信号传导和细胞周期有关的蛋白质,来干预、劫持宿主信号通路、信号传导,阻滞/停滞细胞周期,使细胞处于有利于病毒复制、病毒生存的周期阶段。
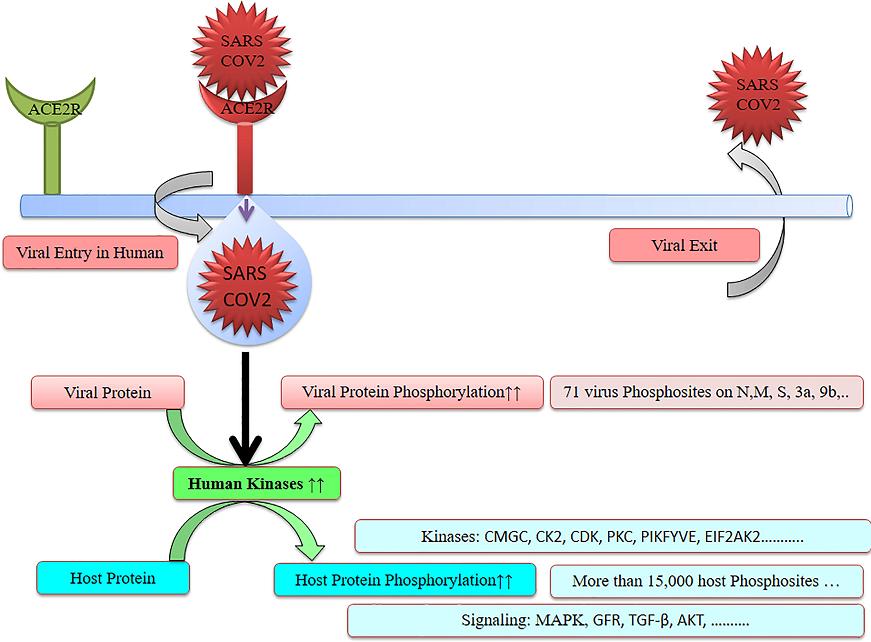
Figure 1 SARS-CoV-2 causes heavy phosphorylation
蛋白质磷酸化异常,包括磷酸化途径的改变会导致多种严重疾病,尤其是癌症。靶向磷酸化途径的药物代表了癌症治疗的有希望的领域。笔者已多次指出,SARS-CoV-2具有高度致癌性,SARS-CoV-2的致癌途径异常丰富。其它与磷酸化异常有关的疾病包括糖尿病、心血管疾病、阿尔茨海默症(Alzheimer's disease)、炎症性疾病等等。
参考论文:
SARS-CoV-2 Infection Triggers Phosphorylation: Potential Target for Anti-COVID-19 Therapeutics
SARS-CoV-2感染触发磷酸化:抗COVID-19治疗的潜在靶点
https://www.frontiersin.org/articles/10.3389/fimmu.2022.829474/full
SARS-CoV-2、MERS-CoV,这两种病毒基因组差异非常巨大,进化距离非常遥远,但在结合、利用DPP4这一细胞感染的关键环节上,它们却出奇地一致。它们都能结合DPP4,都能以DPP4为受体感染人体细胞(如前文所述,能结合DPP4或以DPP4为感染受体的病毒非常罕见,仅有约4种),它们在结合DPP4时锚挂的4个DPP4关键氨基酸位点相同,而MERS-CoV锚挂的所有14个DPP4氨基酸位点更是与人类腺苷脱氨酶(ADA)完全相同、一个不差!极为反常、对比极为鲜明的是,SARS-CoV-2的所有“近亲”病毒,SARS-CoV-2同支系的所有冠状病毒,无一例外,全都不能结合DPP4,全都不能以DPP4为感染受体。另外,以DPP4为感染受体,或具有DPP4结合能力的病毒非常罕见,可能只有4种(截止2020年),能以DPP4为受体感染人体细胞的病毒可能仅有两种,就是SARS-CoV-2和MERS-CoV;
这两种病毒基因组差异非常巨大,进化关系非常遥远,但在S1/S2这一感染、致病的关键位点处,它们的氨基酸序列却高度相似、高度匹配,它们在这一位点处都具有furin酶切位点(FCS)。极为反常、对比极为鲜明的是,SARS-CoV-2的所有“近亲”病毒,SARS-CoV-2同支系的所有冠状病毒,在S1/S2处,全都与SARS-CoV-2差异显著,它们无一例外,全都存在显著的4氨基酸空缺,它们无一例外,全都没有furin酶切位点;
这两种基因组差异非常巨大,进化距离非常遥远的病毒,它们furin切割序列P5位点的氨基酸同为脯氨酸(proline,P)。极为反常、极其不可思议的是,在难计其数的冠状病毒、非冠状病毒中,具有furin切割位点,且furin切割序列P5位点为脯氨基酸的病毒仅有两种,它们恰巧、偏偏就是SARS-CoV-2和MERS-CoV;
这两种基因组差异非常巨大,进化距离非常遥远的病毒,它们furin切割序列P6、P5位点都使用了脯氨酸定向激酶基序并形成磷酸化位点。脯氨酸定向激酶有两个二元作用基序(SP、TP),SARS-CoV-2、MERS-CoV恰巧各使用了一种(SARS-CoV-2使用了SP,MERS-CoV使用了TP);furin切割序列P6、P5位点使用脯氨酸定向激酶基序的病毒也只有两种,它们依然是SARS-CoV-2、MERS-CoV。
如此之多极低概率的巧合,如此之多极为离奇、极为诡异、极度不可思议的巧合,不是随机性、无目的自然变异、自然演化所能解释、敷衍的,它们铁证如山地揭示、证明:SARS-CoV-2、MERS-CoV都是人为设计、制造的实验室病毒;这两种病毒的设计思路高度一致、高度契合、一脉相承,它们极有可能出自同一实验室、同一团队或同一团伙之手。
(未完待续)













 SARS-CoV-2 S1/S2位点附近的的脯氨酸定向激酶作用基序SP及嗜碱性激酶作用基序RARS
SARS-CoV-2 S1/S2位点附近的的脯氨酸定向激酶作用基序SP及嗜碱性激酶作用基序RARS