接續:“萬能”受體適配器--新冠S蛋白 2
SARS-CoV-2的S(Spike,刺突)蛋白不只是達成感染(進入細胞)的工具、鑰匙。SARS-CoV-2的S蛋白,包括疫苗中嵌入的SARS-CoV-2 S蛋白,或疫苗編碼產生的SARS-CoV-2 S蛋白,具有多方面的毒性(致病能力)。比如,SARS-CoV-2的S蛋白可引發凝血障礙和血栓,再比如,SARS-CoV-2的S蛋白可導致鐵代謝失調、紊亂,引發鐵毒性(游離鐵過量)、紅細胞生成紊亂(產生無效的紅細胞)等等一系列鐵代謝失調、紊亂後果。
S蛋白自身具有毒性,這在冠狀病毒中可能前所未見,因而,在疫苗設計、研發、大力推廣中,SARS-CoV-2 S蛋白的毒性被廣泛忽視;新冠疫苗(促發正常免疫反應之外)的致病、致殘、致死表現及“副作用”,可能本質上就源自SARS-CoV-2 S蛋白的毒性(可能同時存在其它材質原因)。近幾個月幾乎聽不到宣傳、強調疫苗接種的聲音了,2023年還多次報出各國大量銷毀疫苗的消息。為什麼大量銷毀疫苗?為什麼許多國家都出現了天量疫苗過期的事情?這是巧合嗎?各國銷毀天量疫苗,真的是因為過期?什麼樣的問題應對、處理方式,有利於公眾,有利於未來?是直面問題、開放討論、公開檢討反思,還是迴避、冷處理、瞞天過海、矇混過關?有些科學、學術問題不只是單純的科學、學術問題,這樣的問題似乎越來越多了。
SARS-CoV-2 S蛋白多重毒性的內在原因,是它擁有史無前例的廣泛的人體因子結合能力,以及對人體因子的影響、干預、改變、模仿等能力。
SARS-CoV-2能夠結合的人體因子/宿主因子之多,令其它所有病毒望塵莫及。已論文報告的,SARS-2 S蛋白可結合的人類跨膜受體蛋白超過三十種(加上本文的轉鐵蛋白受體,筆者目前僅介紹了其中的7種);SARS-2 S蛋白還能結合眾多非跨膜存在的,不作為感染受體的人體蛋白、多肽、激素;SARS-CoV-2還能通過S蛋白之外的其它蛋白結合人體因子。
還有大量被SARS-CoV-2影響、干預、改變、模仿的人體因子(這些人體因子與SARS-CoV-2的可結合人體因子部分重合)。SARS-CoV-2甚至赤裸裸地抄襲、復用人類關鍵基因片斷,例如,SARS-CoV-2抄襲了人類ENaC-α(上皮鈉離子通道的α亞基)的長furin切割序列(八氨基酸序列RRAR'SVAS),將其作為S蛋白關鍵位點S1/S2處的furin切割序列,並以此模仿ENaC的酶切水解激活。
SARS-CoV-2 S蛋白、其它蛋白對眾多人體因子的結合、利用、競爭、消耗,對眾多人體因子的影響、干預,對部分人體因子的功能改變、結構借鑑、功能模仿,不同程度地干擾、抑制、破壞人體的正常機能,引發不勝枚舉的病理後果。
由上一篇文章可知,SARS-CoV-2 S蛋白能夠結合兩種人體抗凝血因子,硫酸乙酰肝素(HS)和肝素(HP),其中HS(及HSPG)可在細胞表面跨膜存在,作為ACE2的輔助受體促進SARS-CoV-2感染。
本文將說明,SARS-CoV-2的S蛋白能夠結合轉鐵蛋白受體(transferrin receptor,TfR),並通過結合TfR達成感染(進入細胞),TfR是獨立於ACE2的SARS-CoV-2感染受體;SARS-CoV-2還能改變轉鐵蛋白(transferrin,Tf,轉鐵蛋白受體的鐵代謝搭檔)的熱力學性質,降低它的熱穩定性,抑制其鐵攝取能力。
下一篇文章將說明,SARS-CoV-2的S蛋白能夠結合人類鐵調素(Hepcidin);並且,SARS-CoV-2 S蛋白的尾部區域與人類鐵調素氨基酸序列相似,S蛋白在人體內降解後釋放出的這一尾部片斷可能能夠模仿鐵調素的分子作用和生理功能--結合鐵轉運蛋白(ferroportin,FP),促使其降解,進而抑制細胞鐵吸收、鐵釋放,降低血液中的循環鐵。轉鐵蛋白(Tf)、轉鐵蛋白受體(TfR)、鐵調素、鐵轉運蛋白(FP)是人類和哺乳動物的關鍵鐵代謝因子,對它們的結合、改變、模仿、降解將干擾人體鐵轉運、鐵代謝,破壞鐵穩態,引發鐵代謝失調、紊亂。下一篇文章或後續文章將指出,SARS-CoV-2的S蛋白還能結合血紅蛋白(hemoglobin,Hb)、肌紅蛋白(myoglobin,Mb)、乳鐵蛋白(lactoferrin ,Lf)等其它鐵代謝因子(不過,與乳鐵蛋白Lf的結合可能對SARS-CoV-2感染、致病起負作用)。
SARS-CoV-2還使用S蛋白外的其它結構蛋白,以及非結構蛋白結合、干擾、攻擊人體鐵代謝因子,比如,SARS-CoV-2的三種非結構蛋白orf1ab、ORF3a、ORF10可協同結合、攻擊血紅蛋白1-β鏈上的血紅素(Heme),使血紅蛋白與鐵離子解離(鐵離子成為游離鐵),破壞鐵代謝,同時干擾血紅素的合成代謝途徑。
SARS-CoV-2引發的鐵代謝失調/紊亂對人體的影響廣泛而深遠,已論文報告的SARS-CoV-2相關的鐵代謝疾病或症狀包括:鐵毒性(血液、其它組織液或細胞中未與轉鐵蛋白、血紅蛋白、鐵蛋白-ferritin等鐵代謝蛋白結合的游離鐵過量)、紅細胞生成紊亂(產生大量無效的紅細胞)、鐵缺乏症、細胞鐵死亡、免疫力低下或受損、高凝血症、功能障礙性血紅蛋白病等等,SARS-CoV-2引起的鐵代謝失調、紊亂還可能引發多器官併發症,導致多器官功能障礙。
SARS-2相關的鐵代謝失調/紊亂也能引發凝血障礙,一個關聯因素是,被SARS-2 S蛋白干擾、改變的轉鐵蛋白(Tf)既是關鍵的鐵代謝因子,又是一種促凝血劑。老年人、男性SARS-CoV-2感染重症風險更高,也與鐵代謝失調/紊亂關係密切。老年人和男性體內的轉鐵蛋白(Tf)水平高於其它人群,因而這兩類人群體內的轉鐵蛋白與抗凝血酶(antithrombin)比值高於其它人群(抗凝血酶水平不受年齡或性別影響),老年男性感染SARS-CoV-2的重症風險最高,很可能與老年男性是轉鐵蛋白/抗凝血酶比值最高人群有關。
SARS-CoV-2對人體鐵代謝多方位、系統化的干預、干擾、破壞能力,是在動物宿主體內隨機、無目的自然演化偶然產生的嗎?SARS-CoV-2是自然產物,還是出自科技狂魔之手的包羅萬象的轉基因“傑作”巨製?
7、transferrin receptor(轉鐵蛋白受體)
先說Transferrin。
Transferrin(縮寫為Tf或Trf),轉鐵蛋白,也叫運鐵蛋白,是一種單鏈糖蛋白。轉鐵蛋白是脊椎動物鐵轉運、鐵代謝的關鍵蛋白,它能緊密結合血清中的游離鐵(包括消化系統吸收的鐵和紅細胞降解釋放的鐵),並將其轉運至機體各處的細胞。轉鐵蛋白有兩個鐵離子結合位,每個結合位可以結合一個三價鐵離子(Fe3+)。未結合鐵離子的轉鐵蛋白稱為脫鐵轉鐵蛋白或原轉鐵蛋白(apo-transferrin,apo-Tf),與鐵離子結合的轉鐵蛋白稱為飽和轉鐵蛋白或全轉鐵蛋白(holo-transferrin,holo-Tf)。轉鐵蛋白轉運的鐵離子是(絕)大多數細胞各個代謝環節所必需的;轉鐵蛋白運至骨髓的鐵離子用於合成血紅蛋白,生成成熟的紅細胞。轉鐵蛋白主要由肝臟產生,睾丸、大腦、脾臟和腎臟也會產生少量轉鐵蛋白。轉鐵蛋白也是一種促凝血劑。
再說transferrin receptor。
transferrin receptor(縮寫為TfR),轉鐵蛋白受體,一種跨膜糖蛋白,細胞鐵攝取的門衛。顧名思義,它就是轉鐵蛋白的受體蛋白、結合蛋白,一個轉鐵蛋白受體(TfR)可結合兩個轉鐵蛋白(Tf),並且它更適於結合已結合鐵離子的轉鐵蛋白,即Holo-Tf(TfR與Holo-Tf的結合親和力強於其與apo-Tf的結合親和力)。轉鐵蛋白受體(TfR)、轉鐵蛋白(Tf)是鐵轉運、鐵代謝的一對關鍵拍檔,轉鐵蛋白受體(TfR)負責在細胞膜表面結合轉鐵蛋白(Tf),並介導轉鐵蛋白進入細胞,使細胞得以攝取轉鐵蛋白所攜帶的鐵離子。簡而言之,轉鐵蛋白(Tf)負責轉運鐵,而轉鐵蛋白受體(TfR)負責為細胞接收鐵、攝入鐵。
轉鐵蛋白受體有兩種類型(亞型):TfR1、TfR2,二者結構相似。TfR1也叫CD71(分化簇71),它以不同水平在絕大多數細胞的細胞膜上普遍表達,結合轉鐵蛋白(Tf),為細胞攝入鐵的就是TfR1;TfR2則專門在肝細胞、紅細胞中表達,通過與轉鐵蛋白(Tf)結合為肝細胞攝入鐵,同時作為鐵傳感器調節蛋白質活性,以響應細胞氧化還原平衡。TfR1還因為在惡性細胞(癌細胞)細胞膜上的表達水平普遍較高而被廣泛用作癌症治療的靶標。
轉鐵蛋白(Tf)、轉鐵蛋白受體(TfR)還都是免疫系統的重要調控、參與因子。巨噬細胞和T淋巴細胞中的轉鐵蛋白(Tf)對早期T淋巴細胞分化至關重要;而轉鐵蛋白受體(TfR)則對T淋巴細胞的DNA合成和細胞分裂至關重要。
已論文報告的以TfR/TfR1為感染受體或細胞進入因子的病毒有:丙型肝炎病毒(hepatitis C virus,HCV,屬於黃病毒科肝炎病毒屬)、傳染性胃腸炎病毒(Transmissible gastroenteritis virus ,TGEV,屬於冠狀病毒科)、狂犬病病毒(Rabies Virus,RABV,屬於彈狀病毒科)、犬細小病毒(canine parvovirus,CPV,屬於細小病毒科)、新大陸出血性沙粒病毒(New World arenaviruses,屬於沙粒病毒科)、甲型流感病毒(Influenza A virus ,IAV,屬於正黏液病毒科)等。
SARS-CoV-2 S蛋白能以高親和力結合轉鐵蛋白受體(TfR/TfR1),並通過結合TfR/TfR1進入細胞;SARS-CoV-2 S蛋白可能干擾轉鐵蛋白(Tf)與轉鐵蛋白受體(TfR)的結合,及Tf的內化(S蛋白頂替Tf被TfR介導至細胞內),從而干擾細胞的鐵攝取;SARS-CoV-2還可改變轉鐵蛋白(Tf)的熱力學性質,降低其熱穩定性,抑制其鐵結合、鐵轉運能力,破壞細胞的鐵攝取來源;
TfR/TfR1是獨立於ACE2的SARS-CoV-2感染受體,它對SARS-CoV-2感染的介導不依賴ACE2。
TfR1也是RABV(Rabies Virus,狂犬病病毒)的感染受體;SARS-CoV-2和RABV還都可結合神經元AChR/nAChR受體(乙酰膽鹼受體/煙鹼型乙酰膽鹼受體),這二種病毒都具有神經毒性,並且,SARS-CoV-2 S蛋白決定nAChR結合能力的基因片斷與RABV G蛋白的對應基因片斷存在序列相似性;此外,RABV的另一種感染受體mGluR2(代謝型穀氨酸受體亞型2,也是一種神經元受體)是SARS-CoV-2的重要內化因子。也就是說,SARS-CoV-2與RABV有3種共同的感染受體或細胞進入因子TfR1、nAChR、mGluR2,二者結合nAChR的序列片斷相似,二者都具有神經毒性。SARS-CoV-2可能借鑑了RABV的感染、致病進入機制,並參照了RABV結合nAChR的序列/多肽結構。RABV約有5種已知的感染受體,它屬於彈狀病毒科,不是冠狀病毒。
SARS-CoV-2可能是已知的,僅有的兩種以TfR/TfR1為感染受體的冠狀病毒之一,另外一種是TGEV(Transmissible gastroenteritis virus ,傳染性胃腸炎病毒),2018年的一篇論文報告說,TfR1是TGEV的輔助受體(非獨立受體)。TGEV的宿主/感染對象不是人類,而是豬(傳染性胃腸炎病毒就是豬傳染性胃腸炎病毒)。SARS-CoV-2屬於冠狀病毒β譜系,TGEV屬於冠狀病毒α譜系,二者親緣關係極遠。
此次疫情前,可能沒有論文報告過,某種可結合TfR/TfR1的病毒能夠(顯著)干預宿主鐵代謝。
### 2023_09_08 更正 ###
最末一句判斷有誤,最近注意到一些HCV(hepatitis C virus,丙型肝炎病毒)影響鐵代謝的過往論文。
###
論文依據一
Transferrin receptor is another receptor for SARS-CoV-2 entry
轉鐵蛋白受體是SARS-CoV-2進入的另一種受體
https://www.biorxiv.org/content/10.1101/2020.10.23.350348v1
論文要點如下:
a)TfR(轉鐵蛋白受體)與SARS-CoV-2 S蛋白以高親和力結合;
b)TfR與SARS-CoV-2 S蛋白相互作用、結合併介導病毒進入細胞;
c)敲除細胞中的ACE2並不能完全阻止SARS-CoV-2進入細胞(TfR對SARS-CoV-2感染的介導獨立於ACE2);
d)在細胞膜上和細胞質中均發現了TfR與SARS-CoV-2 S蛋白的共定位(即發現、鑑定了二者結合形成的複合物),表明SARS-2通過TfR在細胞膜和細胞質之間進行轉運;
e)干擾TfR-Spike相互作用(、結合)可阻止SARS-CoV-2進入細胞;
f)SARS-CoV-2可以感染表達hTfR(human TfR,人類轉鐵蛋白受體),且不表達hACE2(human ACE2)的人源化轉基因小鼠(再次表明hTfR是獨立於hACE2的SARS-CoV-2感染受體);
g)anti-TfR抗體對表達hTfR的人源化小鼠顯示出良好的抗SARS-CoV-2(感染、複製)效果。
更具體地,論文指出:
1、qRT-PCR檢測和蛋白質印跡(western blot)檢測表明,TfR(蛋白及其RNA基因)在鼻腔、氣管、肺、肝臟等多種組織中表達,在肺和氣管中表達水平較高(圖A、B、C);
免疫組織化學分析(Immunohistochemical analysis)顯示,被SARS-CoV-2感染的猴子和hACE2小鼠(hACE2 mice)肺組織中的TfR表達水平上調(升高)(圖D、E)。
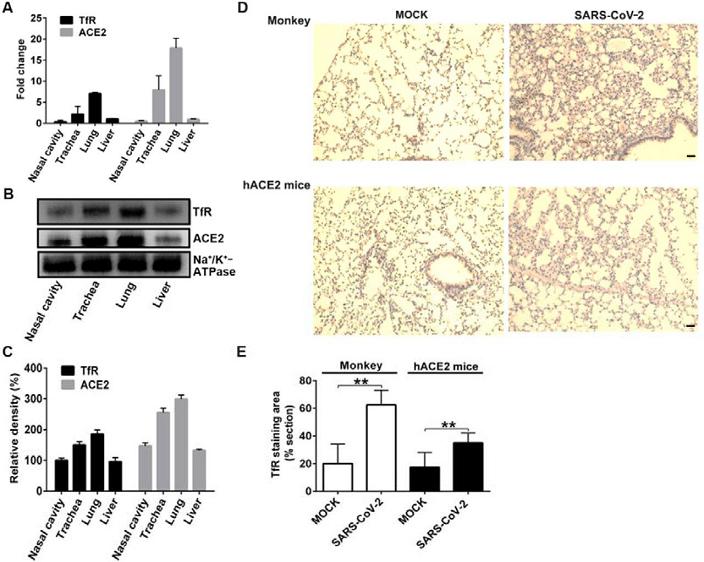
TfR的多組織表達;SARS-CoV-2感染上調猴子、hACE2小鼠肺組織中的TfR表達水平。
圖D中,肺組織的細胞核用蘇木精(hematoxylin)染成藍色,棕色細胞為TfR陽性細胞,MOCK為未使用SARS-CoV-2感染的對照組織。用SARS-CoV-2感染後,兩種動物肺組織的棕色加深,表明TfR的表達水平升高。
該研究使用了hTfR小鼠和hACE2小鼠兩種人源化轉基因小鼠,hACE2小鼠將mACE2替換為hACE2,hTfR小鼠則將mTfR替換為hTfR。SARS-CoV-2對普通小鼠的感染、致病能力微弱,它的S蛋白不易結合mACE2、mTfR。
2、ELISA測定和SPR分析表明,完整的SARS-CoV-2 S(Spike)蛋白或S中的RBD都可與TfR直接作用、結合。SARS-2 S蛋白與TfR的結合親和力,稍弱於其與ACE2的結合親和力;完整S蛋白的TfR結合親和力,比S-RBD的TfR結合親和力高大約15倍,這表明,S蛋白RBD之外的區域也與TfR發生作用。
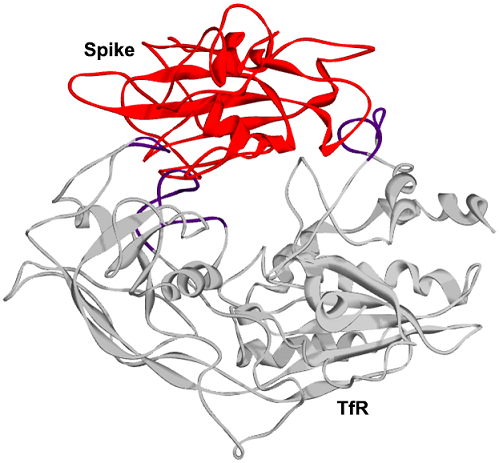
SARS-2 S(紅色)、TfR(灰色)複合體的3D結構
ELISA:enzyme-linked immunosorbent assay,酶聯免疫吸附測定;
SPR:Surface plasmon resonance,表面等離子共振。
3、SPR及PAGE分析表明,TfR也可直接與ACE2相互作用、結合,SARS-2 S、TfR、ACE2三者可結合形成三元複合物。
PAGE,polyacrylamide gel electrophoresis,聚丙烯酰胺凝膠電泳,以聚丙烯酰胺凝膠作為支持介質的一種常用電泳技術,用於分離不同的蛋白質(或多肽、寡核苷酸)。
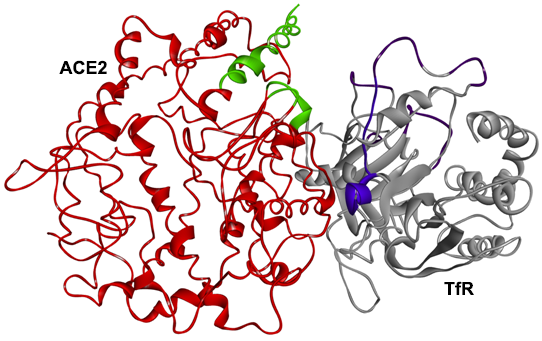
TfR(灰色)、ACE2(紅色)複合體的3D結構
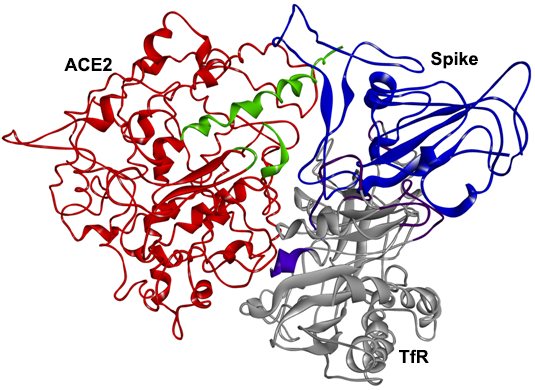
TfR(灰色)、ACE2(紅色)、SARS-2 S(藍色)複合體的3D結構
4、一種(該研究)設計的多肽SL8(SKVEKLTL)可同時干擾TfR-ACE2和TfR-Spike相互作用,干擾TfR-ACE2-Spike三元複合體的形成。
5、就Vero E6(非洲綠猴腎細胞系)細胞進行相關檢測、實驗,結果如下:
TfR在Vero E6細胞膜上高密度表達;
TfR與ACE2共定位於感染和未感染SARS-CoV-2的Vero E6細胞膜上;
在SARS-2感染的Vero E6細胞膜上觀察到TfR與SARS-2 S的顯著共定位(圖I),以及TfR、ACE2、SARS-2 S三者的共定位(圖J);
在被SARS-CoV-2感染的Vero E6細胞的細胞質中僅觀察到TfR與SARS-2 S的共定位(未觀察到ACE2與SARS-2 S,及TfR與ACE2的共定位),這表明,與SARS-CoV-2共同從細胞膜內化、轉運至細胞質的是TfR,而非ACE2。
觀察到X與Y共定位,指觀察到X、Y結合形成的複合體。
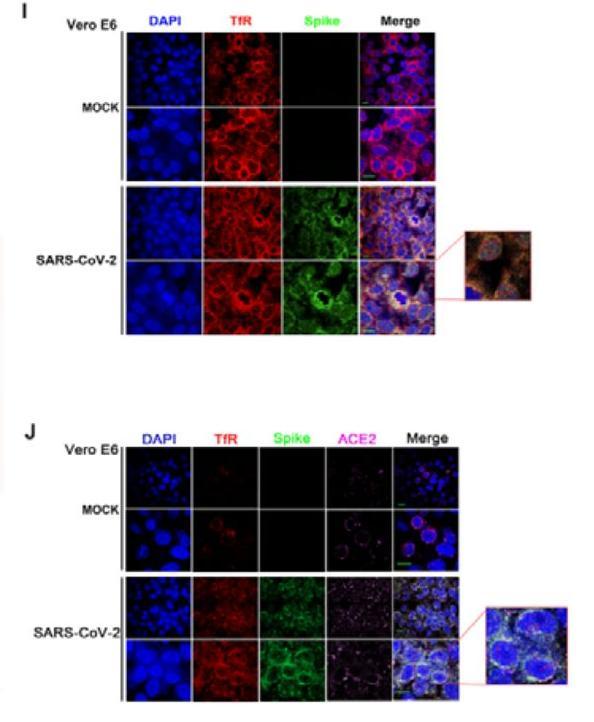
圖I:用anti-TfR、anti-Spike抗體標記對應蛋白,觀察Spike-TfR共定位;
圖J:用anti-TfR、anti-ACE2、anti-Spike抗體標記對應蛋白,觀察Spike-TfR-ACE2共定位。
關於圖中各列,
DAPI,表示用DAPI染色、標記細胞核。DAPI:4′,6-diamidino-2-phenylindole,4',6-二脒基-2-苯基吲哚,一種用於DNA和細胞核染色的藍色熒光染料,與雙鏈DNA結合後可以產生比DAPI自身強20多倍的藍色熒光;
TfR,表示用anti-TfR染色、標記TfR;
Spike,表示用anti-Spike染色、標記SARS-CoV-2的Spike(即S蛋白);
ACE2,表示用anti-ACE2染色、標記ACE2;
Merge,表示同時染色、標記TfR、Spike(圖I),或同時染色、標記TfR、Spike、ACE2(圖J)。
關於圖中各行,
MOCK,表示未用SARS-CoV-2感染的對照組Vero E6細胞,二行MOCK可能代表兩組對照細胞,或對照細胞的兩組圖像;
SARS-CoV-2,表示用SARS-CoV-2感染的Vero E6細胞,二行SARS-CoV-2可能代表兩組感染細胞,或感染細胞的兩組圖像。
圖I、圖J的區別是,圖I未染色、標記ACE2,圖J染色、標記了ACE2。
關於實驗結果,
圖I,
未用SARS-CoV-2感染時,在Merge列同時觀察到藍色的細胞核和紅色的TfR;
使用SARS-CoV-2感染時,在Merge列同時觀察到藍色的細胞核、紅色的TfR,及與Spike形態吻合的結構(看不到明顯的綠色)。
圖J,
未用SARS-CoV-2感染時,在Merge列同時觀察到藍色的細胞核、紅色的TfR、紫色點狀的ACE2;
使用SARS-CoV-2感染時,在Merge列同時觀察到藍色的細胞核、紅色的TfR、紫色點狀的ACE2,及與Spike形態吻合的結構。
筆者感覺肉眼很難識別圖J Merge列中的ACE2。論文對圖I、圖J未提供細節說明,上述“關於實驗結果”相關內容為筆者個人理解和推測。
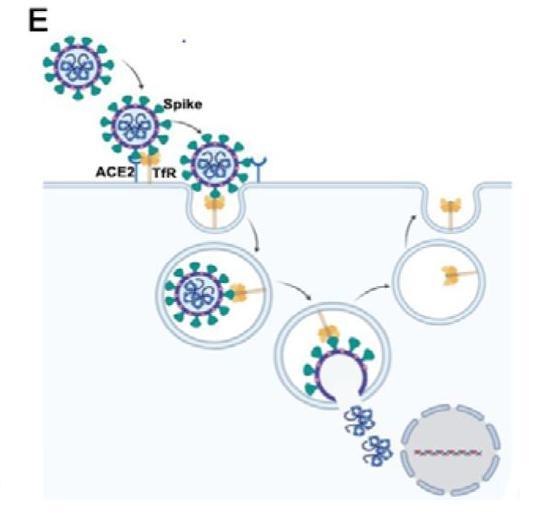
TfR與Spike結合,介導SARS-2進入細胞並與之共同內化至細胞質示意圖
6、可溶性TfR、Tf(transferrin,轉鐵蛋白)、anti-TfR抗體和SL8多肽都顯著抑制了SARS-CoV-2對Vero E6細胞的感染;
註:
可溶性TfR可結合、消耗SARS-CoV-2 S蛋白,減少其與細胞膜表面TfR的結合;
轉鐵蛋白(Tf)、anti-TfR可競爭、干擾SARS-CoV-2 S蛋白與細胞膜表面TfR的結合;
200nM anti-TfR抗體的抗SARS-2感染效果與高濃度(4μM)Remdeivir(瑞德西韋)相當(見圖A的第一行和最後一行,1μM=1000nM);
(該研究)所設計的三種多肽顯示出很強的SARS-2抑制能力(圖H第二、三行及圖J),在80μM濃度下,SL8、QK8和FG8分別抑制了87%、99%和75%的病毒感染(圖H、J、K)。
三種多肽功能如下:
SL8同時干擾TfR-ACE2、TfR-Spike的相互作用;
QK8干擾TfR-Spike的相互作用;
FG8干擾TfR-ACE2的相互作用。
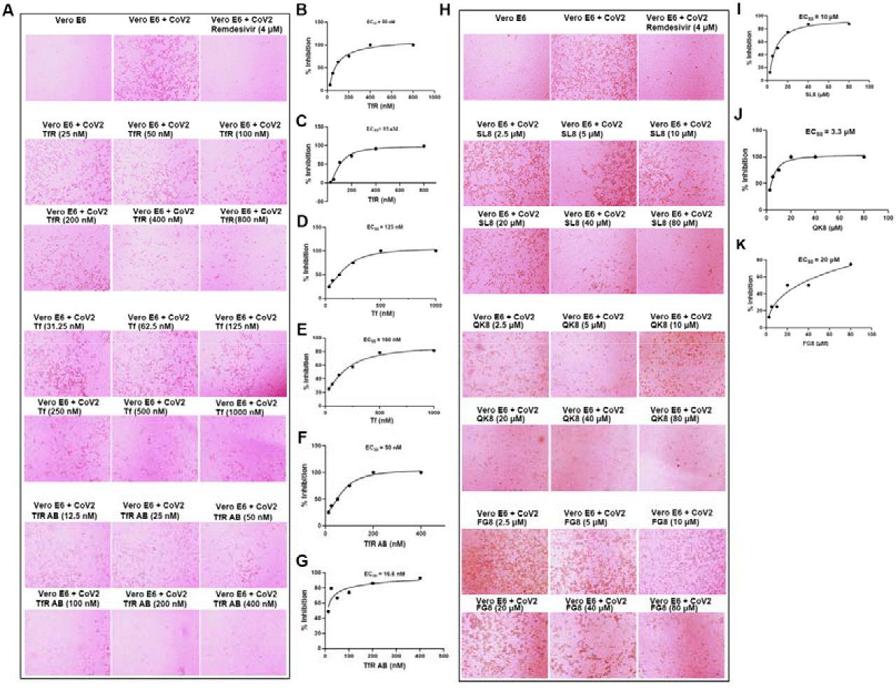
圖A中的TfR AB,指TfR antibody,即anti-TfR抗體。
7、SARS-CoV-2可感染敲除了ACE2的Vero E6細胞和A549細胞;同時,anti-TfR抗體近乎消除了SARS-CoV-2對這兩種ACE2敲除細胞的感染(下圖C、D)。這表明,在沒有ACE2的情況下,介導SARS-CoV-2感染Vero E6、A549細胞的很可能是TfR。
此外,TfR過表達促進SARS-CoV-2感染ACE2敲除的Vero E6細胞,如果同時敲除細胞中的ACE2和TfR,則SARS-CoV-2對Vero E6細胞的感染將受到極大抑制(下圖E、F)。這表明,SARS-CoV-2對ACE2敲除的Vero E6細胞的感染,確實是由TfR介導的,TfR是一種獨立於ACE2的SARS-CoV-2感染受體。
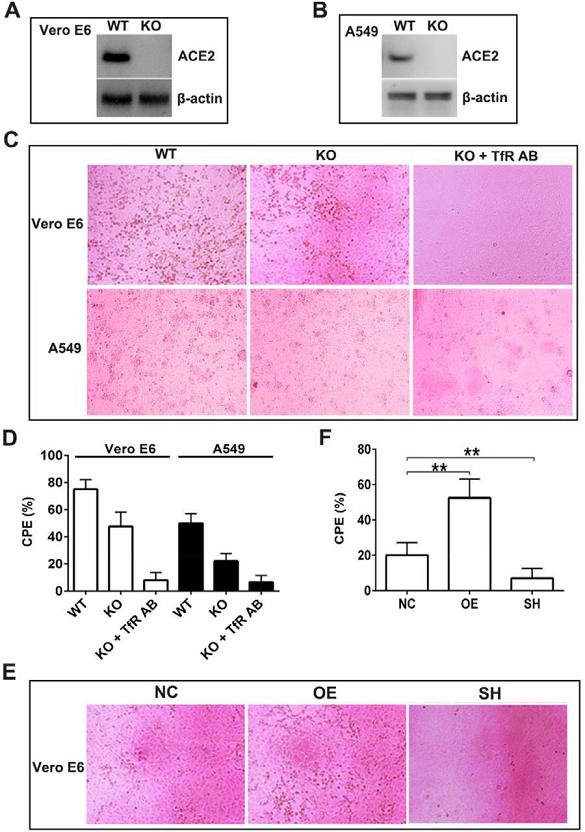
圖A:用蛋白質印跡法確認Vero E6細胞的ACE2敲除。
圖B:用蛋白質印跡法確認A549細胞的ACE2敲除。
圖C:SARS-CoV-2感染6組細胞的顯微鏡圖像。由圖可見,anti-TfR抗體近乎消除了SARS-CoV-2對ACE2敲除的Vero E6、A549細胞的感染。
WT,wild-type,野生型,代表未作人為基因加工、改造的細胞;
KO,knockout,敲除,對應敲除了ACE2基因的細胞;
KO+TfR AB,對應敲除了ACE2,且用anti-TfR預處理過的細胞;
圖D:通過量化圖C中的CPE視覺結果來評估、對比SARS-CoV-2對6組細胞的感染效果。
CPE,Cytopathic effect,細胞病變效果或細胞病變程度。
圖E:SARS-CoV-2感染TfR過表達或TfR敲除的ACE2敲除Vero E6細胞的顯微鏡圖像。由圖可見,SARS-CoV-2對TfR、ACE2同時敲除的Vero E6細胞幾乎沒有視覺可見的感染效果。
圖E中的三組細胞皆為敲除了ACE2的Vero E6細胞。
NC,對照組(control)細胞,對應敲除了ACE2,但對TfR未作處理的Vero E6細胞;
OE,over-expression,過表達,對應通過基因轉染提升了TfR表達水平,同時敲除了ACE2的Vero E6細胞;
SH,可能是shield(屏蔽)的縮寫,對應同時敲除了TfR、ACE2的Vero E6細胞。
圖F:通過量化圖E中的CPE視覺結果來評估、對比SARS-CoV-2對3組ACE2敲除細胞的感染效果。
8、hTfR(human TfR)使不易感染SARS-CoV-2的小鼠易於被感染,且症狀較為嚴重。相比野生型小鼠,hTfR小鼠肺組織中的病毒載量(Viral Loads)大幅提升(圖A),體重顯著下降(圖B),並出現嚴重的血管充血和出血症狀(圖C)。
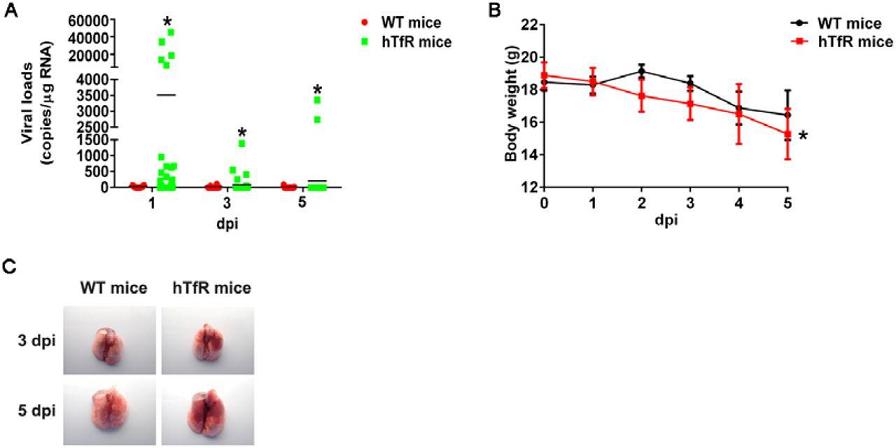
SARS-CoV-2對WT mice、hTfR mice的感染、致病差異
圖A:感染後第1、3、5天,WT mice、hTfR mice肺組織中的病毒載量。
圖B:感染後第1~5天,WT mice、hTfR mice的體重變化。
圖C:感染後第3、5天,WT mice、hTfR mice的肺標本照片。
dpi,day post inflection,感染後天數。
上述實驗表明,相比小鼠TfR,SARS-CoV-2 S蛋白更適宜結合人類TfR。一個對應事實是:SARS-CoV-2 S蛋白最適宜結合hACE2,SARS-2 S蛋白與hACE2的結合親和力,強於所有已對照的物種ACE2。人類是SARS-CoV-2的最佳感染對象。
9 、anti-TfR抗體對hTfR小鼠表現出良好的抗SARS-CoV-2效果。
施用anti-TfR大幅降低了hTfR小鼠肺組織中的病毒載量,而施用IgG抗體沒有獲得抑制效果(圖A);
施用anti-TfR降低了hTfR小鼠體重下降幅度(圖B);
肺組織切片病理學檢查表明,施用anti-TfR的hTfR小鼠肺組織病理損傷顯著減輕,沒有樣本出現對照組hTfR小鼠典型的間質性肺炎(interstitial pneumonia)症狀(圖C、D)。
IgG,Immunoglobulin G,免疫球蛋白G抗體。
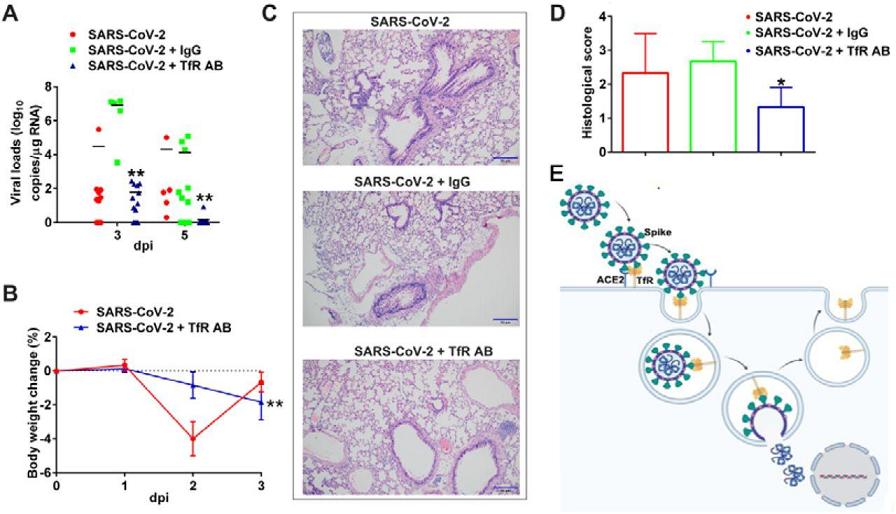
Anti-TfR抗體抑制SARS-CoV-2對hTfR小鼠的感染、致病
圖A:施用anti-TfR(TfR AB)、IgG、未施用抗體三種情況下的hTfR小鼠肺組織病毒載量。由圖可見,感染後第五天,anti-TfR施用組的病毒載量相比未施用組下降了5個對數級,即降低了10^5倍;IgG施用組病毒載量未見降低。
圖B:anti-TfR施用組、未施用組hTfR小鼠的體重變化。
圖C:感染後第5天anti-TfR施用組、IgG施用組、未施用抗體組hTfR小鼠肺組織切片的病變染色分析圖象。
圖D:對圖C中肺組織病變視覺結果的量化評估、對比。
Histological score,組織學評分,應指組織病變評分,分值越高,病變越嚴重。
圖E:TfR與Spike結合,介導SARS-2進入細胞並與之共同內化至細胞質。
論文依據二
Ferristatin II Efficiently Inhibits SARS-CoV-2 Replication in Vero Cells
Ferristatin II有效抑制Vero細胞中的SARS-CoV-2複製
https://www.mdpi.com/1999-4915/14/2/317
這項研究使用TfR1降解劑ferristatin II抑制/阻斷了SARS-CoV-2對Vero細胞的感染、複製,驗證了TfR1對SARS-CoV-2感染的介導作用。該研究還表明,TfR1不僅介導SARS-CoV-2感染,還促進SARS-CoV-2複製。
TfR1降解劑ferristatin II(NSC8679)是一種小分子化合物,它通過制黴菌素(Nystatin)敏感的脂筏途徑降解TfR1。脂筏(lipid raft)是質膜(細胞膜)上富含膽固醇和鞘磷脂的動態微結構域。
論文指出:
1、TfR1小分子降解劑ferristatin II顯著抑制了SARS-CoV-2 Wuhan D614G毒株和Delta毒株對Vero細胞(Vero-CCL81)的感染,半數抑制濃度(IC50)分別為26.5µM、40.4µM(圖A);當濃度達到100µM時,ferristatin II可使D614G、Delta在Vero細胞中的複製完全中止(細胞上清液中的病毒滴度降至qRT-PCR有效RNA檢測值的下限)(圖B)。
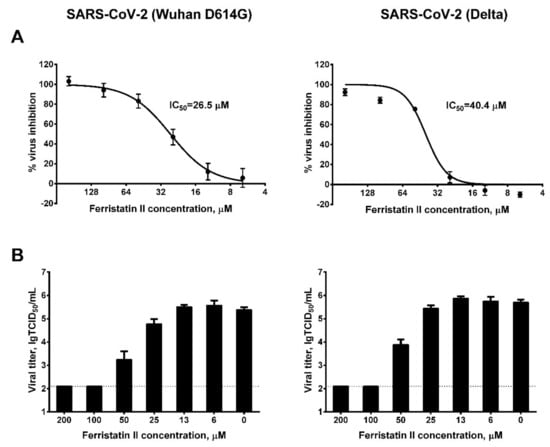
圖A:不同濃度ferristatin II對D614G、Delta的抑制度;
圖B:不同濃度ferristatin II對細胞上清液中D614G、Delta(相對)滴度的影響。
縱坐標約為2的水平虛線代表RNA檢測值的下限。
IC50,half(50%)maximal inhibitory concentration,半數抑制濃度,獲得50%最大抑制效果所需的藥劑濃度;
TCID50:half(50%)tissue culture infectious dose,半數組織培養物感染劑量,使半數培養細胞發生感染、病變或死亡所需的病毒劑量。
µM,µmol/L,微摩爾/升,1µM=10^-6mol/L。
2、ferristatin II對Omicron變體的抑制效果更顯著。如下圖所示,6.25µM濃度的ferristatin II即可使細胞上清液中的Omicron滴度下降10倍(滴度對數值從6降到5,對應滴度值下降10倍),50µM的ferristatin II即可使Omicron完全停止複製。
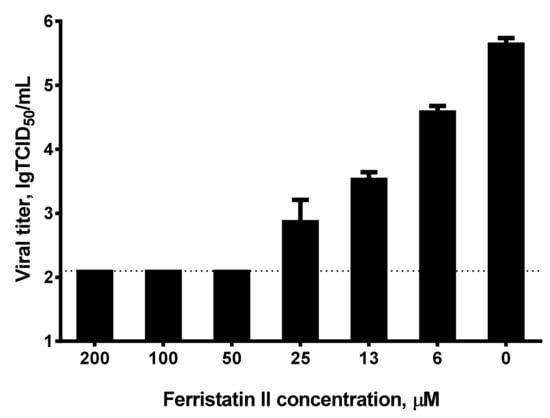
按照論文說明,2、3中的實驗需要ferristatin II與Vero細胞持續共存於培養基中(按論文所言,這也是ferristatin II降解TfR1的通常條件),僅在細胞預處理階段使用ferristatin II,或者,不使用ferristatin II預處理細胞,而是將ferristatin II與SARS-CoV-2同時施用於Vero細胞,都觀察不到上述實驗效果。
3、檢查了ferristatin II的細胞毒性,如下圖所示,培養基中ferristatin II濃度即使高達400µM,48小時內對細胞活力(viability)也沒有負面影響,這表明ferristatin II對SARS-CoV-2複製的抑制效果不是ferristatin II的細胞毒性,及細胞毒性引起的細胞代謝障礙所致。
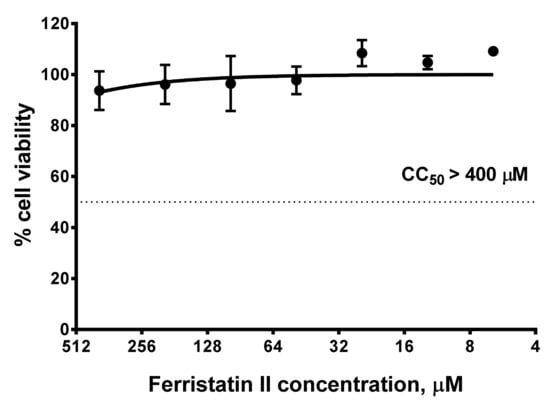
<=400µM濃度的ferristatin II48小時內不會抑制細胞活力
4、用100µM ferristatin II處理Vero細胞18小時後施加SARS-CoV-2,發現TAMRA標記的SARS-2-RBD瀰漫性地分布在Vero細胞表面,僅有一小部分成簇的TAMRA信號與DAPI染色的細胞核重疊(進入細胞),如下面的共聚焦圖像末排所示。這表明,ferristatin II(通過降解TfR1)阻止了SARS-CoV-2進入細胞(SARS-2 RBD或S蛋白可能與細胞表面的其它因子結合,但未能進入細胞)。(SARS-CoV-2為什麼沒有利用ACE2進入Vero細胞???)
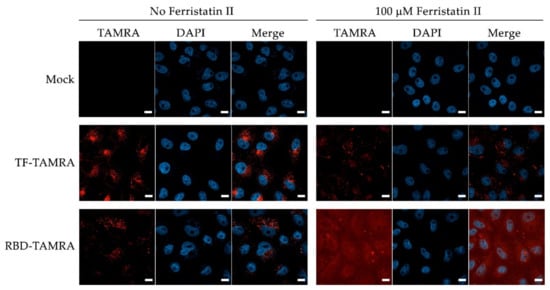
ferristatin II阻止SARS-CoV-2進入Vero細胞
TAMRA,Tetramethylrhodamine,四甲基羅丹明,一種染色、標記蛋白質、核酸和其他生物分子的紅色熒光染料;
DAPI,一種用於DNA和細胞核染色、標記的藍色熒光染料,前面作過介紹;
Merge,表示同時使用TAMRA和DAPI染色相應對象(Mock除外);
Mock,模擬、未處理,表示未使用TAMRA染色、標記SARS-2-RBD或轉鐵蛋白(Tf);
TF-TAMRA,表示用TAMRA染色、標記轉鐵蛋白(Tf);
RBD-TAMRA,表示Vero細胞與SARS-CoV-2共同培養,且培養前SARS-2-RBD已用TAMRA染色、標記;
左圖各實驗未使用ferristatin II。
左圖第一排,Vero細胞的細胞核用DAPI染色;
左圖第二排,轉鐵蛋白(Tf)用TAMRA染色,細胞核用DAPI染色,紅色的轉鐵蛋白與藍色的細胞核共同出現在Vero細胞內;
左圖第三排,Vero細胞與SARS-CoV-2共同培養,培養前SARS-2-RBD已用TAMRA染色,細胞核已用DAPI染色,紅色的SARS-2-RBD與藍色的細胞核共同出現在Vero細胞內;
右圖各實驗使用100µM ferristatin II預處理Vero細胞18小時,其它情況與左圖對應實驗相同。
右圖第一排,Vero細胞的細胞核用DAPI染色,共聚焦圖像與左圖第一排大體一致;
右圖第二排,轉鐵蛋白(Tf)用TAMRA染色,細胞核用DAPI染色,相比左圖第二排,出現在細胞內的紅色轉鐵蛋白顯著減少(ferristatin II降解了Tf進入細胞所需的TfR1);
右圖第三排,已施加ferristatin II的Vero細胞與SARS-CoV-2共同培養,SARS-2-RBD用TAMRA染色,細胞核用DAPI染色,共聚焦圖像與左圖第三排截然不同,紅色的SARS-2-RBD瀰漫性分布在細胞表面,未進入細胞內(ferristatin II降解了SARS-2進入細胞所需的TfR1)。
論文依據三
A Possible Way to Relate the Effects of SARS-CoV-2-Induced Changes in Transferrin to Severe COVID-19-Associated Diseases
SARS-CoV-2引發的轉鐵蛋白改變效應與嚴重COVID-19相關疾病之間的一種可能關聯
https://www.mdpi.com/1422-0067/23/11/6189
論文指出:
SARS-CoV-2可能通過與轉鐵蛋白(Tf)結合,誘導Tf發生熱力學變化,熱穩定性降低,Fe3+攝取能力被抑制,Tf保持在無鐵的apo構象狀態(Apo-Transferrin,脫鐵轉鐵蛋白),機體內產生過量的游離鐵(未與轉鐵蛋白等鐵代謝蛋白結合的鐵離子),過量游離鐵的毒性造成紅細胞生成紊亂(這可能是SARS-CoV-2引起紅細胞生成紊亂的內在機制)。
論文沒有解釋、說明SARS-CoV-2與轉鐵蛋白(Tf)結合的細節,筆者猜測,這一結合可能指SARS-CoV-2 S蛋白通過結合轉鐵蛋白受體(TfR)間接結合與TfR結合的轉鐵蛋白(Tf)。筆者沒有查閱到SARS-CoV-2直接結合轉鐵蛋白(Tf)的論文依據。
論文依據四
Transferrin Receptor Protein 1 Cooperates with mGluR2 To Mediate the Internalization of Rabies Virus and SARS-CoV-2
轉鐵蛋白受體蛋白1與mGluR2配合介導狂犬病病毒和SARS-CoV-2的內化
https://journals.asm.org/doi/10.1128/jvi.01611-22
論文研究、比照了兩種人類受體(TfR1、mGluR2)在兩種病毒(RABV、SARS-CoV-2)內化過程中的作用,展示了RABV、SARS-CoV-2利用TfR1、mGluR2達成感染的機制關聯性。
RABV:rabies virus,狂犬病病毒。
病毒內化(Virus Internalization),指完成受體結合,附着到細胞膜上的病毒,病毒粒子或其RNA進入細胞內的過程。病毒內化可通過細胞整體內吞病毒粒子,或病毒包膜與細胞膜直接膜融合後向細胞內釋放病毒RNA等方式來實現。受體結合+內化=達成感染/細胞進入。
mGluR2,metabotropic glutamate receptor subtype 2,代謝型穀氨酸受體亞型2,是代謝型穀氨酸受體(mGluR)的8種亞型之一。和前面提到的AChR/nAChR一樣,mGluR也是神經元受體,且是人體內最重要的神經遞質受體之一,它結合穀氨酸,負責興奮性神經信號的傳遞。
論文指出:
1、mGluR2在體外充當RABV的進入受體,並且是SARS-CoV-2體外和體內的重要內化因子;
2、mGluR2促進RABV體外內化和體內感染;
3、轉鐵蛋白受體1(TfR1)與mGluR2相互作用,並在同一個網格蛋白包被的凹坑中與mGluR2和RABV內化。TfR1的敲低會阻止激動劑觸發的mGluR2內化;
4、重要的是,TfR1還與SARS-CoV-2 S蛋白相互作用,對於SARS-CoV-2內化很重要;
5、我們的研究結果確定了RABV和SARS-CoV-2用於細胞進入的新軸(mGluR2-TfR1軸),並表明TfR1可作為RABV和SARS-CoV-2治療的潛在靶點。
如前所述,SARS-CoV-2與狂犬病病毒(RABV)有3種共同的感染受體/細胞進入因子:TfR1、nAChR、mGluR2,二者負責結合nAChR的序列片斷相似,二者都具有神經毒性。TfR1、nAChR是SARS-CoV-2的感染受體, mGluR2是SARS-CoV-2的重要內化因子,TfR1、nAChR、mGluR2都是RABV的感染受體,RABV約有5種已知的感染受體。SARS-CoV-2可能借鑑了RABV的感染、致病機制,並參照了RABV結合nAChR的序列/多肽結構。
相關論文
1、
COVID-19-Related Coagulopathy—Is Transferrin a Missing Link?
COVID-19相關凝血病——轉鐵蛋白是缺失的一環嗎?
https://www.mdpi.com/2075-4418/10/8/539
2、
COVID-19 Attacks the 1-Beta Chain of Hemoglobin to Disrupt Respiratory Function and Escape Immunity by Capsid-Like System
COVID-19攻擊血紅蛋白1-β鏈,破壞呼吸功能並通過衣殼樣系統逃避免疫
https://chemrxiv.org/engage/chemrxiv/article-details/63d134df6bc5ca30b61a9d64
3、
Transferrin Receptor Protein 1 Is an Entry Factor for Rabies Virus
轉鐵蛋白受體蛋白1是狂犬病病毒的一種(細胞)進入因子
https://journals.asm.org/doi/10.1128/jvi.01612-22
(未完待續)



















