接续:“万能”受体适配器--新冠S蛋白 2
SARS-CoV-2的S(Spike,刺突)蛋白不只是达成感染(进入细胞)的工具、钥匙。SARS-CoV-2的S蛋白,包括疫苗中嵌入的SARS-CoV-2 S蛋白,或疫苗编码产生的SARS-CoV-2 S蛋白,具有多方面的毒性(致病能力)。比如,SARS-CoV-2的S蛋白可引发凝血障碍和血栓,再比如,SARS-CoV-2的S蛋白可导致铁代谢失调、紊乱,引发铁毒性(游离铁过量)、红细胞生成紊乱(产生无效的红细胞)等等一系列铁代谢失调、紊乱后果。
S蛋白自身具有毒性,这在冠状病毒中可能前所未见,因而,在疫苗设计、研发、大力推广中,SARS-CoV-2 S蛋白的毒性被广泛忽视;新冠疫苗(促发正常免疫反应之外)的致病、致残、致死表现及“副作用”,可能本质上就源自SARS-CoV-2 S蛋白的毒性(可能同时存在其它材质原因)。近几个月几乎听不到宣传、强调疫苗接种的声音了,2023年还多次报出各国大量销毁疫苗的消息。为什么大量销毁疫苗?为什么许多国家都出现了天量疫苗过期的事情?这是巧合吗?各国销毁天量疫苗,真的是因为过期?什么样的问题应对、处理方式,有利于公众,有利于未来?是直面问题、开放讨论、公开检讨反思,还是回避、冷处理、瞒天过海、蒙混过关?有些科学、学术问题不只是单纯的科学、学术问题,这样的问题似乎越来越多了。
SARS-CoV-2 S蛋白多重毒性的内在原因,是它拥有史无前例的广泛的人体因子结合能力,以及对人体因子的影响、干预、改变、模仿等能力。
SARS-CoV-2能够结合的人体因子/宿主因子之多,令其它所有病毒望尘莫及。已论文报告的,SARS-2 S蛋白可结合的人类跨膜受体蛋白超过三十种(加上本文的转铁蛋白受体,笔者目前仅介绍了其中的7种);SARS-2 S蛋白还能结合众多非跨膜存在的,不作为感染受体的人体蛋白、多肽、激素;SARS-CoV-2还能通过S蛋白之外的其它蛋白结合人体因子。
还有大量被SARS-CoV-2影响、干预、改变、模仿的人体因子(这些人体因子与SARS-CoV-2的可结合人体因子部分重合)。SARS-CoV-2甚至赤裸裸地抄袭、复用人类关键基因片断,例如,SARS-CoV-2抄袭了人类ENaC-α(上皮钠离子通道的α亚基)的长furin切割序列(八氨基酸序列RRAR'SVAS),将其作为S蛋白关键位点S1/S2处的furin切割序列,并以此模仿ENaC的酶切水解激活。
SARS-CoV-2 S蛋白、其它蛋白对众多人体因子的结合、利用、竞争、消耗,对众多人体因子的影响、干预,对部分人体因子的功能改变、结构借鉴、功能模仿,不同程度地干扰、抑制、破坏人体的正常机能,引发不胜枚举的病理后果。
由上一篇文章可知,SARS-CoV-2 S蛋白能够结合两种人体抗凝血因子,硫酸乙酰肝素(HS)和肝素(HP),其中HS(及HSPG)可在细胞表面跨膜存在,作为ACE2的辅助受体促进SARS-CoV-2感染。
本文将说明,SARS-CoV-2的S蛋白能够结合转铁蛋白受体(transferrin receptor,TfR),并通过结合TfR达成感染(进入细胞),TfR是独立于ACE2的SARS-CoV-2感染受体;SARS-CoV-2还能改变转铁蛋白(transferrin,Tf,转铁蛋白受体的铁代谢搭档)的热力学性质,降低它的热稳定性,抑制其铁摄取能力。
下一篇文章将说明,SARS-CoV-2的S蛋白能够结合人类铁调素(Hepcidin);并且,SARS-CoV-2 S蛋白的尾部区域与人类铁调素氨基酸序列相似,S蛋白在人体内降解后释放出的这一尾部片断可能能够模仿铁调素的分子作用和生理功能--结合铁转运蛋白(ferroportin,FP),促使其降解,进而抑制细胞铁吸收、铁释放,降低血液中的循环铁。转铁蛋白(Tf)、转铁蛋白受体(TfR)、铁调素、铁转运蛋白(FP)是人类和哺乳动物的关键铁代谢因子,对它们的结合、改变、模仿、降解将干扰人体铁转运、铁代谢,破坏铁稳态,引发铁代谢失调、紊乱。下一篇文章或后续文章将指出,SARS-CoV-2的S蛋白还能结合血红蛋白(hemoglobin,Hb)、肌红蛋白(myoglobin,Mb)、乳铁蛋白(lactoferrin ,Lf)等其它铁代谢因子(不过,与乳铁蛋白Lf的结合可能对SARS-CoV-2感染、致病起负作用)。
SARS-CoV-2还使用S蛋白外的其它结构蛋白,以及非结构蛋白结合、干扰、攻击人体铁代谢因子,比如,SARS-CoV-2的三种非结构蛋白orf1ab、ORF3a、ORF10可协同结合、攻击血红蛋白1-β链上的血红素(Heme),使血红蛋白与铁离子解离(铁离子成为游离铁),破坏铁代谢,同时干扰血红素的合成代谢途径。
SARS-CoV-2引发的铁代谢失调/紊乱对人体的影响广泛而深远,已论文报告的SARS-CoV-2相关的铁代谢疾病或症状包括:铁毒性(血液、其它组织液或细胞中未与转铁蛋白、血红蛋白、铁蛋白-ferritin等铁代谢蛋白结合的游离铁过量)、红细胞生成紊乱(产生大量无效的红细胞)、铁缺乏症、细胞铁死亡、免疫力低下或受损、高凝血症、功能障碍性血红蛋白病等等,SARS-CoV-2引起的铁代谢失调、紊乱还可能引发多器官并发症,导致多器官功能障碍。
SARS-2相关的铁代谢失调/紊乱也能引发凝血障碍,一个关联因素是,被SARS-2 S蛋白干扰、改变的转铁蛋白(Tf)既是关键的铁代谢因子,又是一种促凝血剂。老年人、男性SARS-CoV-2感染重症风险更高,也与铁代谢失调/紊乱关系密切。老年人和男性体内的转铁蛋白(Tf)水平高于其它人群,因而这两类人群体内的转铁蛋白与抗凝血酶(antithrombin)比值高于其它人群(抗凝血酶水平不受年龄或性别影响),老年男性感染SARS-CoV-2的重症风险最高,很可能与老年男性是转铁蛋白/抗凝血酶比值最高人群有关。
SARS-CoV-2对人体铁代谢多方位、系统化的干预、干扰、破坏能力,是在动物宿主体内随机、无目的自然演化偶然产生的吗?SARS-CoV-2是自然产物,还是出自科技狂魔之手的包罗万象的转基因“杰作”巨制?
7、transferrin receptor(转铁蛋白受体)
先说Transferrin。
Transferrin(缩写为Tf或Trf),转铁蛋白,也叫运铁蛋白,是一种单链糖蛋白。转铁蛋白是脊椎动物铁转运、铁代谢的关键蛋白,它能紧密结合血清中的游离铁(包括消化系统吸收的铁和红细胞降解释放的铁),并将其转运至机体各处的细胞。转铁蛋白有两个铁离子结合位,每个结合位可以结合一个三价铁离子(Fe3+)。未结合铁离子的转铁蛋白称为脱铁转铁蛋白或原转铁蛋白(apo-transferrin,apo-Tf),与铁离子结合的转铁蛋白称为饱和转铁蛋白或全转铁蛋白(holo-transferrin,holo-Tf)。转铁蛋白转运的铁离子是(绝)大多数细胞各个代谢环节所必需的;转铁蛋白运至骨髓的铁离子用于合成血红蛋白,生成成熟的红细胞。转铁蛋白主要由肝脏产生,睾丸、大脑、脾脏和肾脏也会产生少量转铁蛋白。转铁蛋白也是一种促凝血剂。
再说transferrin receptor。
transferrin receptor(缩写为TfR),转铁蛋白受体,一种跨膜糖蛋白,细胞铁摄取的门卫。顾名思义,它就是转铁蛋白的受体蛋白、结合蛋白,一个转铁蛋白受体(TfR)可结合两个转铁蛋白(Tf),并且它更适于结合已结合铁离子的转铁蛋白,即Holo-Tf(TfR与Holo-Tf的结合亲和力强于其与apo-Tf的结合亲和力)。转铁蛋白受体(TfR)、转铁蛋白(Tf)是铁转运、铁代谢的一对关键拍档,转铁蛋白受体(TfR)负责在细胞膜表面结合转铁蛋白(Tf),并介导转铁蛋白进入细胞,使细胞得以摄取转铁蛋白所携带的铁离子。简而言之,转铁蛋白(Tf)负责转运铁,而转铁蛋白受体(TfR)负责为细胞接收铁、摄入铁。
转铁蛋白受体有两种类型(亚型):TfR1、TfR2,二者结构相似。TfR1也叫CD71(分化簇71),它以不同水平在绝大多数细胞的细胞膜上普遍表达,结合转铁蛋白(Tf),为细胞摄入铁的就是TfR1;TfR2则专门在肝细胞、红细胞中表达,通过与转铁蛋白(Tf)结合为肝细胞摄入铁,同时作为铁传感器调节蛋白质活性,以响应细胞氧化还原平衡。TfR1还因为在恶性细胞(癌细胞)细胞膜上的表达水平普遍较高而被广泛用作癌症治疗的靶标。
转铁蛋白(Tf)、转铁蛋白受体(TfR)还都是免疫系统的重要调控、参与因子。巨噬细胞和T淋巴细胞中的转铁蛋白(Tf)对早期T淋巴细胞分化至关重要;而转铁蛋白受体(TfR)则对T淋巴细胞的DNA合成和细胞分裂至关重要。
已论文报告的以TfR/TfR1为感染受体或细胞进入因子的病毒有:丙型肝炎病毒(hepatitis C virus,HCV,属于黄病毒科肝炎病毒属)、传染性胃肠炎病毒(Transmissible gastroenteritis virus ,TGEV,属于冠状病毒科)、狂犬病病毒(Rabies Virus,RABV,属于弹状病毒科)、犬细小病毒(canine parvovirus,CPV,属于细小病毒科)、新大陆出血性沙粒病毒(New World arenaviruses,属于沙粒病毒科)、甲型流感病毒(Influenza A virus ,IAV,属于正黏液病毒科)等。
SARS-CoV-2 S蛋白能以高亲和力结合转铁蛋白受体(TfR/TfR1),并通过结合TfR/TfR1进入细胞;SARS-CoV-2 S蛋白可能干扰转铁蛋白(Tf)与转铁蛋白受体(TfR)的结合,及Tf的内化(S蛋白顶替Tf被TfR介导至细胞内),从而干扰细胞的铁摄取;SARS-CoV-2还可改变转铁蛋白(Tf)的热力学性质,降低其热稳定性,抑制其铁结合、铁转运能力,破坏细胞的铁摄取来源;
TfR/TfR1是独立于ACE2的SARS-CoV-2感染受体,它对SARS-CoV-2感染的介导不依赖ACE2。
TfR1也是RABV(Rabies Virus,狂犬病病毒)的感染受体;SARS-CoV-2和RABV还都可结合神经元AChR/nAChR受体(乙酰胆碱受体/烟碱型乙酰胆碱受体),这二种病毒都具有神经毒性,并且,SARS-CoV-2 S蛋白决定nAChR结合能力的基因片断与RABV G蛋白的对应基因片断存在序列相似性;此外,RABV的另一种感染受体mGluR2(代谢型谷氨酸受体亚型2,也是一种神经元受体)是SARS-CoV-2的重要内化因子。也就是说,SARS-CoV-2与RABV有3种共同的感染受体或细胞进入因子TfR1、nAChR、mGluR2,二者结合nAChR的序列片断相似,二者都具有神经毒性。SARS-CoV-2可能借鉴了RABV的感染、致病进入机制,并参照了RABV结合nAChR的序列/多肽结构。RABV约有5种已知的感染受体,它属于弹状病毒科,不是冠状病毒。
SARS-CoV-2可能是已知的,仅有的两种以TfR/TfR1为感染受体的冠状病毒之一,另外一种是TGEV(Transmissible gastroenteritis virus ,传染性胃肠炎病毒),2018年的一篇论文报告说,TfR1是TGEV的辅助受体(非独立受体)。TGEV的宿主/感染对象不是人类,而是猪(传染性胃肠炎病毒就是猪传染性胃肠炎病毒)。SARS-CoV-2属于冠状病毒β谱系,TGEV属于冠状病毒α谱系,二者亲缘关系极远。
此次疫情前,可能没有论文报告过,某种可结合TfR/TfR1的病毒能够(显著)干预宿主铁代谢。
### 2023_09_08 更正 ###
最末一句判断有误,最近注意到一些HCV(hepatitis C virus,丙型肝炎病毒)影响铁代谢的过往论文。
###
论文依据一
Transferrin receptor is another receptor for SARS-CoV-2 entry
转铁蛋白受体是SARS-CoV-2进入的另一种受体
https://www.biorxiv.org/content/10.1101/2020.10.23.350348v1
论文要点如下:
a)TfR(转铁蛋白受体)与SARS-CoV-2 S蛋白以高亲和力结合;
b)TfR与SARS-CoV-2 S蛋白相互作用、结合并介导病毒进入细胞;
c)敲除细胞中的ACE2并不能完全阻止SARS-CoV-2进入细胞(TfR对SARS-CoV-2感染的介导独立于ACE2);
d)在细胞膜上和细胞质中均发现了TfR与SARS-CoV-2 S蛋白的共定位(即发现、鉴定了二者结合形成的复合物),表明SARS-2通过TfR在细胞膜和细胞质之间进行转运;
e)干扰TfR-Spike相互作用(、结合)可阻止SARS-CoV-2进入细胞;
f)SARS-CoV-2可以感染表达hTfR(human TfR,人类转铁蛋白受体),且不表达hACE2(human ACE2)的人源化转基因小鼠(再次表明hTfR是独立于hACE2的SARS-CoV-2感染受体);
g)anti-TfR抗体对表达hTfR的人源化小鼠显示出良好的抗SARS-CoV-2(感染、复制)效果。
更具体地,论文指出:
1、qRT-PCR检测和蛋白质印迹(western blot)检测表明,TfR(蛋白及其RNA基因)在鼻腔、气管、肺、肝脏等多种组织中表达,在肺和气管中表达水平较高(图A、B、C);
免疫组织化学分析(Immunohistochemical analysis)显示,被SARS-CoV-2感染的猴子和hACE2小鼠(hACE2 mice)肺组织中的TfR表达水平上调(升高)(图D、E)。
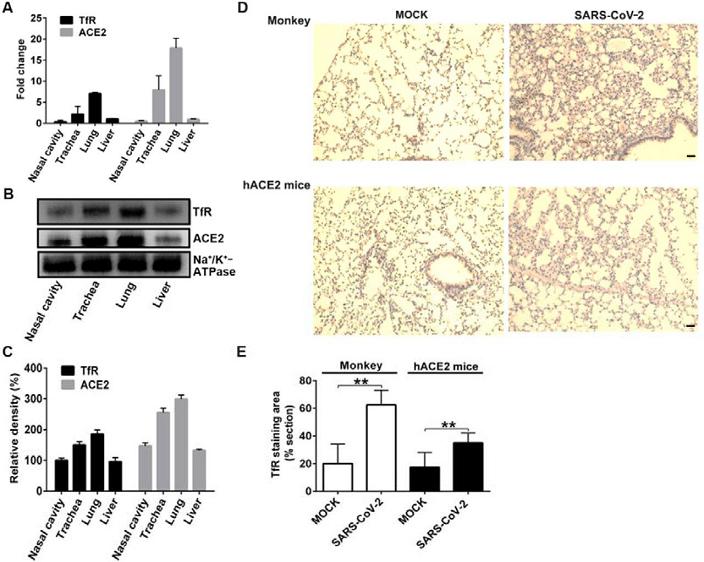
TfR的多组织表达;SARS-CoV-2感染上调猴子、hACE2小鼠肺组织中的TfR表达水平。
图D中,肺组织的细胞核用苏木精(hematoxylin)染成蓝色,棕色细胞为TfR阳性细胞,MOCK为未使用SARS-CoV-2感染的对照组织。用SARS-CoV-2感染后,两种动物肺组织的棕色加深,表明TfR的表达水平升高。
该研究使用了hTfR小鼠和hACE2小鼠两种人源化转基因小鼠,hACE2小鼠将mACE2替换为hACE2,hTfR小鼠则将mTfR替换为hTfR。SARS-CoV-2对普通小鼠的感染、致病能力微弱,它的S蛋白不易结合mACE2、mTfR。
2、ELISA测定和SPR分析表明,完整的SARS-CoV-2 S(Spike)蛋白或S中的RBD都可与TfR直接作用、结合。SARS-2 S蛋白与TfR的结合亲和力,稍弱于其与ACE2的结合亲和力;完整S蛋白的TfR结合亲和力,比S-RBD的TfR结合亲和力高大约15倍,这表明,S蛋白RBD之外的区域也与TfR发生作用。
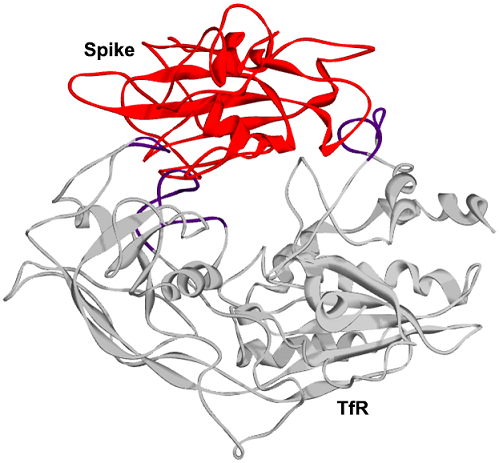
SARS-2 S(红色)、TfR(灰色)复合体的3D结构
ELISA:enzyme-linked immunosorbent assay,酶联免疫吸附测定;
SPR:Surface plasmon resonance,表面等离子共振。
3、SPR及PAGE分析表明,TfR也可直接与ACE2相互作用、结合,SARS-2 S、TfR、ACE2三者可结合形成三元复合物。
PAGE,polyacrylamide gel electrophoresis,聚丙烯酰胺凝胶电泳,以聚丙烯酰胺凝胶作为支持介质的一种常用电泳技术,用于分离不同的蛋白质(或多肽、寡核苷酸)。
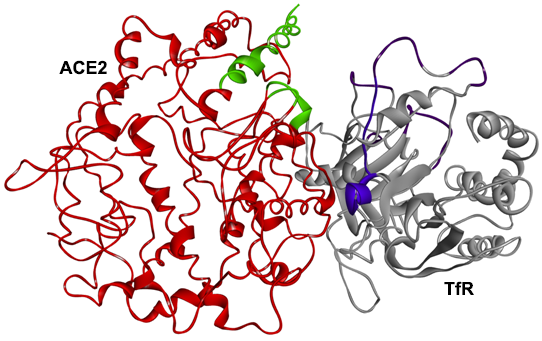
TfR(灰色)、ACE2(红色)复合体的3D结构
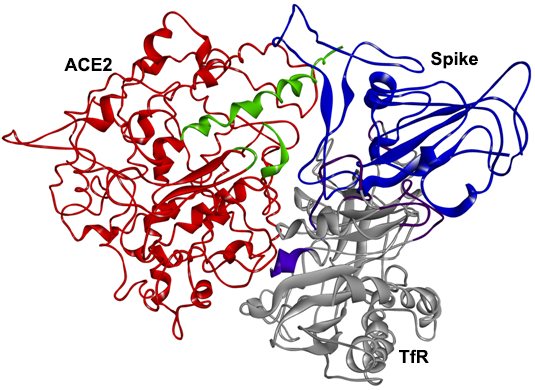
TfR(灰色)、ACE2(红色)、SARS-2 S(蓝色)复合体的3D结构
4、一种(该研究)设计的多肽SL8(SKVEKLTL)可同时干扰TfR-ACE2和TfR-Spike相互作用,干扰TfR-ACE2-Spike三元复合体的形成。
5、就Vero E6(非洲绿猴肾细胞系)细胞进行相关检测、实验,结果如下:
TfR在Vero E6细胞膜上高密度表达;
TfR与ACE2共定位于感染和未感染SARS-CoV-2的Vero E6细胞膜上;
在SARS-2感染的Vero E6细胞膜上观察到TfR与SARS-2 S的显著共定位(图I),以及TfR、ACE2、SARS-2 S三者的共定位(图J);
在被SARS-CoV-2感染的Vero E6细胞的细胞质中仅观察到TfR与SARS-2 S的共定位(未观察到ACE2与SARS-2 S,及TfR与ACE2的共定位),这表明,与SARS-CoV-2共同从细胞膜内化、转运至细胞质的是TfR,而非ACE2。
观察到X与Y共定位,指观察到X、Y结合形成的复合体。
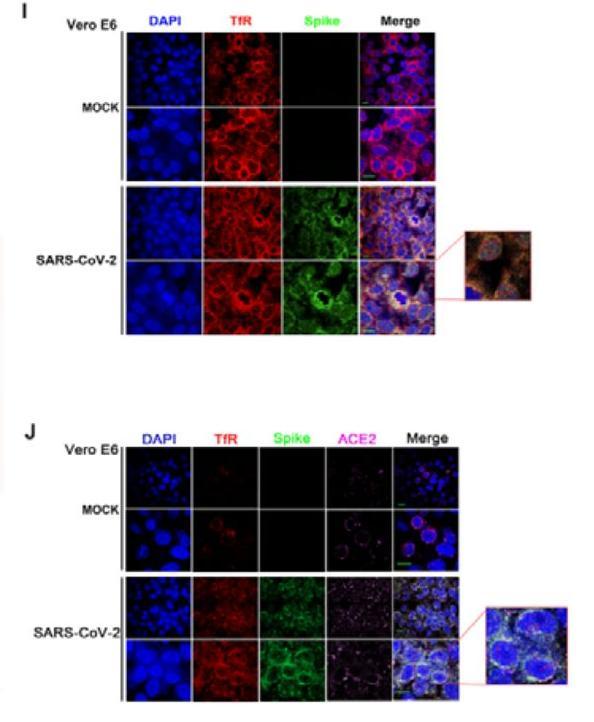
图I:用anti-TfR、anti-Spike抗体标记对应蛋白,观察Spike-TfR共定位;
图J:用anti-TfR、anti-ACE2、anti-Spike抗体标记对应蛋白,观察Spike-TfR-ACE2共定位。
关于图中各列,
DAPI,表示用DAPI染色、标记细胞核。DAPI:4′,6-diamidino-2-phenylindole,4',6-二脒基-2-苯基吲哚,一种用于DNA和细胞核染色的蓝色荧光染料,与双链DNA结合后可以产生比DAPI自身强20多倍的蓝色荧光;
TfR,表示用anti-TfR染色、标记TfR;
Spike,表示用anti-Spike染色、标记SARS-CoV-2的Spike(即S蛋白);
ACE2,表示用anti-ACE2染色、标记ACE2;
Merge,表示同时染色、标记TfR、Spike(图I),或同时染色、标记TfR、Spike、ACE2(图J)。
关于图中各行,
MOCK,表示未用SARS-CoV-2感染的对照组Vero E6细胞,二行MOCK可能代表两组对照细胞,或对照细胞的两组图像;
SARS-CoV-2,表示用SARS-CoV-2感染的Vero E6细胞,二行SARS-CoV-2可能代表两组感染细胞,或感染细胞的两组图像。
图I、图J的区别是,图I未染色、标记ACE2,图J染色、标记了ACE2。
关于实验结果,
图I,
未用SARS-CoV-2感染时,在Merge列同时观察到蓝色的细胞核和红色的TfR;
使用SARS-CoV-2感染时,在Merge列同时观察到蓝色的细胞核、红色的TfR,及与Spike形态吻合的结构(看不到明显的绿色)。
图J,
未用SARS-CoV-2感染时,在Merge列同时观察到蓝色的细胞核、红色的TfR、紫色点状的ACE2;
使用SARS-CoV-2感染时,在Merge列同时观察到蓝色的细胞核、红色的TfR、紫色点状的ACE2,及与Spike形态吻合的结构。
笔者感觉肉眼很难识别图J Merge列中的ACE2。论文对图I、图J未提供细节说明,上述“关于实验结果”相关内容为笔者个人理解和推测。
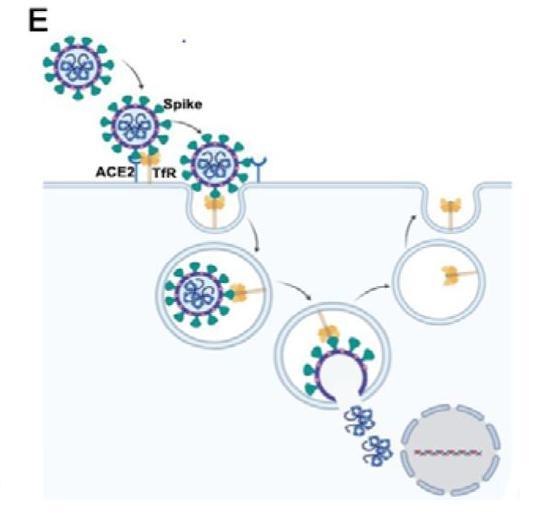
TfR与Spike结合,介导SARS-2进入细胞并与之共同内化至细胞质示意图
6、可溶性TfR、Tf(transferrin,转铁蛋白)、anti-TfR抗体和SL8多肽都显著抑制了SARS-CoV-2对Vero E6细胞的感染;
注:
可溶性TfR可结合、消耗SARS-CoV-2 S蛋白,减少其与细胞膜表面TfR的结合;
转铁蛋白(Tf)、anti-TfR可竞争、干扰SARS-CoV-2 S蛋白与细胞膜表面TfR的结合;
200nM anti-TfR抗体的抗SARS-2感染效果与高浓度(4μM)Remdeivir(瑞德西韦)相当(见图A的第一行和最后一行,1μM=1000nM);
(该研究)所设计的三种多肽显示出很强的SARS-2抑制能力(图H第二、三行及图J),在80μM浓度下,SL8、QK8和FG8分别抑制了87%、99%和75%的病毒感染(图H、J、K)。
三种多肽功能如下:
SL8同时干扰TfR-ACE2、TfR-Spike的相互作用;
QK8干扰TfR-Spike的相互作用;
FG8干扰TfR-ACE2的相互作用。
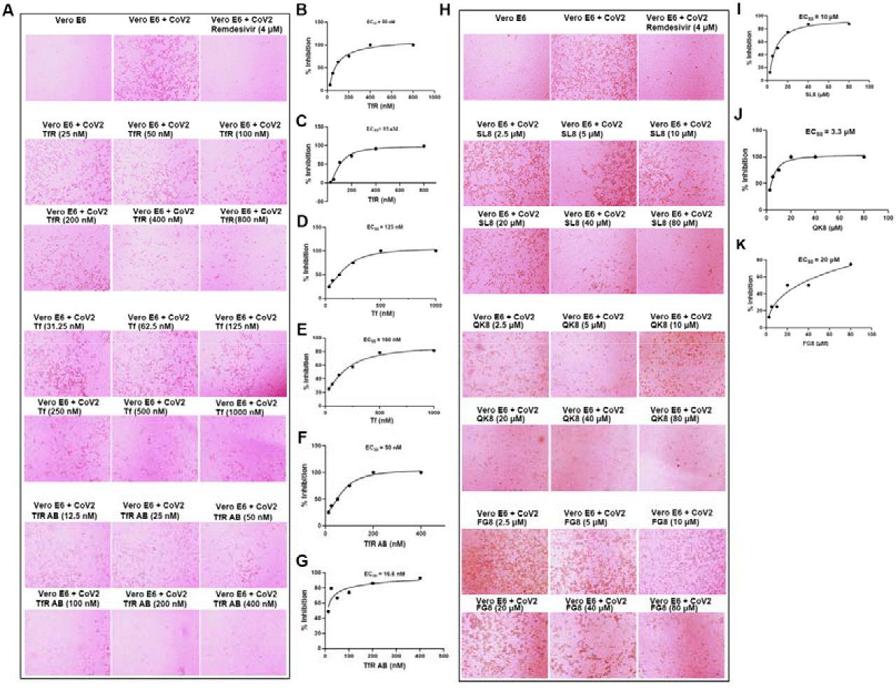
图A中的TfR AB,指TfR antibody,即anti-TfR抗体。
7、SARS-CoV-2可感染敲除了ACE2的Vero E6细胞和A549细胞;同时,anti-TfR抗体近乎消除了SARS-CoV-2对这两种ACE2敲除细胞的感染(下图C、D)。这表明,在没有ACE2的情况下,介导SARS-CoV-2感染Vero E6、A549细胞的很可能是TfR。
此外,TfR过表达促进SARS-CoV-2感染ACE2敲除的Vero E6细胞,如果同时敲除细胞中的ACE2和TfR,则SARS-CoV-2对Vero E6细胞的感染将受到极大抑制(下图E、F)。这表明,SARS-CoV-2对ACE2敲除的Vero E6细胞的感染,确实是由TfR介导的,TfR是一种独立于ACE2的SARS-CoV-2感染受体。
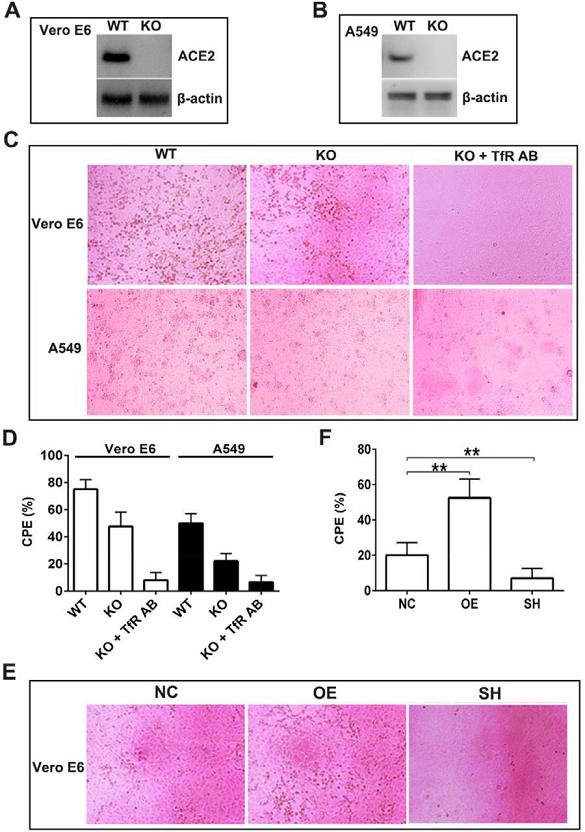
图A:用蛋白质印迹法确认Vero E6细胞的ACE2敲除。
图B:用蛋白质印迹法确认A549细胞的ACE2敲除。
图C:SARS-CoV-2感染6组细胞的显微镜图像。由图可见,anti-TfR抗体近乎消除了SARS-CoV-2对ACE2敲除的Vero E6、A549细胞的感染。
WT,wild-type,野生型,代表未作人为基因加工、改造的细胞;
KO,knockout,敲除,对应敲除了ACE2基因的细胞;
KO+TfR AB,对应敲除了ACE2,且用anti-TfR预处理过的细胞;
图D:通过量化图C中的CPE视觉结果来评估、对比SARS-CoV-2对6组细胞的感染效果。
CPE,Cytopathic effect,细胞病变效果或细胞病变程度。
图E:SARS-CoV-2感染TfR过表达或TfR敲除的ACE2敲除Vero E6细胞的显微镜图像。由图可见,SARS-CoV-2对TfR、ACE2同时敲除的Vero E6细胞几乎没有视觉可见的感染效果。
图E中的三组细胞皆为敲除了ACE2的Vero E6细胞。
NC,对照组(control)细胞,对应敲除了ACE2,但对TfR未作处理的Vero E6细胞;
OE,over-expression,过表达,对应通过基因转染提升了TfR表达水平,同时敲除了ACE2的Vero E6细胞;
SH,可能是shield(屏蔽)的缩写,对应同时敲除了TfR、ACE2的Vero E6细胞。
图F:通过量化图E中的CPE视觉结果来评估、对比SARS-CoV-2对3组ACE2敲除细胞的感染效果。
8、hTfR(human TfR)使不易感染SARS-CoV-2的小鼠易于被感染,且症状较为严重。相比野生型小鼠,hTfR小鼠肺组织中的病毒载量(Viral Loads)大幅提升(图A),体重显著下降(图B),并出现严重的血管充血和出血症状(图C)。
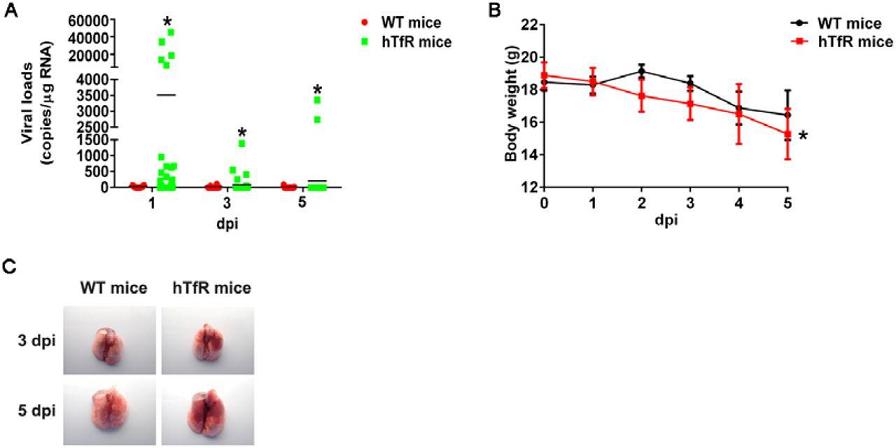
SARS-CoV-2对WT mice、hTfR mice的感染、致病差异
图A:感染后第1、3、5天,WT mice、hTfR mice肺组织中的病毒载量。
图B:感染后第1~5天,WT mice、hTfR mice的体重变化。
图C:感染后第3、5天,WT mice、hTfR mice的肺标本照片。
dpi,day post inflection,感染后天数。
上述实验表明,相比小鼠TfR,SARS-CoV-2 S蛋白更适宜结合人类TfR。一个对应事实是:SARS-CoV-2 S蛋白最适宜结合hACE2,SARS-2 S蛋白与hACE2的结合亲和力,强于所有已对照的物种ACE2。人类是SARS-CoV-2的最佳感染对象。
9 、anti-TfR抗体对hTfR小鼠表现出良好的抗SARS-CoV-2效果。
施用anti-TfR大幅降低了hTfR小鼠肺组织中的病毒载量,而施用IgG抗体没有获得抑制效果(图A);
施用anti-TfR降低了hTfR小鼠体重下降幅度(图B);
肺组织切片病理学检查表明,施用anti-TfR的hTfR小鼠肺组织病理损伤显著减轻,没有样本出现对照组hTfR小鼠典型的间质性肺炎(interstitial pneumonia)症状(图C、D)。
IgG,Immunoglobulin G,免疫球蛋白G抗体。
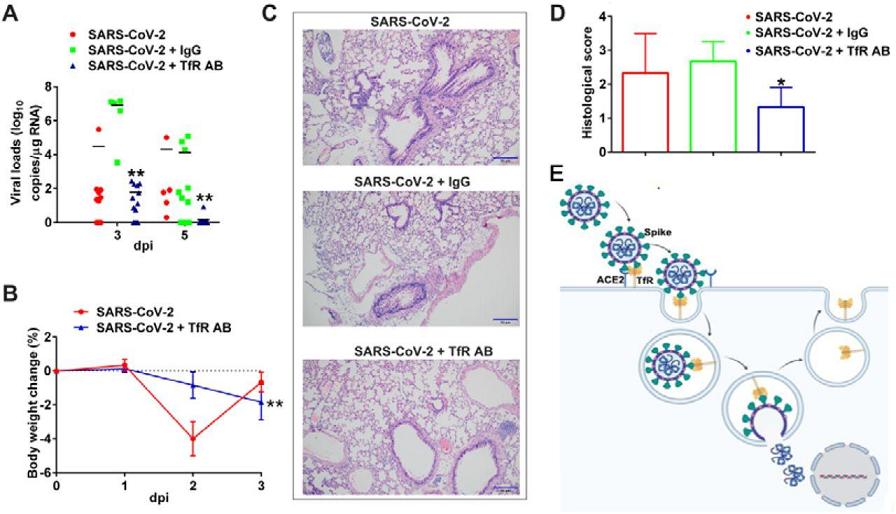
Anti-TfR抗体抑制SARS-CoV-2对hTfR小鼠的感染、致病
图A:施用anti-TfR(TfR AB)、IgG、未施用抗体三种情况下的hTfR小鼠肺组织病毒载量。由图可见,感染后第五天,anti-TfR施用组的病毒载量相比未施用组下降了5个对数级,即降低了10^5倍;IgG施用组病毒载量未见降低。
图B:anti-TfR施用组、未施用组hTfR小鼠的体重变化。
图C:感染后第5天anti-TfR施用组、IgG施用组、未施用抗体组hTfR小鼠肺组织切片的病变染色分析图象。
图D:对图C中肺组织病变视觉结果的量化评估、对比。
Histological score,组织学评分,应指组织病变评分,分值越高,病变越严重。
图E:TfR与Spike结合,介导SARS-2进入细胞并与之共同内化至细胞质。
论文依据二
Ferristatin II Efficiently Inhibits SARS-CoV-2 Replication in Vero Cells
Ferristatin II有效抑制Vero细胞中的SARS-CoV-2复制
https://www.mdpi.com/1999-4915/14/2/317
这项研究使用TfR1降解剂ferristatin II抑制/阻断了SARS-CoV-2对Vero细胞的感染、复制,验证了TfR1对SARS-CoV-2感染的介导作用。该研究还表明,TfR1不仅介导SARS-CoV-2感染,还促进SARS-CoV-2复制。
TfR1降解剂ferristatin II(NSC8679)是一种小分子化合物,它通过制霉菌素(Nystatin)敏感的脂筏途径降解TfR1。脂筏(lipid raft)是质膜(细胞膜)上富含胆固醇和鞘磷脂的动态微结构域。
论文指出:
1、TfR1小分子降解剂ferristatin II显著抑制了SARS-CoV-2 Wuhan D614G毒株和Delta毒株对Vero细胞(Vero-CCL81)的感染,半数抑制浓度(IC50)分别为26.5µM、40.4µM(图A);当浓度达到100µM时,ferristatin II可使D614G、Delta在Vero细胞中的复制完全中止(细胞上清液中的病毒滴度降至qRT-PCR有效RNA检测值的下限)(图B)。
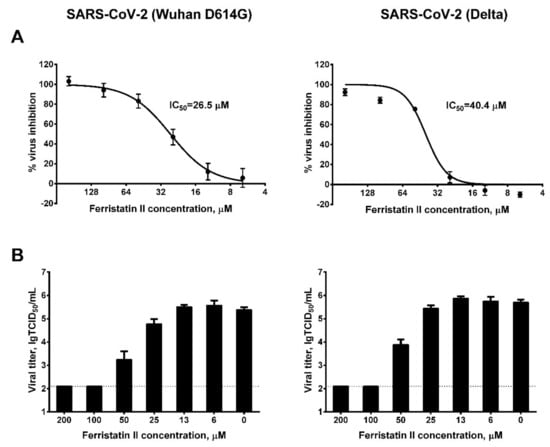
图A:不同浓度ferristatin II对D614G、Delta的抑制度;
图B:不同浓度ferristatin II对细胞上清液中D614G、Delta(相对)滴度的影响。
纵坐标约为2的水平虚线代表RNA检测值的下限。
IC50,half(50%)maximal inhibitory concentration,半数抑制浓度,获得50%最大抑制效果所需的药剂浓度;
TCID50:half(50%)tissue culture infectious dose,半数组织培养物感染剂量,使半数培养细胞发生感染、病变或死亡所需的病毒剂量。
µM,µmol/L,微摩尔/升,1µM=10^-6mol/L。
2、ferristatin II对Omicron变体的抑制效果更显著。如下图所示,6.25µM浓度的ferristatin II即可使细胞上清液中的Omicron滴度下降10倍(滴度对数值从6降到5,对应滴度值下降10倍),50µM的ferristatin II即可使Omicron完全停止复制。
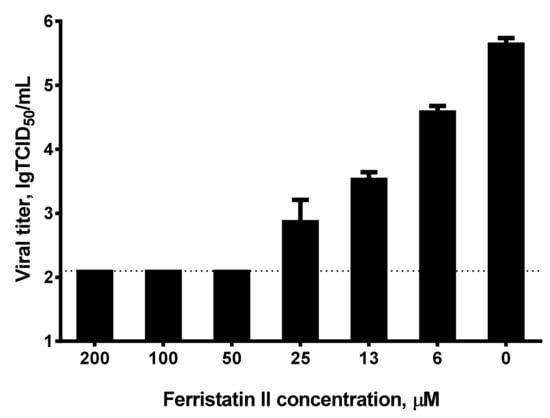
按照论文说明,2、3中的实验需要ferristatin II与Vero细胞持续共存于培养基中(按论文所言,这也是ferristatin II降解TfR1的通常条件),仅在细胞预处理阶段使用ferristatin II,或者,不使用ferristatin II预处理细胞,而是将ferristatin II与SARS-CoV-2同时施用于Vero细胞,都观察不到上述实验效果。
3、检查了ferristatin II的细胞毒性,如下图所示,培养基中ferristatin II浓度即使高达400µM,48小时内对细胞活力(viability)也没有负面影响,这表明ferristatin II对SARS-CoV-2复制的抑制效果不是ferristatin II的细胞毒性,及细胞毒性引起的细胞代谢障碍所致。
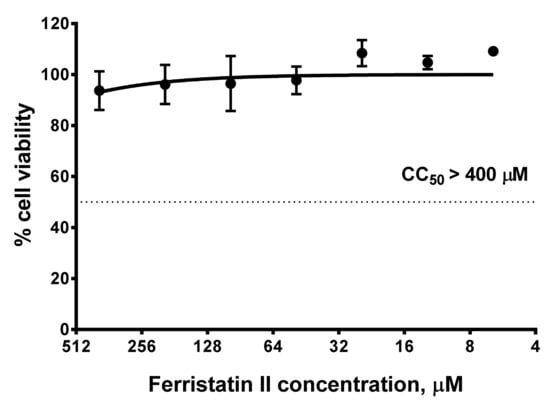
<=400µM浓度的ferristatin II48小时内不会抑制细胞活力
4、用100µM ferristatin II处理Vero细胞18小时后施加SARS-CoV-2,发现TAMRA标记的SARS-2-RBD弥漫性地分布在Vero细胞表面,仅有一小部分成簇的TAMRA信号与DAPI染色的细胞核重叠(进入细胞),如下面的共聚焦图像末排所示。这表明,ferristatin II(通过降解TfR1)阻止了SARS-CoV-2进入细胞(SARS-2 RBD或S蛋白可能与细胞表面的其它因子结合,但未能进入细胞)。(SARS-CoV-2为什么没有利用ACE2进入Vero细胞???)
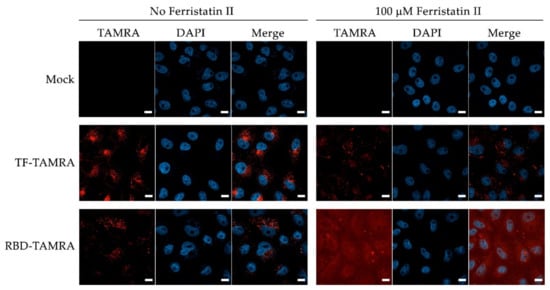
ferristatin II阻止SARS-CoV-2进入Vero细胞
TAMRA,Tetramethylrhodamine,四甲基罗丹明,一种染色、标记蛋白质、核酸和其他生物分子的红色荧光染料;
DAPI,一种用于DNA和细胞核染色、标记的蓝色荧光染料,前面作过介绍;
Merge,表示同时使用TAMRA和DAPI染色相应对象(Mock除外);
Mock,模拟、未处理,表示未使用TAMRA染色、标记SARS-2-RBD或转铁蛋白(Tf);
TF-TAMRA,表示用TAMRA染色、标记转铁蛋白(Tf);
RBD-TAMRA,表示Vero细胞与SARS-CoV-2共同培养,且培养前SARS-2-RBD已用TAMRA染色、标记;
左图各实验未使用ferristatin II。
左图第一排,Vero细胞的细胞核用DAPI染色;
左图第二排,转铁蛋白(Tf)用TAMRA染色,细胞核用DAPI染色,红色的转铁蛋白与蓝色的细胞核共同出现在Vero细胞内;
左图第三排,Vero细胞与SARS-CoV-2共同培养,培养前SARS-2-RBD已用TAMRA染色,细胞核已用DAPI染色,红色的SARS-2-RBD与蓝色的细胞核共同出现在Vero细胞内;
右图各实验使用100µM ferristatin II预处理Vero细胞18小时,其它情况与左图对应实验相同。
右图第一排,Vero细胞的细胞核用DAPI染色,共聚焦图像与左图第一排大体一致;
右图第二排,转铁蛋白(Tf)用TAMRA染色,细胞核用DAPI染色,相比左图第二排,出现在细胞内的红色转铁蛋白显著减少(ferristatin II降解了Tf进入细胞所需的TfR1);
右图第三排,已施加ferristatin II的Vero细胞与SARS-CoV-2共同培养,SARS-2-RBD用TAMRA染色,细胞核用DAPI染色,共聚焦图像与左图第三排截然不同,红色的SARS-2-RBD弥漫性分布在细胞表面,未进入细胞内(ferristatin II降解了SARS-2进入细胞所需的TfR1)。
论文依据三
A Possible Way to Relate the Effects of SARS-CoV-2-Induced Changes in Transferrin to Severe COVID-19-Associated Diseases
SARS-CoV-2引发的转铁蛋白改变效应与严重COVID-19相关疾病之间的一种可能关联
https://www.mdpi.com/1422-0067/23/11/6189
论文指出:
SARS-CoV-2可能通过与转铁蛋白(Tf)结合,诱导Tf发生热力学变化,热稳定性降低,Fe3+摄取能力被抑制,Tf保持在无铁的apo构象状态(Apo-Transferrin,脱铁转铁蛋白),机体内产生过量的游离铁(未与转铁蛋白等铁代谢蛋白结合的铁离子),过量游离铁的毒性造成红细胞生成紊乱(这可能是SARS-CoV-2引起红细胞生成紊乱的内在机制)。
论文没有解释、说明SARS-CoV-2与转铁蛋白(Tf)结合的细节,笔者猜测,这一结合可能指SARS-CoV-2 S蛋白通过结合转铁蛋白受体(TfR)间接结合与TfR结合的转铁蛋白(Tf)。笔者没有查阅到SARS-CoV-2直接结合转铁蛋白(Tf)的论文依据。
论文依据四
Transferrin Receptor Protein 1 Cooperates with mGluR2 To Mediate the Internalization of Rabies Virus and SARS-CoV-2
转铁蛋白受体蛋白1与mGluR2配合介导狂犬病病毒和SARS-CoV-2的内化
https://journals.asm.org/doi/10.1128/jvi.01611-22
论文研究、比照了两种人类受体(TfR1、mGluR2)在两种病毒(RABV、SARS-CoV-2)内化过程中的作用,展示了RABV、SARS-CoV-2利用TfR1、mGluR2达成感染的机制关联性。
RABV:rabies virus,狂犬病病毒。
病毒内化(Virus Internalization),指完成受体结合,附着到细胞膜上的病毒,病毒粒子或其RNA进入细胞内的过程。病毒内化可通过细胞整体内吞病毒粒子,或病毒包膜与细胞膜直接膜融合后向细胞内释放病毒RNA等方式来实现。受体结合+内化=达成感染/细胞进入。
mGluR2,metabotropic glutamate receptor subtype 2,代谢型谷氨酸受体亚型2,是代谢型谷氨酸受体(mGluR)的8种亚型之一。和前面提到的AChR/nAChR一样,mGluR也是神经元受体,且是人体内最重要的神经递质受体之一,它结合谷氨酸,负责兴奋性神经信号的传递。
论文指出:
1、mGluR2在体外充当RABV的进入受体,并且是SARS-CoV-2体外和体内的重要内化因子;
2、mGluR2促进RABV体外内化和体内感染;
3、转铁蛋白受体1(TfR1)与mGluR2相互作用,并在同一个网格蛋白包被的凹坑中与mGluR2和RABV内化。TfR1的敲低会阻止激动剂触发的mGluR2内化;
4、重要的是,TfR1还与SARS-CoV-2 S蛋白相互作用,对于SARS-CoV-2内化很重要;
5、我们的研究结果确定了RABV和SARS-CoV-2用于细胞进入的新轴(mGluR2-TfR1轴),并表明TfR1可作为RABV和SARS-CoV-2治疗的潜在靶点。
如前所述,SARS-CoV-2与狂犬病病毒(RABV)有3种共同的感染受体/细胞进入因子:TfR1、nAChR、mGluR2,二者负责结合nAChR的序列片断相似,二者都具有神经毒性。TfR1、nAChR是SARS-CoV-2的感染受体, mGluR2是SARS-CoV-2的重要内化因子,TfR1、nAChR、mGluR2都是RABV的感染受体,RABV约有5种已知的感染受体。SARS-CoV-2可能借鉴了RABV的感染、致病机制,并参照了RABV结合nAChR的序列/多肽结构。
相关论文
1、
COVID-19-Related Coagulopathy—Is Transferrin a Missing Link?
COVID-19相关凝血病——转铁蛋白是缺失的一环吗?
https://www.mdpi.com/2075-4418/10/8/539
2、
COVID-19 Attacks the 1-Beta Chain of Hemoglobin to Disrupt Respiratory Function and Escape Immunity by Capsid-Like System
COVID-19攻击血红蛋白1-β链,破坏呼吸功能并通过衣壳样系统逃避免疫
https://chemrxiv.org/engage/chemrxiv/article-details/63d134df6bc5ca30b61a9d64
3、
Transferrin Receptor Protein 1 Is an Entry Factor for Rabies Virus
转铁蛋白受体蛋白1是狂犬病病毒的一种(细胞)进入因子
https://journals.asm.org/doi/10.1128/jvi.01612-22
(未完待续)



















