| 印軍已占領中國領土百萬寸魏鳳和咋整? |
| 送交者: Pascal 2020年09月06日14:17:01 於 [五 味 齋] 發送悄悄話 |
|
一個殘酷的現實是,這次被印度占領的班公湖南岸的 黑頂山戰略位置極為重要。1962年,在對印自衛反擊 戰當中,解放軍用82人傷亡的代價才拿下了這個山頭。 而如今這個山頭已經失守,現在已經有大批的印度軍隊駐紮, 還有一個團的坦克兵力在附近虎視眈眈。
據印度媒體報道,搶占黑頂區域的印度士兵已經將中方的 監控設備全部清除,並已經形成居高臨下之勢, 將解放軍的動向盡數掌握。 不得不說,印度軍隊已經做了精心的準備工作。
而如果再像過去中印對峙那樣依靠冷兵器時代, 用我們的解放軍的血肉之軀去奪回這片高地顯然是很困難的。 從3日印度媒體報道的雙方的坦克已經相互進入射程之內 就可以看出,其實我軍已經退無可退了。
http://shizheng.xilu.com/20200906/1000010001144640.html
https://card.weibo.com/article/m/show/id/2309404545448731082928?_wb_client_=1&object_id=1022%3A2309404545448731082928&extparam=lmid--4545448734362633&luicode=10000011&lfid=231522type%3D1%26t%3D10%26q%3D%23%E5%8D%B0%E5%BA%A6%23&featurecode=newtitle 如果中國前進路上,一定要找一塊磨刀石, 那印度就是最好的料。武統台灣的話,畢竟還是自己人。
如果中印之仗不可避免,那麼中國只能“以打促和”, 依次達成四個戰略目標: 第一,讓印度充分認清,中國以戰止戰的決心、意志和能力,
第二,收復部分或全部被占領土,對歷史有個交代,增強民族凝聚力。第三,占據對印地緣更大優勢,對新德里形成更大威懾。第四,把印度徹底打蔫,提前搞定“龍象之爭”。希望印度好自為之。
https://weibo.com/ttarticle/p/show?id=2309404545101551763610
咱家裡有一個人,曾經代表中國革命的前進方向, 但他後來背叛了革命,成了人民的叛徒, 面對帝國主義卑躬屈膝,面對人民群眾窮凶極惡。 從背棄孫中山先生,背棄三民主義開始, 這個人就已經死了,他的屍體在咱家院子裡 曬了四十四年了,但因為沒有入殮, 就總有一些蒼蠅嗡嗡地給它招魂, 還有一個跳梁小丑圍着屍體墳頭蹦迪,丟人現眼。 在這具屍體上,承載了太多太多中國人民的 苦痛和鮮血了,他被帝國主義刻下的傷痕, 到現在還在隱隱作痛, 只有讓這具屍體體面地謝幕, 我們才能更好地向明天出發。 71年了,是時候把這具屍體釘死在棺材裡了。
https://weibo.com/ttarticle/p/show?id=2309404546283875467456
https://twitter.com/Julya52664 779/status/1302201955708579840
所以我們不主動惹事,但也要作好一切防備, 正如中共國防部部長陸軍上將魏鳳和同志這次 在莫斯科會晤辛格時所表示的那樣, “中國的領土一寸也不會丟!”
http://shizheng.xilu.com/20200905/1000010001144635_4.html
2020年9月6日 路德時評(路冠康談)1詳細解讀一篇發表在著名醫學期刊《醫學病毒學》上的論文,它是由來自十二個國家的許多作者共同編輯撰寫,並通過同行評議後正式發表的一篇論文(該論文中文翻譯版詳見Gnews新聞2)。 該論文直接針對目前科學界對於新型冠狀病毒起源於蝙蝠冠狀病毒,特別是RaTG13的普遍共識發出質疑,從而讓業界思考新冠病毒近端起源的問題,該論文主要內容總結如下:
該論文是由全球十二個國家的多位科學家參與撰稿完成的,他們在論文中都附上個人資訊,這舉動是在為病毒來自實驗室的結論進行背書。該論文屬於中短篇幅,其討論形式和論文結構都非常少見,應該是多位科學家共同參與討論並對上述觀點達成共識後共同發表。 這篇文章雖然短小,但是極具里程碑意義,這意味着閆博士將病毒真相公布於眾之後,有更多科學家開始甦醒,科學界開始彰顯正義的力量,這股力量將突破強權的威脅和金錢的誘惑,相信絕地大反攻即將開啟。 路德社透露閆博士將公布最新重磅病毒報告,其中的內容和證據對CCP將是致命一擊,任何惡勢力都不能掩蓋住真相的傳播,爆料革命的霹靂之夢將再次成為現實。
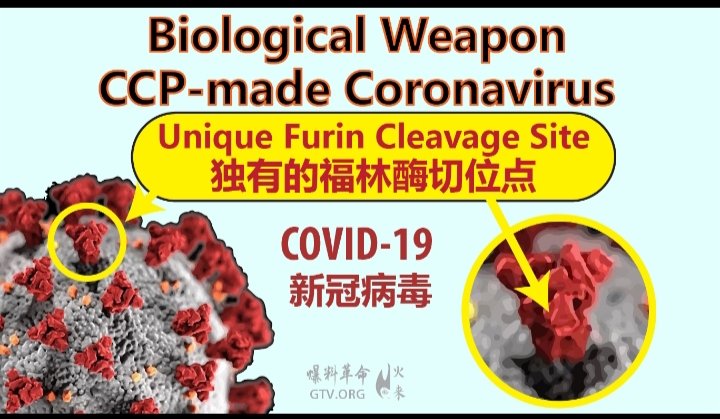
美東時間9月5號,全球權威科學雜誌《醫學病毒學雜誌》發表了一篇名為《有關SARS-CoV-2近端起源的問題》的文章,該文章進入排版發布階段。來自美國、瑞士、奧地利、北愛爾蘭、印度、新西蘭等共十二個國家,包括來自奧地利維也納大學自然與技術科學、惡性腫瘤和自身免疫的穆拉特·塞蘭博士在內的共二十一位動物學、生物學、傳染病毒學等多名權威專家及專業人士參與了該文章的撰寫。 該文章認為病毒載體SARS-CoV-2起源於蝙蝠冠狀病毒,但與其他CoV(冠狀病毒)相比,SARS-CoV-2宿主的向性和適應性模式存在明顯差異。SARS-CoV-2穗蛋白(S蛋白)的唾液酸結合結構域的平坦且不凹陷的表面,與所有其他CoV(冠狀病毒)所觀察到的一般適應性和生存模式相互矛盾。與RaTG13(蝙蝠冠狀病毒)不同,SARS-CoV-2重組可能發生在S蛋白的S1和S2結構域之間,從而可以利用宿主弗林蛋白酶。儘管全球已記錄了數百萬例病例,但SARS-CoV-2的S蛋白沒有任何明顯的進一步重組記錄,使其與其他CoV的重組模型相衝突。同樣,SARS-CoV-2的S蛋白受體結合域(RBD)也沒有出現高密度交叉傳播,從而使SARS-CoV-2與其他RBD中具有正選擇和適應突變的CoV存在明顯區別。 SARS-CoV-2的S蛋白無進一步重組記錄,S蛋白受體結合域也沒有出現高密度交叉傳播,證明SARS-CoV-2非自然進化而成。SARS-CoV-2通過人工“創造”而成,而具備人工“創造”條件的只有中共控制的各類病毒實驗室。英雄科學家閆麗夢博士於7月30號在WARROOM戰鬥室直播中提到的,SARS-CoV-2是中共解放軍實驗室獨家擁有的病毒,肆虐全球的CCP病毒是中共軍方的生化武器!
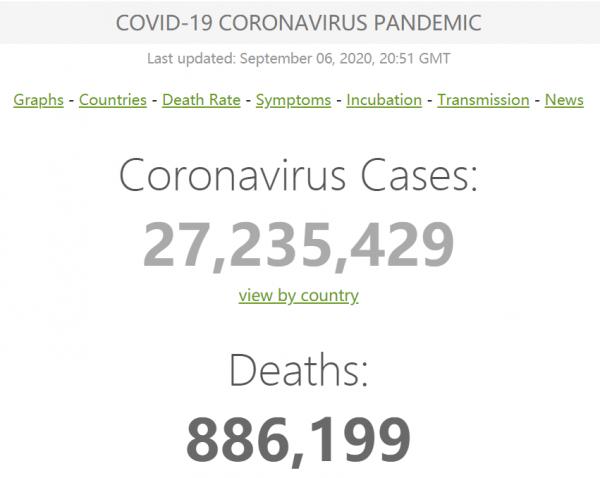
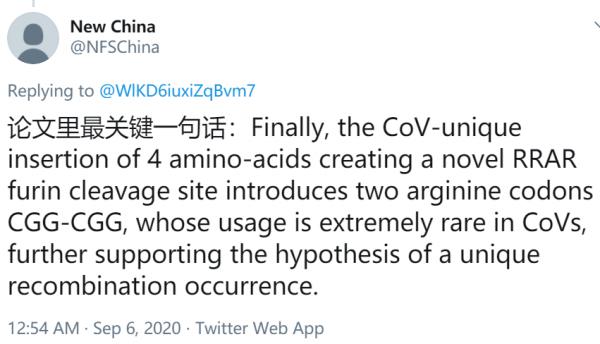
新聞簡述:9月3日著名醫學期刊《醫學病毒學》(Journal of Medical Virology)發表了數十位來自世界各地的科學家聯名致信該期刊主編的經同行評議過的信件。該文對新型冠狀病毒來源於蝙蝠冠狀病毒,特別是RaTG13的行業共識提出了質疑。新型冠狀病毒是第七種人冠狀病毒,但也是第一個且是唯一一個具備大流行潛力的人冠狀病毒。然而,其宿主取向/適應模式與其它冠狀病毒存在顯著差異,這就引起了關於新型冠狀病毒的近端起源的討論。 下載英文原文 (譯者註:所有內容均以英文原文為準) Letter to the Editor 致編者信函 Questions concerning the proximal origin of SARS-CoV-2 關於新型冠狀病毒近端起源的問題 This article has been accepted for publication and undergone full peer review but has not been through the copyediting, typesetting, pagination and proofreading process, which may lead to differences between this version and the Version of Record. Please cite this article as doi: 10.1002/jmv.26478. 這篇文章已被接收出版,並通過完整的同行評審,但未經編輯、排版、分頁和校對等過程,這可能會導致該版本與原版間產生差異。請將該文章引用為doi: 10.1002/ jvm .26478。 Keywords: Coronavirus, Genetic Variability, Mutation, Fusion Protein 關鍵詞 :冠狀病毒,遺傳變異,突變,融合蛋白 Summary: 總結: There is a consensus that Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) originated naturally from Bat coronaviruses (CoVs), in particular RaTG13. However, the SARS-CoV-2 host tropism/adaptation pattern has significant discrepancies compared to other CoVs, raising questions concerning the proximal origin of SARS-CoV-2. The flat and non-sunken surface of the sialic acid-binding domain of SARS-CoV-2 spike protein (S protein) conflicts with the general adaptation and survival pattern observed for all other CoVs. Unlike RaTG13, SARS-CoV-2 recombination presumably occurred between the S1/S2 domains of S protein enabling host furin protease utilization. Although millions of recorded cases have been recorded globally, SARS-CoV-2 S protein does not have any apparent further recombination, placing it in conflict with the recombination models of other CoVs. Similarly, the S protein receptor-binding domain (RBD) of SARS-CoV-2 has not accumulated high-frequency non-synonymous substitutions, differentiating SARS-CoV-2 from other CoVs that have positive selection/adaptation mutations in their RBDs. 有一個共識:嚴重急性呼吸綜合徵冠狀病毒2 (SARS-CoV-2)自然起源於蝙蝠冠狀病毒(CoVs),特別是RaTG13。然而,與其它冠狀病毒相比,SARS-CoV-2的宿主取向/適應模式存在顯著差異,這就引發了關於SARS-CoV-2近端起源的問題。SARS-CoV-2刺突蛋白(S蛋白)的唾液酸結合結構域平坦而非凹陷的表面與所有其它冠狀病毒的一般適應性和生存模式相違背。與RaTG13不同的是,SARS-CoV-2重組可能發生在S蛋白的S1/S2結構域之間,從而可以利用宿主弗林蛋白酶。儘管全球記錄了數百萬病例,但SARS-CoV-2 S蛋白沒有出現任何明顯的進一步重組,這使其與其它冠狀病毒的重組模型相違背。同樣,SARS-CoV-2的S蛋白受體結合域(RBD)並未積累高頻率非同義替代,這將SARS-CoV-2與其他RBDs選擇/適應性突變的冠狀病毒區別開來。 Discussion 討論 Andersen and colleagues documented the possible natural origin of SARS-CoV-2 from BatCoV RaTG13 1,2. SARS-CoV-2 is the seventh zoonotic CoV virus capable of infecting humans, but the first and only human coronavirus (HCoV) with pandemic potential 3. Bat or rodent CoVs demonstrate certain specific changes in the S protein receptor-binding domain (RBD), as well as the S protein glycan-binding N-terminal domain (NTD), during host tropism/adaptation 4,5. SARS-CoV-2, unlike other CoVs, does not have those signature changes, suggesting that these RBD and NTD subdomains are of very recent origin. Andersen和他的同事記錄了SARS-CoV-2可能的自然來源是蝙蝠冠狀病毒 RaTG13 1,2。SARS-CoV-2是第七種能夠感染人類的人畜共患冠狀病毒,但也是第一個且是唯一一個具備大流行潛力的人冠狀病毒(HCoV) 3。蝙蝠或嚙齒類動物的冠狀病毒在宿主向性/適應過程中,S蛋白受體結合域(RBD)和S蛋白多糖結合N端結合域(NTD)發生了特定的變化4,5。與其它冠狀病毒不同,SARS-CoV-2沒有這些特徵變化,這表明這些RBD和NTD子域是最近才出現的。 The “Canyon Hypothesis” explains the development of canyons, depression zones or cavities on the surfaces of influenza virus, human rhinovirus, and Meningo viruses 6 . In CoVs (except SARS-CoV-2), the S protein NTD domain has several predicted glycanbinding domains, with a common feature being the hidden localization of these glycan binding domains to cavities to limit their access to antibodies and immune cells 5 . This pattern of CoVs is thought to be an evolutionary measure to restrict the recognition of these active sites by host immune system 4 . “峽谷假說”解釋了流感病毒、人類鼻病毒和腦膜炎病毒表面的峽谷、凹陷區或空腔的發展6。在冠狀病毒(SARS-CoV-2除外)中,S蛋白NTD結構域有幾個可預測多糖結合域,其共同特徵是這些多糖結合域在腔中的隱蔽定位從而限制它們與抗體和免疫細胞接觸5。這冠狀病毒模式被認為是一種進化措施,以限制宿主免疫系統識別這些活性位點。 HCoVs can evade detection by host glycan-binding immune receptors. Comparative genomic analysis of six HCoVs with their corresponding native bat or rodent CoVs suggests compatibility with the “Canyon Hypothesis” resulting from various adaptive S protein NTD non-synonymous mutations near or at the glycan binding domain which are predicted to result in these NTD domains being hidden below the protein surface5 . The predicted flat, non-sunken pattern of the SARS-CoV-2 S protein NTD glycan binding domains conflicts with this evolutionary host tropism/adaptation strategy 7. 人冠狀病毒可以逃避宿主聚糖結合免疫受體的檢測。對六種人冠狀病毒及其相應的當地蝙蝠或齧齒動物冠狀病毒進行比較基因組分析表明,與多糖結合域附近的各種適應性S蛋白NTD非同義突變導致的“峽谷假說”具有相融性,預計這些突變會導致這些NTD域被隱藏在蛋白質表面之下5。預測的SARS-CoV-2 S蛋白NTD聚糖結合域的預測平坦、非凹陷模式與這種進化宿主趨向性/適應策略相違背7。 A template-switching mechanism is presumably responsible for the high rate of RNA recombination in CoVs. In host cells, CoV RNAs show discontinuous RNA synthesis materialized by pauses of the RNA-dependent complex and subsequent jumps to downstream template acceptor sequences. This process results in subgenomic minus strand RNAs which serve as templates for subgenomic mRNAs. Due to the mechanistic similarity to recombination, this process might be at the origin of recombinant CoVs co-opting other CoV or even host related sequences8. Instances include the mouse hepatitis coronavirus S protein NTD sialic acid binding domain, likely arising from recombination of viral RNA with human galectin RNA sequences 8. 一種模板轉換機制可能是冠狀病毒(CoVs)與 RNA高重組率的原因。在宿主細胞中,冠狀病毒RNA呈現出不連續的RNA合成,表現為依賴RNA的複合物間歇並隨後跳轉到下游模板受體序列。這一過程產生亞基因組負鏈RNA,作為亞基因組mRNA的模板。由於重組機制的相似性,這一過程可能是起源於重組冠狀病毒(CoV)吸收其它冠狀病毒(CoV)甚至宿主相關的序列8。例如,小鼠肝炎冠狀病毒S蛋白NTD唾液酸結合域,可能由病毒RNA與人乳糖蛋白RNA序列重組而產生8。 The furin recognition motif present at the SARS-CoV2 S1/S2 junction has no analogy in other “linage B” beta-coronaviruses, including neither pangolin-CoV nor RaTG13 1 . This indicates that the S protein S1/S2 junction is not a hot spot for RNA recombination termination that depends on a pattern swapping templates (copy-choice) 8 . Additionally, clinical isolates of SARS-CoV-2 S protein have not indicated any further recombination in this S1/S2 area, suggesting that the addition of a motif for S1/S2 site furin cleavage constituted a unique recombination occurrence. Finally, the CoV-unique insertion of 4 amino-acids creating a novel RRAR furin cleavage site introduces two arginine codons CGG-CGG, whose usage is extremely rare in CoVs, further supporting the hypothesis of a unique recombination occurrence. 在SARS-CoV2 S1/S2接合處存在的弗林蛋白酶識別基序在其他“linage B”-冠狀病毒中沒有類比,包括穿山甲冠狀病毒和RaTG13 1。這說明S蛋白S1/S2連接並不是RNA重組終止的熱點,RNA重組終止依賴於模式交換模板(copy-choice) 8。此外,臨床分離到的SARS-CoV-2 S蛋白在這個S1/S2區域沒有任何進一步的重組,這表明為S1/S2位點添加的基序弗林蛋白酶裂解構成了一個獨特的重組。最後,4個氨基酸在冠狀病毒(CoV)中獨特的插入,形成了一個新的RRAR弗林蛋白酶裂解位點,引入了兩個精氨酸密碼子CGG-CGG,這兩個精氨酸密碼子在冠狀病毒(CoVs)中使用極為罕見,進一步支持了發生獨特重組的假設。 HCoVs have high-frequency “hot spots” for non-synonymous amino acid replacements that can possibly create positive selection for host tropism/adaptation, resistance to neutralizing antibodies, or immune evasion 2 . Interestingly, clinical SARS-CoV-2 isolates to date have only a single high frequency non-synonymous mutation, D614G, in their S protein 9. Based on currently known mutation rates and patterns in clinical isolates of SARS-CoV-2, the S protein does not appear to be a mutational “hot spot” for SARSCoV-2, unlike other human CoVs. 人冠狀病毒(HCoVs)為非同義氨基酸提供高頻替換“熱點”,這些替換可能會趨向宿主趨同性/適應、而對中和抗體或免疫逃避產生抵抗2。有趣的是,迄今為止臨床分離的SARS-CoV-2在其S蛋白中只有一個高頻非同義突變,D614G9。對臨床分離株SARS-CoV-2,根據目前已知的變異率和模式, 不像其它人冠狀病毒,S蛋白似乎沒有SARS CoV-2突變的“熱點”。 SARS-CoV-2 is the seventh HCoV, but the first HCoV with pandemic potential. SARSCoV disappeared without a pandemic, and MERS-CoV is mostly endemic to the Arabian Peninsula with some additional limited traveler infections resulting in outbreaks in South Korea 3,4. These unique features of SARS-CoV-2 raise several questions concerning the proximal origin of the virus that require further discussion. SARS-CoV-2是第七種人冠狀病毒,卻是第一個具有大流行潛力的人冠狀病毒。非典在大流行前就消失了,MERS-CoV主要是阿拉伯半島的地方傳染病,另外還有部分有限的旅行者感染導致韓國爆發3,4。SARS-CoV-2的這些獨特特徵引發幾個有關該病毒近端起源的問題,還需進一步討論。 Author Contributions: 作者貢獻 M. S. conceived the study. A. M. B, V. N. U, A. L., and K. L. provided critical review. N. R., D. P., A. L. S. P. S.. V. N. U, K. L.T. M. A. edited the article, M. S., P. A., T. M. A. formatted the article. All authors M. S., D. P., P. A., T. M.A., S. S. H., A. S., R. K., K. L., D. M., M. T., A. L., P. P. C., V. N. U., S. P. S., B. D. U., N. R., A. M. B. and G. Z. K. of the consortium interpreted the results and approved the final version for submission. M. S. 構思該研究. A. M. B, V. N. U, A. L., and K. L. 進行重要審稿 N. R., D. P., A. L. S. P. S.. V. N. U, K. L.T. M. A.撰寫文章, M. S., P. A., T. M. A. 排版該文章 所有作者(M. S., D. P., P. A., T. M.A., S. S. H., A. S., R. K., K. L., D. M., M. T., A. L., P. P. C., V. N. U., S. P. S., B. D. U., N. R., A. M. B. and G. Z. K. )聯合解釋該結果並同意提交最終版本。 Competing Interests statement: The authors declare no competing interests. 利益衝突聲明:作者聲明沒有利益衝突。 References: 參考文獻: 1. Andersen KG, Rambaut A, Lipkin WI, Holmes EC, Garry RF. The proximal origin of SARS-CoV-2.NatMed.2020;26(4):450-452.doi:10.1038/s41591-020-0820-9; 2. Malaiyan J, Arumugam S, Mohan K, Gomathi Radhakrishnan G. An update on the origin of SARS-CoV-2: Despite closest identity, bat (RaTG13) and pangolin derived coronaviruses varied in the critical binding site and O-linked glycan residues [published online ahead of print, 2020 Jul 7]. J Med Virol. 2020;10.1002/jmv.26261. doi:10.1002/jmv.26261 3. Forni D, Cagliani R, Clerici M, Sironi M. Molecular Evolution of Human Coronavirus Genomes.Trends Microbiol. 2017;25(1):35-48. doi:10.1016/j.tim.2016.09.001 4. Hulswit RJ, de Haan CA, Bosch BJ. Coronavirus Spike Protein and Tropism Changes. Adv Virus Res. 2016;96:29-57. doi:10.1016/bs.aivir.2016.08.004 5. Li F. Receptor recognition mechanisms of coronaviruses: a decade of structural studies. J Virol. 2015;89(4):1954-1964. doi:10.1128/JVI.02615-14 6. Rossmann MG. The canyon hypothesis. Hiding the host cell receptor attachment site on a viral surface from immune surveillance. J Biol Chem.1989;264(25):14587- 14590. 7. Fantini J, Di Scala C, Chahinian H, Yahi N. Structural and molecular modelling studies reveal a new mechanism of action of chloroquine and hydroxychloroquine against SARS-CoV-2 infection. Int J Antimicrob Agents. 2020;55(5):105960. doi:10.1016/j.ijantimicag.2020.105960 8. Makino S, Keck JG, Stohlman SA, Lai MM. High-frequency RNA recombination of murine coronaviruses. J Virol. 1986;57(3):729-737. doi:10.1128/JVI.57.3.729-737.1986 9. Brufsky A. Distinct viral clades of SARS-CoV-2: Implications for modeling of viral spread [published online ahead of print, 2020 Apr 20]. J Med Virol. 2020;10.1002/jmv.25902. doi:10.1002/jmv.25902
|
|
|
 |
 |
| 實用資訊 | |
|
|
| 一周點擊熱帖 | 更多>> |
| 一周回復熱帖 |
| 歷史上的今天:回復熱帖 |
| 2019: | 幾千年來天朝人能吃飽飯能隨便吃肉也就 | |
| 2019: | 來自老大哥的明斯基,黑天鵝,背後捅刀 | |
| 2018: | 不要臉的海華為國內大老闆拉皮條 | |
| 2018: | 國內的飯局的確非常噁心,聊天的口水貼 | |
| 2017: | 本來薩德部署南韓遭遇重重阻攔。不但中 | |
| 2017: | 繼南韓部署薩德之後,川大總統最近又解 | |
| 2016: | 對對眼看大逆轉:Trump leading Clinto | |
| 2016: | 淡紫:對比一下,我的字和老爸的字 | |
| 2015: | 香椿樹:用俘虜數量推算消滅日軍數量 | |
| 2015: | 東東的體型自信是不容懷疑的,很可惜沒 | |