新冠病毒究竟源自何處,誰設計、製造了新冠病毒?
本文接續:
Ralph S. Baric的病毒改造與人工合成(序篇)
Ralph S. Baric(拉爾夫·巴里克),美國病毒學家,北卡羅來納大學教堂山分校微生物學和免疫學院流行病學系教授;Ralph S. Baric是國際頂級冠狀病毒研究權威,反向遺傳平台的發明者,無痕跡病毒改造技術的發明者,是最早人工合成冠狀病毒的科學家;他還是國際頂級功能增益研究權威,病毒功能增益性改造的積極力行、狂熱痴迷者。2021年4月,Ralph S. Baric入選美國國家科學院院士。
Ralph S. Baric(團隊)與新冠病毒存在多項、多組關聯關係。新冠病毒的多處特殊結構,多項特殊功能、特性,Ralph S. Baric(團隊)要麼專門研究過,要麼反覆研究過高度相關的內容;此外,Ralph S. Baric(團隊)在不同論文中對冠狀病毒的改造方向,對未來可能出現的冠狀病毒的功能、特性,做過多項預測和展望,其中至少四項,在新冠病毒身上神奇地應驗(、實現)了。
在Ralph S. Baric(團隊)與新冠病毒的多組、多項關聯關係中,存在一組雙紐帶關聯,這組關聯中的雙紐帶是指:
紐帶一:蝙蝠冠狀病毒WIV1(rs3367),自然界中已知的跨物種感染能力最強的冠狀病毒。
紐帶二:關鍵氨基酸,即冠狀病毒刺突蛋白RBD(Receptor Binding Domain,受體結合域)的5個特殊位點的氨基酸,它們決定冠狀病毒的刺突蛋白能否結合脊椎動物的ACE2受體,決定冠狀病毒能否進入(感染)某個物種的細胞,決定冠狀病毒的宿主範圍。
WIV1(rs3367)、關鍵氨基酸與新冠病毒、與Ralph S. Baric(團隊)都有非同一般的關聯,它們是串連Ralph S. Baric(團隊)與新冠病毒,揭示二者關係秘密的一對紐帶。
相關內容將順次通過以下六個部分展開:
I、WIV1(Rs3367)病毒
II、新冠、WIV1(rs3367)高度相似的強大跨物種感染能力、高度相似的宿主範圍
III、冠狀病毒刺突蛋白RBD的5個關鍵氨基酸
IV、新冠、WIV1(rs3367)關鍵氨基酸的高度關聯性、高度等價性
V、Ralph S. Baric團隊對WIV1(rs3367)的研究
VI、Ralph S. Baric團隊對關鍵氨基酸的研究
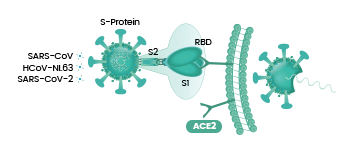
為方便讀者理解本文,先插貼一張冠狀病毒結構示意圖。
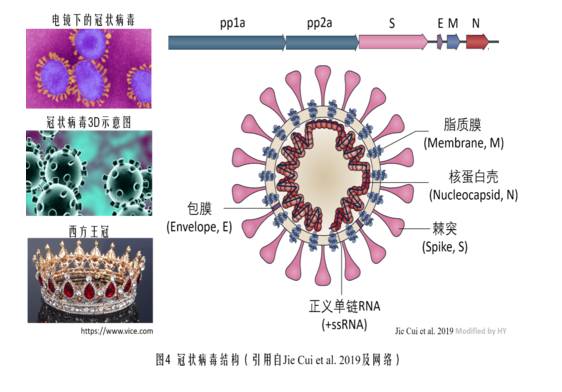
首先詳細介紹一下WIV1(Rs3367)病毒。
I、 WIV1(Rs3367)病毒
rs3367、WIV1,是一對“孿生”蝙蝠冠狀病毒。
rs3367,分離、分析自中華菊頭蝠(又稱中華馬蹄蝠)的腸道與糞便樣本(應該是分析出了基因序列,但沒有獲得有活性的病毒毒株),樣本收集地點是距雲南昆明約60公里的一處有多種蝙蝠混居的洞穴,收集時間是2012年3月。rs3367的全基因組序列於2013年4月8日上傳到NCBI(National Center for Biotechnology Information,美國國家生物技術信息中心) GenBank生物信息數據庫,實現了國際共享,其GenBank(ACCESSION) ID為: KC881006。
WIV1病毒也分離自中華菊頭蝠(中華馬蹄蝠)的腸道與糞便樣本(WIV1既有基因序列,又有分離出或培養出的有活性的病毒毒株),其樣本與rs3367采自同一蝙蝠洞穴,收集時間是2012年9月。2013年4月8日,WIV1的刺突蛋白(Spike蛋白,S蛋白)基因序列上傳至GenBank,實現了國際共享(同一天,石正麗團隊還上傳了rs3367、rsSHC014的全基因組序列),其GenBank ID為:KC881007;2013年7月8日,WIV1全基因組序列上傳至GenBank,實現了國際共享,其GenBank ID為:KF367457。在某些論文中,WIV1也稱為WIV1-CoV或SL-CoV-WIV1。
為什麼要一再強調基因序列的國際共享呢?因為對於病毒改造來說,最不可或缺的不是自然來源的病毒毒株,而是病毒的基因序列。有自然來源的病毒毒株當然更方便;對頂尖病毒學家來說,有沒有自然來源的病毒毒株區別不是很大,因為只要有病毒的基因序列,就可以在實驗室中合成該病毒的克隆毒株。
不晚於2000年,美國科學家已經掌握了使用反向遺傳技術,基於病毒的基因序列,方便、快捷、精確地合成冠狀病毒的cDNA、RNA,收穫冠狀病毒活性毒株的技術,這一技術的核心發明者就是Ralph S. Baric。
2003年10月28日,Ralph S. Baric團隊、美國陸軍傳染病醫學研究院、范德堡大學醫療中心在PNAS(美國國家科學院院刊)聯合發表了一篇論文:Reverse genetics with a full-length infectious cDNA of severe acute respiratory syndrome coronavirus(SARS病毒全長傳染性cDNA的反向遺傳學)。
https://www.pnas.org/content/100/22/12995

Ralph S. Baric是該論文的通訊作者。在該論文中,研究者使用他們命名的反向遺傳(克隆)平台,基於SARS病毒的基因序列,先合成了SARS病毒的cDNA(complementary DNA,互補DNA,RNA的DNA復製品),接着由cDNA轉錄出SARS的RNA,而後將RNA通過電穿孔釋放到Vero E6細胞(非洲綠猴腎細胞系細胞)中,最終成功收穫了SARS RNA在細胞中組裝出的具有生物活性(感染、複製能力)的SARS病毒克隆毒株。也就是說,Ralph S. Baric等人在SARS疫情發生的次年,就人工合成了SARS病毒的cDNA、RNA並收穫了SARS病毒的活性毒株克隆。
SARS病毒不是Ralph S. Baric人工合成的首個冠狀病毒。2000年11月,Ralph S. Baric等人在Journal of Virology發表了一篇論文:Strategy for Systematic Assembly of Large RNA and DNA Genomes: Transmissible Gastroenteritis Virus Model(大RNA和DNA基因組系統組裝策略:傳染性胃腸炎病毒模型)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC110934/
註:冠狀病毒基因組是自然界中最大、最長的單鏈正極性RNA基因組,人工合成冠狀病毒具有不同尋常的意義。

Ralph S. Baric仍是論文的通訊作者,該論文使用反向遺傳技術,基於病毒的基因序列,人工合成了豬傳染性胃腸炎病毒TGEV(Transmissible gastroenteritis virus)的cDNA並收穫了其活性毒株,這是Ralph S. Baric人工合成的首個冠狀病毒,也是人類首次人工合成冠狀病毒。論文還明確指出:構建TGEV的方法允許對冠狀病毒基因組進行精確的基因改造。
二年後的2002年11月,Ralph S. Baric等人又在Journal of Virology發表了另一篇論文:Systematic Assembly of a Full-Length Infectious cDNA of Mouse Hepatitis Virus Strain A59(小鼠肝炎病毒A59毒株全長傳染性cDNA的系統組裝)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC136593/
在該論文中,Ralph S. Baric等人再次使用反向遺傳技術,基於病毒的基因序列,人工合成了小鼠肝炎病毒MHV-A59的cDNA並收穫了其活性毒株。Ralph S. Baric依然是論文的通訊作者。
經常有人說,Ralph S. Baric(團隊)沒有蝙蝠冠狀病毒的毒株,不可能基於蝙蝠冠狀病毒進行病毒改造,不可能將蝙蝠冠狀病毒改造為新冠病毒;武漢病毒研究所是多種蝙蝠冠狀病毒的發現者和毒株唯一擁有者,因此,將蝙蝠冠狀病毒改造為新冠病毒的,肯定是武漢病毒研究所。
上述說法犯了三個錯誤。
第一,石正麗團隊從未發表過任何功能增益研究論文,從未對病毒進行過任何功能增益性改造,集多種跨科屬病毒功能於一身的新冠病毒,一定是功能增益研究經驗異常豐富的團隊設計、製造的,不可能出自功能增益研究經驗為0的石正麗團隊之手。
第二,石正麗團隊發現、分離的蝙蝠冠狀病毒毒株或病毒樣本,不只收藏於武漢病毒研究所病毒庫,它們還要提供給直接合作者(PREDICT項目)、直接資助者--達薩克為主席(首席執行官)的生態健康聯盟。達薩克為誰工作?為美國政府工作,生態健康聯盟背後的老闆、金主是美國國際開發署(USAID)和美國國立衛生研究院(NIH),將病毒毒株或病毒樣本提供給生態健康聯盟,就是將它們提供給美國。
第三,自2000年使用反向遺傳技術合成TGEV病毒後,特別是2003年反向遺傳平台已臻完善後,Ralph S. Baric團隊就不再依賴得自自然界的冠狀病毒毒株了,他們可以基於病毒基因序列,使用反向遺傳平台自行合成所需病毒毒株的克隆,使用人工合成的病毒毒株進行病毒研究、病毒改造。
反向遺傳平台不只是可以用來合成已有病毒的毒株克隆;對病毒的基因序列進行設計、改造後,使用反向遺傳平台,基於改造後的基因序列,同樣可以合成出新病毒的病毒毒株。反向遺傳平台實際上提供了一種精確的無痕跡病毒改造技術。
2004年後,Ralph S. Baric(團隊)在研究中使用的病毒,幾乎都是使用反向遺傳平台人工合成的;Ralph S. Baric(團隊)在“無數篇”論文中,“無數次”地使用反向遺傳平台,合成已有病毒毒株,或合成改造病毒的毒株。我以前的文章已經介紹過一些實例,本系列後續文章將展示更多的實例。
石正麗團隊能不能使用反向遺傳技術人工合成冠狀病毒?能。石正麗團隊是什麼時候掌握這一技術的?在2016年6月24日發表的一篇Journal of Virology論文中(署名作者包括達薩克),石正麗團隊宣布研發出了自己的反向遺傳系統,並首次應用該系統合成了三種病毒,其中之一是論文的研究對象WIV1。該論文標題為:Bat Severe Acute Respiratory Syndrome-Like Coronavirus WIV1 Encodes an Extra Accessory Protein, ORFX, Involved in Modulation of the Host Immune Response(蝙蝠類SARS冠狀病毒WIV1編碼一種額外的輔助蛋白ORFX,參與宿主免疫反應的調節)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4936131/
https://journals.asm.org/doi/10.1128/JVI.03079-15
註:這不是一篇功能增益研究論文,該論文未對WIV1進行功能增益性改造;論文記錄表明,石正麗團隊未發表過任何功能增益研究論文,未對任何病毒進行過功能增益性改造,未改造出過任何一種有人類致病能力的病毒。
石正麗團隊研發出反向遺傳系統(平台),首次人工合成冠狀病毒的時間,比Ralph S. Baric團隊晚了16年!
言歸原題。
WIV1、rs3367是一對極度相似的“孿生”蝙蝠冠狀病毒。二者全基因組序列的同一性或相似度為99.92% ;在決定物種感染能力及宿主範圍的S蛋白S1亞基部分,二者氨基酸序列同一性為100%。在不同論文中,有時使用rs3367,有時則使用WIV1,它們可以相互替代,不會對論文產生任何實質影響。為描述方便,我本人的文章經常將它們視為同一病毒。
無獨有偶,“孿生”蝙蝠冠狀病毒還有一對:WIV16與Rs4874,二者全基因組序列同一性為99.93%。WIV1(rs3367)、WIV16(Rs4874)發現於雲南同一蝙蝠洞穴,這兩對“孿生”病毒之間也非常相似,WIV1與WIV16全基因組序列的一致性(相似度)為97.54%;特別是,兩對雙胞胎RBD的五個關鍵氨基酸完全相同,這意味着它們的ACE2結合能力,宿主細胞進入(感染)能力,宿主範圍都高度相似。
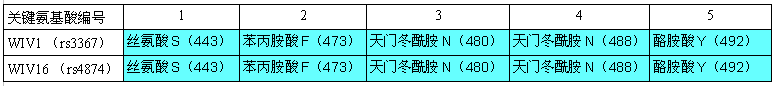
WIV1(rs3367)、WIV16(Rs4874)刺突蛋白RBD五個關鍵氨基酸對照表。
WIV1 spike GenBank ID:AGZ48828,WIV16 spike GenBank ID:ALK02457。
WIV1通過ACE2受體進入(感染)人體細胞,新冠病毒感染人體的核心受體也是ACE2。雖然大家都知道ACE2,但我要再羅嗦一嘴。
ACE2,即Angiotensin Converting Enzyme2,血管緊張素轉換酶2,腎素-血管緊張素系統(RAS)中的關鍵蛋白酶之一。ACE2是細胞表面的一個跨膜糖蛋白,廣泛存在於脊椎動物的呼吸、消化、血液、泌尿、生殖、視覺等系統的各個器官、組織內。ACE2可介導與之發生結合的病毒進入它所嵌附的細胞內部,常被稱為ACE2受體。
WIV1、rs3367是非常非常特殊、非常非常奇特的蝙蝠冠狀病毒。
絕大多數蝙蝠冠狀病毒不能進入(感染)人體細胞,它們的刺突蛋白不能結合hACE2(human ACE2);WIV1、rs3367卻具有人體細進入(或者說感染)能力,它們的刺突蛋白能夠結合hACE2,能通過這種結合,介導病毒進入(感染)人體細胞。可結合hACE2,可進入(感染)人體細胞,這是它們的第一個特別之處。
刺突蛋白可結合hACE2,具有人體細胞進入(感染)能力的特殊蝙蝠冠狀病毒已知共(約)有7種,其中5種是:rs3367、WIV1、WIV16、rs4874、SHC014(即rsSHC014)。前四種本文剛剛提及,第5種--SHC014在我之前的文章中已多次出現,後續文章還會提及。
WIV1、rs3367的第二個特別之處是:雖然能夠進入(感染)人體細胞,但它們不會使人發病,不會使人體產生任何疾病症狀。雖然本身是人類無害的,但是,將它們刺突蛋白的全部或部分嫁接、嵌合到有致病能力的病毒骨架上(如SARS),將能改造出新的有人類致病能力的危險病毒,參照其刺突蛋白的結構改造某些病毒,也能改造出有人類致病能力的危險病毒。
WIV1、rs3367還有第三個特別之處。。。
II、 新冠、WIV1(rs3367)高度相似的強大跨物種感染能力,高度相似的宿主範圍
WIV1、rs3367的第三個非同尋常之處是:它們具有強大的跨物種感染能力,它們的刺突蛋白能夠結合眾多脊椎動物的ACE2,它們能夠進入(感染)眾多物種的細胞,在新冠病毒出現前,WIV1、rs3367是已知的跨物種感染能力最強的冠狀病毒(另一對孿生病毒WIV16、Rs4874的跨物種感染能力應該與WIV1、rs3367相當),已確認的可被它們感染的動物(含人類)至少有以下10種(類):
人類、果子狸、貉、非洲綠猴、恆河猴、雪貂、水鼬(即水貂)、貓、蝙蝠(包括菊頭蝠、果蝠等翼手目動物)、老鼠(它們能使實驗小鼠產生輕度疾病症狀)。
強大的跨物種感染能力使WIV1、rs3367成為功能增益研究、冠狀病毒功能增益改造的絕佳原材料、絕佳參照物。
新冠病毒的跨物種感染能力又如何呢?
新冠病毒的跨物種感染、傳播能力極為強大、驚人!已確認的,或已報告的可被新冠病毒感染的動物包括:
人類、靈長類動物(如大猩猩、非洲綠猴、恆河猴、食蟹獼猴、狒狒、黑長尾猴和狨猴)、穿山甲、狗、豬、兔子、某些鼠類(如倉鼠、田鼠)、鼬類或貂類(如雪貂、水貂、水獺、黃鼠狼等等)、家貓、老虎、獅子、雪豹、麝香貓、北美鹿(如白尾鹿)、貉、樹鼩、果蝠等等。


新冠病毒的感染名單看上去比WIV1(rs3367)長得多,這是否說明新冠的跨物種感染能力比WIV1(rs3367)強大得多呢?並非如此,這主要是研究、確認的不對等造成的,因為對WIV1、rs3367物種感染能力所做的研究、確認遠少於新冠;還有一個原因,WIV1、rs3367很少使被感染的動物發病或產生症狀,不專門、細緻地研究、實驗,很難發覺它們對某種動物的感染能力。WIV1、rs3367可感染的動物絕不會只限於前述10種,我的推測是,WIV、rs3367的跨物種感染能力可能還稍勝新冠。
WIV1(rs3367)已知的感染名單是:
人類、果子狸、貉、非洲綠猴、恆河猴、雪貂、水鼬(水貂)、貓、蝙蝠(包括菊頭蝠、果蝠)、老鼠。
將這一名單與新冠的感染名單比對,不難發現,WIV1(rs3367)能感染的物種,幾乎全都包含在新冠的感染名單中,唯一的例外是蝙蝠。WIV1(rs3367)既能感染菊頭蝠,也能感染果蝠;新冠病毒能感染果蝠,但對眾多蝙蝠冠狀病毒的宿主菊頭蝠,新冠的感染能力很弱(這是新冠來自蝙蝠的一個反證)。還要說明一下果子狸和麝香貓的情況,已知WIV1(rs3367)能感染果子狸,而新冠能感染麝香貓;果子狸和麝香貓同屬靈貓科,它們的ACE2高度相似,可以推斷,WIV1(rs3367)、新冠都能感染果子狸和麝香貓。
進而可作出如下推斷:新冠與WIV1(rs3367)的宿主範圍高度雷同。
新冠病毒的跨物種感染(、傳播)能力如此強大、驚世駭俗,這只是自然演化的偶然嗎?新冠、WIV1(rs3367)的跨物種感染(、傳播)能力都極為強大,這只是巧合嗎?新冠與WIV1(rs3367)的宿主範圍高度雷同,這又是巧合嗎?
既非偶然,也不是巧合,它們是內在的結構原因決定的。什麼結構原因?新冠與WIV1(rs3367)的某一結構是高度關聯、高度等價的。新冠的什麼結構與WIV1(rs3367)高度關聯、高度等價?就是決定ACE2結合能力,決定細胞進入能力,決定宿主範圍的刺突蛋白RBD的5個關鍵氨基酸。
III、 冠狀病毒刺突蛋白RBD的5個關鍵氨基酸
能否感染(即進入)細胞,取決於病毒有沒有能打開“細胞鎖”的鑰匙。冠狀病毒的鑰匙是它的刺突蛋白(即Spike蛋白,S蛋白),而細胞的鎖,就是嵌在細胞膜上的各種受體,如ACE2,TMPRSS2(跨膜絲氨酸蛋白酶2),CD4(表面抗原分化簇4糖蛋白)等等。
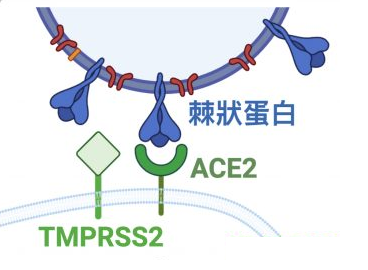
冠狀病毒的細胞鑰匙--刺突蛋白包括相連的兩個部分--兩個亞基,朝向外部的是S1蛋白,S1蛋白與病毒包膜之間是S2蛋白。S2蛋白也叫膜融合亞基(參與某些病毒如新冠病毒與細胞的膜融合),它相當於鑰匙的手柄部分;S1蛋白也叫受體結合亞基,它負責與細胞表面的受體結合,相當於鑰匙的齒面部分。S1蛋白中有一個區域叫做受體結合域(Receptor Binding Domain),簡稱RBD,RBD是S1蛋白與細胞受體發生接觸的部分,相當於齒面上的鑰齒區域。
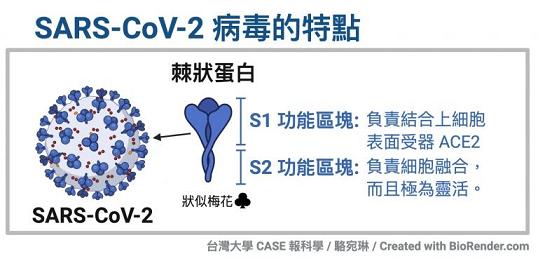
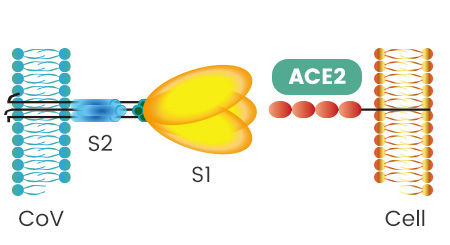
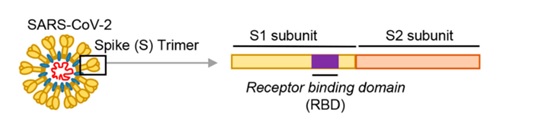
SARS病毒、新冠病毒感染細胞所用的核心受體都是ACE2(還有其它輔助受體)。冠狀病毒刺突蛋白S1亞基RBD中,與ACE2能發生直接接觸的氨基酸(殘基)有14個,這14個氨基酸中,有5個起決定性的作用,它們決定刺突蛋白能否與ACE2結合,進而決定冠狀病毒能否進入(感染)細胞。這5個關鍵氨基酸也是決定或影響冠狀病毒宿主範圍的最重要因素,它們相當於冠狀病毒刺突蛋白鑰匙上的關鍵鑰齒。
如果5個關鍵氨基酸與ACE2適配,那麼,刺突蛋白就能與ACE2成功結合,細胞的ACE2鎖就“打開”了,冠狀病毒將在ACE2的介導下,整體進入(感染)ACE2所嵌附着的細胞,或在膜融合(病毒包膜與細胞膜融合)後直接向細胞內釋放其RNA。
經過上述準備,現在可以說明、解答如下問題了:新冠的關鍵氨基酸,與WIV1(rs3367)的關鍵氨基酸,到底存在着怎樣的高度關聯?
IV、 新冠、WIV1(rs3367)關鍵氨基酸的高度關聯、高度等價
下表展示了新冠、rs3367(WIV1)5個關鍵氨基酸的對應關係。表格中關鍵氨基酸的表達格式為:氨基酸名稱-字母縮寫-(氨基酸序號)。如,第二行第二列的亮胺酸L(455),表示新冠病毒的第一個關鍵氨基酸--亮胺酸(字母縮寫為L),是新冠病毒的刺突蛋白氨基酸序列中的第455個氨基酸(殘基)。
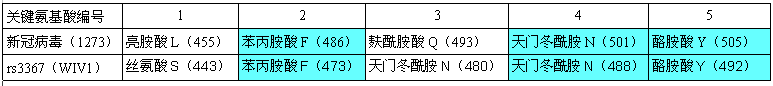
註:新冠病毒刺突蛋白的“長度”有兩種情況:一類毒株的刺突蛋白包含1273個氨基酸(殘基),另一類則包含1269個氨基酸(殘基),1273刺突蛋白相比1269刺突蛋白前面多出4個氨基酸,(不考慮其它變異情況)二者後面的氨基酸沒有差異,只是序號相差4。上圖對應前一種情況;當採用後一類毒株時,新冠的關鍵氨基酸保持不變,但它們的序號都要-4。
由圖可見,新冠、rs3367(WIV1)的5個關鍵氨基酸有三個是一樣的:
它們的第五、第四、第二關鍵氨基酸同為酪氨酸Y、天門冬酰胺N、苯丙胺酸F。
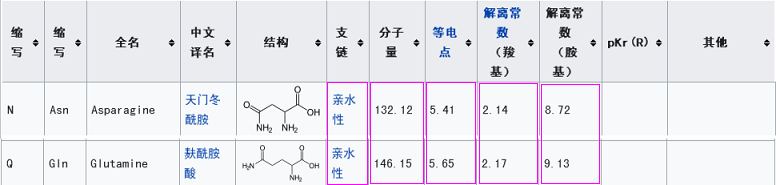
新冠的第三關鍵氨基酸是麩酰胺酸Q,rs3367(WIV1)的第三關鍵氨基酸是天門冬酰胺N。這兩個氨基酸之間有什麼玄機嗎?有,它們的多項理化屬性“碰巧”非常相似或接近,這意味着,在刺突蛋白與ACE2結合時,它們所起的作用是高度等價或高度等效的。
至此可知,新冠的5個關鍵氨基酸,與WIV1(rs3367)的5個關鍵氨基酸高度關聯:三個雷同,一個高度等價。
這可能是自然演化的結果嗎?絕無可能!
第一,WIV1(rs3367)與新冠全基因組序列的一致性(相似度)僅為82.13%,在自然演化關繫上,它們相距一千個銀河系;
第二,新冠有furin酶切位點,如果它是蝙蝠冠狀病毒自然演化產生的,那麼它的較近祖先應該是一個有furin酶切位點的蝙蝠冠狀病毒,然而,已知的所有蝙蝠冠狀病毒都沒有furin酶切位點!
第三,新冠基因序列中有天然病毒中極為罕見的雙CGG密碼子(密碼子指三個核苷酸鹼性對的短序列),然而,從未在任何蝙蝠冠狀病毒基因序列中發現過的雙CGG密碼子;
第四,新冠刺突蛋白中有一個精巧的三關節式絞鏈結構,然而,從未在其它病毒中發現過近似的結構;
第五,新冠還具有多項“源自”非冠狀病毒科病毒的結構或功能,如:刺突蛋白S1亞基中具有免疫破壞功能的gp120蛋白、Gag蛋白,S1亞基、S2亞基交接處具有免疫屏蔽功能的O-Linked聚糖結構,N蛋白中具有免疫抑制、免疫干擾功能的nsp3A編碼,以及逆轉錄自身RNA為cDNA,並將其整合到人體被感染細胞DNA中的功能。。。這些結構、功能分別來自逆轉錄科、絲狀病毒科、黃病毒科、微小病毒科等科屬的某些病毒,這些結構、功能中的任何一項,已知的蝙蝠冠狀病毒無一具有!已知的冠狀病毒無一具有!這些結構、功能中的任何一項,都是自然演化難以跨越的天塹!
參考文章:新冠病毒是自然產生或無意人為促生的嗎?
新冠病毒絕不可能是自然演化產生的,它是對不同科屬的多種病毒廣為借鑑,人為精心設計的跨科屬的病毒集大成者。
新冠與WIV1(rs3367)關鍵氨基酸的高度關聯、高度等價也是人為設計的結果:有人參照WIV1(rs3367)的5個關鍵氨基酸,通過重用+等效或等價替代,設計出了新冠病毒的5個關鍵氨基酸。由於人為設計出的新冠病毒的關鍵氨基酸,與WIV1(rs3367)的關鍵氨基酸高度等價或等效,才產生了兩個貌似的“巧合”:
1)新冠的跨物種感染、傳播能力與WIV1(rs3367)高度相似、極為強大;
2)新冠與WIV1(rs3367)的宿主範圍高度雷同。
參照WIV1(rs3367)設計新冠病毒5個關鍵氨基酸對頂級病毒學家來說算不上高難設計,不計摸索、反覆等細節,設計工作可通過以下三個步驟完成:
1)直接復用WIV1(rs3367)的3個關鍵氨基酸:第五關鍵氨基酸--酪氨酸Y,第四關鍵氨基酸--天門冬酰胺N,第二關鍵氨基酸--苯丙胺酸F;
2)用理化屬性非常相似、接近的麩酰胺酸Q替代WIV1(rs3367)第三關鍵氨基酸--天門冬酰胺N,以麩酰胺酸Q作為新冠的第三關鍵氨基酸;
3)最後為新冠選擇第一關鍵氨基酸。選拔原則是:入選氨基酸應與已確定的四個關鍵氨基酸最配套,使新冠5個關鍵氨基酸與WIV1(rs3367)的5個關鍵氨基酸在整體空間結構上高度同構,或者,在與ACE2結合時高度等價、等效。使用相關軟件,通過空間結構模擬、ACE2結合模擬,且、或通過實際的ACE2結合實驗,在20種常見氨基酸中,選出亮氨酸L,以之為新冠病毒的第一關鍵氨基酸。
新冠關鍵氨基酸設計結束。
誰參照WIV1(rs3367),通過氨基酸重用+替代,設計出了新冠病毒的5個關鍵氨基酸?
有沒有人同時深入研究過WIV1(rs3367)和關鍵氨基酸?
有,有人不僅同時深入研究過WIV1(rs3367)和關鍵氨基酸,還符合以下五個條件:
1)反覆、深入研究過WIV1(rs3367);
2)“無數次”研究過冠狀病毒刺突蛋白RBD的關鍵氨基酸;
3)有着長期的,極為豐富的功能增益研究經驗、病毒改造經驗;
4)曾多次對關鍵氨基酸進行改造、替代實驗,並改造、培育出了可跨物種傳播的,可感染人類和靈長類動物的冠狀病毒;
5)曾以WIV1(rs3367)為原材料,改造出了有人類致病能力的危險病毒。
這個人是誰?Ralph S. Baric。Ralph S. Baric(或其團隊)不僅符合以上五個條件,而且極可能是唯一符合以上五個條件的人(或團隊)。
(未完待續)





















