信口雌黃、憑空捏造、無中生有不會帶來真相,謊言、偽證、掩耳盜鈴不會帶來真相。
真相出自可核實的證據,真相出自經得起推敲的必要證據細節,真相出自信息甄別、信息對照。
新冠病毒的來源真相,新冠疫情的發生真相不應是小圈子裡的秘密。
接續:誰設計、製造了新冠病毒(四)北卡肺研究所與ENaC
回顧:新冠S蛋白與ENaC-α,北卡肺研究所與ENaC
上一篇文章指出:
1、新冠病毒S蛋白與人類ENaC-α擁有相同的長FCS序列,新冠病毒S蛋白S1亞基、S2亞基交界處(S1/S2處)的長furin切割序列,人類ENaC-α(上皮鈉離子通道的α亞基)的長furin切割序列,同為RRAR'SVAS。
在新冠病毒中,八氨基酸序列RRAR'SVAS是S蛋白aa(amino acid,氨基酸)序列的第683-690氨基酸(殘基),在人類ENaC-α中,同一序列是aa序列的第201-208氨基酸(殘基)。
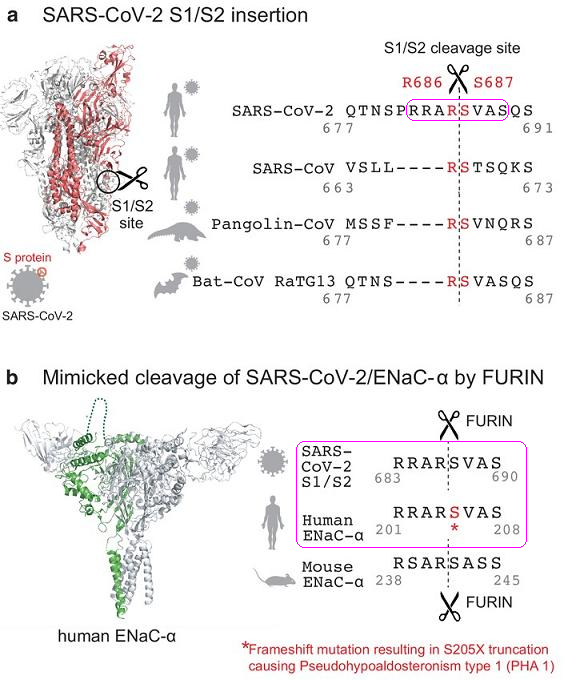
圖a:新冠、三種新冠“近親”S1/S2附近的aa序列對照。
圖b:新冠S蛋白、人類ENaC-α、小鼠ENaC-α的長furin切割序列對照。
2、
從自然演化的角度看,新冠S蛋白與人類ENaC-α共有RRAR'SVAS序列這一結構巧合是不可思議的“零概率事件”,這至少體現在:
a)新冠病毒是S蛋白含有RRAR'SVAS序列的唯一一種冠狀病毒,新冠之外的所有冠狀病毒S蛋白皆不含有RRAR'SVAS序列。
b) 就人類而言,RRAR'SVAS序列只存在於ENaC-α之中,更具體點說,ENaC-α是aa序列含有RRAR'SVAS的唯一一種人體蛋白結構。
c)
RRAR'SVAS序列在生物界極為罕見,ENaC-α含有RRAR'SVAS的生物物種僅有六種,其中五種是靈長類動物:人類(human)、黑猩猩(chimpanzee)、倭黑猩猩(bonobo)、猩猩(orangutan)、大猩猩(gorilla),唯一一種ENaC-α含有RRAR'SVAS序列的非靈長類物種是一種發現於歐洲和西亞的叫作pipistrellus
kuhlii的蝙蝠。
d) 在新冠病毒近3萬個核苷酸(鹼基)位點中,RRAR'SVAS恰巧出現在對感染、致病能力至關重要的S蛋白S1亞基、S2亞基交界處。
3、新冠病毒S1/S2處的長furin切割序列不是自然演化產生的,是人為設計、賦予的。
4、ENaC是北卡教堂山分校肺研究所(肺研究中心)長期的研究核心領域(之一),在2001年至2018年間,北卡肺研究所至少發表了十篇專門研究ENaC微觀結構與內在機能的分子生物學/生物化學論文,該所在同一時期還發表了一些與ENaC高度相關的論文(數量未作統計,筆者提供了兩篇示例)。
是誰,將人類ENaC-α的長furin序列RRAR'SVAS引入到了新冠S蛋白S1/S2位點處?誰才是新冠病毒的核心設計者?
是北卡肺研究所的ENaC專家嗎?北卡肺研究所在新冠病毒產生中充當的角色難以確定,他們可能是新冠病毒設計工作的參與者或建議者,亦或是有意、無意的idea貢獻者;但可以肯定,他們不會是新冠病毒的核心設計者。
早前的
誰設計、製造了新冠病毒(四)匪夷所思
一文指出:
由已發表的一系列科學論文、文獻可知,新冠病毒集眾多冠狀病毒、非冠狀病毒(如逆轉錄科慢病毒屬的艾滋病病毒、絲狀病毒科的埃博拉病毒、正黏液病毒科的甲型流感病毒、黃病毒科黃病毒屬的登革熱病毒等等)的結構、能力、特性於一身,它兼具十幾種受體結合能力,擁有完備的宿主免疫系統對抗能力(包括免疫破壞、免疫屏蔽與免疫逃避、免疫干擾與免疫抑制等);新冠病毒還兼具非病毒生物(如人類)、微生物(十幾種致病細菌)、非生物毒素(如金黃色葡萄球菌腸毒素B)的基因或蛋白結構。新冠病毒不是隨機、無目的自然演化的產物,新冠病毒是人為精心設計的跨科屬、跨界集大成者。
集各種冠狀病毒、非冠狀病毒、非病毒生物、微生物、非生物毒素結構、能力、特性於一身的跨界集大成者-新冠病毒必定出自老牌病毒專家之手,它的核心設計者必定是一個長期從事病毒研究、病毒改造,功能增益(Gain-of-function,GoF)經驗異常豐富、積澱異常深厚的資深病毒學家、微生物學家。新冠病毒的設計、研發團隊(或二次設計者)很可能還包括艾滋病病毒、埃博拉病毒、免疫學等領域的資深專家。
設計、製造新冠病毒這件事,不是長年跋山涉水、鑽山穿洞搜尋、搜集蝙蝠樣本,分離、測序、鑑定蝙蝠冠狀病毒,從未發表過功能增益研究論文,2016年才研發出反向遺傳系統,2017年才首次嘗試冠狀病毒無痕跡改造技術,病毒合成、改造技術落後世界頂尖水平16年的武漢病毒研究所、石正麗們所能做到的。
系統性地迴避、隱匿、不宣傳、不普及、冷處理新冠病毒種種匪夷所思的結構、能力、特性,是為了維持謊言、偽證、假相,轉移視線,隱藏新冠病毒的真正設計、製造者,掩蓋新冠病毒的真正來源地和新冠疫情發生的真正原因。
Ralph S. Baric(拉爾夫·巴里克)
我們已經知道,北卡羅來納大學教堂山分校(University
of North Carolina at Chapel Hill,UNC at
CH)有一批長期研究ENaC的頂尖分子生物學家、生物化學家;巧合的是,北卡教堂山分校還有一位世界最頂級的冠狀病毒研究權威Ralph S.
Baric(拉爾夫·巴里克)。Ralph S.
Baric研究冠狀病毒近40年,發錶冠狀病毒論文二百餘篇,合成、改造冠狀病毒無數,被譽為“冠狀病毒合成、改造之父”,他同時是功能增益研究的堅定支持者和執着的長期身體力行者。Ralph
S.
Baric不僅是當今世界上最有能力、最富技術積累和經驗積澱以設計、製造新冠病毒的人,而且,如筆者已經多次指出,還將不斷指出、介紹的,新冠病毒的多項結構、能力、特性,如S蛋白的RBD關鍵氨基酸、S蛋白的furin切割序列、S蛋白的三關節式鉸鏈結構、逆轉錄RNA-人類DNA整合特性,S蛋白異常廣泛的受體結合能力(新冠S蛋白可結合十幾種受體,集多種冠軍病毒、非冠狀病毒的受體結合能力於一身)、異常廣泛的各種細胞感染能力等等等等,都與Ralph
S. Baric的論文內容、研究內容存在高度關聯,如此之多的高度關聯絕非偶然的巧合。
Ralph S.
Baric是北卡羅來納大學(UNC)教堂山分校流行病學系(Department of
Epidemiology)教授,併兼任UNC教堂山分校微生物學和免疫學系(Department of Microbiology and
Immunology)教授(也有資料稱Ralph S.
Baric是UNC微生物學和免疫學院流行病學系教授),他還是UNC萊恩伯格綜合癌症中心(The Lineberger Comprehensive
Cancer Center)的成員。最新的UNC介紹資料顯示,流行病學系隸屬於UNC吉林斯公共衛生學院(The UNC Gillings
School of Public Health),微生物學和免疫學系隸屬於UNC醫學院(The UNC School of
Medicine),值得注意的是,北卡肺研究所也隸屬於UNC醫學院。
疫情發生後的2021年4月,Ralph S. Baric入選美國國家科學院院士,次年4月,他又入選美國藝術與科學院院士。美國國家科學院與美國藝術與科學院是兩個不同的機構。
Ralph S. Baric與北卡肺研究所
北卡肺研究所的研究領域與Ralph S. Baric(團隊)的研究領域高度相關且相輔相成。肺、呼吸道的結構(包括ENaC)、機能、發病機制是肺研究所的主要研究領域,而Ralph S. Baric的研究對象—大多數冠狀病毒的最首要感染部位,也正是肺、呼吸道。
Ralph S. Baric實驗室與肺研究所不僅同屬北卡醫學院,而且雙方關係極為密切,雙方交流、合作極為頻繁。
a) 雙方人員經常合作開展研究,聯名發表論文,包括大量GoF研究,這些研究通常涉及人體感染、致病實驗,以及通過實驗室手段(如人工改造、人體組織培養或其它手段),使冠狀病毒具有人體感染、致病能力,或可跨物種感染、傳播的有效嘗試;
b) 雙方有共同的研究成員或接口人,有些肺研究所成員如Raymond J Pickles,同時隸屬於Ralph S. Baric所在的微生物學和免疫學系,在北卡醫學院內跨系所任職,同時或交叉性地參與雙方的研究和論文發表;
c) 從2007起,近十多年來,Ralph S. Baric實驗室做了大量的人類感染、致病實驗。Ralph S. Baric實驗室試驗病毒對人類感染、致病能力所用的人體肺臟、人體氣道樣本,及人體肺臟、氣道上皮細胞培養物,通常由肺研究所提供或代為購買、獲取(自捐獻者);
d) Ralph S. Baric實驗室不僅使用肺研究所提供的人體器官、組織樣本,人體細胞培養物進行體外感染實驗,還使用人源化轉基因小鼠進行體內感染實驗。Ralph S. Baric實驗室模擬檢驗冠狀病毒人體體內感染、致病效果所用的人源化小鼠,是在肺研究所(下屬動物模型核心)發明的轉基因小鼠基礎上進一步雜交得到的。
-
人源化小鼠(hACE2轉基因小鼠)
-
人源化小鼠是一種擬人化的轉基因小鼠,這種小鼠肺、腦、肝、腎和胃腸道等部位的細胞跨膜受體—mACE2(mouse
ACE2)被轉基因技術修改、替換為hACE2(human
ACE2)。在病毒研究中,除使用人體器官、組織樣本,人體細胞培養物進行體外感染實驗外,還可能做體內感染實驗,體內實驗通常不會使用真實的人類活體,而是以模擬的“人體”替代,人源化轉基因小鼠就是這樣一種人類活體模擬物。人源化小鼠可檢驗病毒(主要是改造產生的冠狀病毒,自然來源的蝙蝠冠狀病毒僅有少數幾種有hACE2結合能力)S蛋白的hACE2結合能力,進而模擬檢驗、評估冠狀病毒的人類體內感染、致病效果。
2016年3月14日,Ralph S. Baric團隊在PNAS(Proceedings of National Academy of Sciences,美國國家科學院院刊)期刊發表了一篇重要的嵌合病毒論文:
SARS-like WIV1-CoV poised for human emergence
類SARS冠狀病毒WIV1-CoV準備出現在人類中(類SARS冠狀病毒WIV1-CoV有潛在的人類感染風險)
https://www.pnas.org/doi/10.1073/pnas.1517719113
https://pubmed.ncbi.nlm.nih.gov/26976607/
這篇論文的新冠溯源價值遠高於巴里克團隊2015年11月9日發表於Nature Medicine(自然醫學)期刊的另一篇廣為人知的嵌合病毒論文。
論文用普通小鼠和人源化小鼠作對比體內感染實驗。實驗結果顯示,嵌合病毒WIV1-MA15隻能使普通小鼠產生輕微症狀;但當感染對象由普通小鼠換成人源化小鼠後,WIV1-MA15的感染、複製、致病能力大大增強。WIV1-MA15在人源化小鼠肺中的複製滴度比在普通小鼠肺中高100倍;部分10-20周齡的被感染人源化小鼠體重減輕超過10%;WIV1-MA15在人源化小鼠大腦中的複製比在肺中更強勁,部分人源化小鼠患上了嚴重的腦炎並致死。
WIV1-MA15是蝙蝠冠狀病毒WIV1的刺突蛋白(S蛋白)與SARS-CoV MA15的骨幹嵌合而成的病毒。SARS-CoV MA15是Ralph S. Baric團隊在實驗室中培養的SARS病毒(SARS-CoV)小鼠適應性變異體。
對比實驗表明,WIV1的S蛋白非常適合結合hACE2;用WIV1的S蛋白或RBD(Receptor
Binding
Domain,受體結合域,S蛋白S1亞基的一部分)或RBD關鍵氨基酸可以構建出非常適合感染人類,人體複製能力、人體致病能力非常強的冠狀病毒,所得的冠狀病毒將具有大腦感染、破壞能力。
蝙蝠冠狀病毒WIV1、2016年PNAS論文與新冠病毒的淵源不止如此,有關情況後續文章還將展開、介紹,我們回歸人源化小鼠這一議題。
論文“Materials
and Methods(材料和方法)”部分的“Generation and Infection of ACE2 Tissue-Specific
Transgenic Mice(ACE2 組織特異性轉基因小鼠的產生和感染)”小節介紹了設計、產生人源化轉基因小鼠的方法和步驟,有關內容如下:
Transgenic
mice with airway-targeted overexpression of human ACE2 were generated
by microinjection of fertilized C3H × C57BL/6 (C3B6) F1 hybrid oocytes
with an expression cassette consisting of the HFH4/FOXJ1 lung ciliated
epithelial cell-specific promoter elements and the coding region of ACE2
cDNA in a pTG1 vector (11) (UNC Animal Model Core). Founder mice were
crossed to C3B6, producing human ACE2-transgenic mice that were each
previously tested for transgene expression as described in SI Materials
and Methods.
通過顯微注射受精的C3H×C57BL/6(C3B6)F1雜交卵母細胞,攜帶在pTG1載體(11)(UNC動物模型核心)中由HFH4/FOXJ1肺纖毛上皮細胞特異性啟動子元件和ACE2
cDNA(ACE2的互補DNA)編碼區組成的表達盒,產生氣道靶向過表達人類ACE2的轉基因小鼠。(再)將這種初始轉基因小鼠與C3B6雜交,(進而)產生人類ACE2轉基因小鼠,每隻小鼠(在用於感染實驗前)都事先測試(驗證)了(人類ACE2的)轉基因表達,如SI材料和方法中所述。
有關術語、名詞完全可以忽略,把握以下大意即可:先產生一種初始轉基因小鼠,而後將其與一種叫做C3B6的小鼠雜交,產生研究所用的hACE2轉基因小鼠。
初始轉基因小鼠是依照參考論文(11)產生的,(11)指UNC動物模型核心(UNC Animal Model Core)發表的如下Cell-Molecular Therapy(細胞-分子療法)論文:
Targeting expression of a transgene to the airway surface epithelium using a ciliated cell-specific promoter
(使用纖毛細胞特異性啟動子將轉基因靶向表達到氣道表面上皮細胞)
https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016(03)00221-1
https://pubmed.ncbi.nlm.nih.gov/14529837/
這是一篇設計、製造轉基因動物(包括小鼠)的論文。論文四位作者是:Lawrence
E Ostrowski,James R Hutchins,Kelly Zakel,Wanda K
O'Neal,按論文提供的信息,作者所屬單位皆為北卡肺研究所:Cystic Fibrosis/Pulmonary Research and
Treatment Center, University of North Carolina at Chapel
Hill。四位作者中的Wanda O'Neal 是UNC動物模型中心(Animal Model
Core)的Director,UNC動物模型核心是UNC肺研究所的下屬單位。
這篇論文發表於2003年10月,Cell期刊收到論文的時間為2003年4月24日。
至此可知,Ralph
S.
Baric團隊在2016年3月PNAS論文研究中進行人體體內模擬感染實驗所用的人源化轉基因小鼠,使用了肺研究所下屬動物模型核心的轉基因技術,前者是對後者進一步雜交得到的。北卡肺研究所-動物模型核心發明轉基因小鼠的時間不晚於2003年4月。
北卡肺研究所動物模型核心的主頁
The Animal Models Core _ Marsico Lung Institute
https://www.med.unc.edu/marsicolunginstitute/core-facilities/mousemodelscore/
介紹說:
The
Animal Models Core has been involved in the generation and
characterization of over 25 lines of genetically modified mice
(transgenic, knockout, or knockin) for a variety of collaborators over
the years, and has also conducted studies in other species (rabbit,
hamster, rat, guinea pig) for investigator-initiated projects.
多年來,動物模型核心為各種合作者提供了超過 25 種轉基因小鼠(轉基因、敲除或敲入)的生成和表徵,並且還從事其他物種(兔子、倉鼠、 大鼠、豚鼠)的(轉基因)研究以服務於研究者發起的項目。
疫情發生後的2020年5月21日,一批中國研究人員(主要來自武漢病毒研究所,有一人來自華中科技大學同濟醫學院法醫學系,另有一位外籍署名作者,論文通訊作者為武漢所的石正麗和楊興婁)在Cell期刊發表了一篇新冠病毒研究論文:
Pathogenesis of SARS-CoV-2 in Transgenic Mice Expressing Human Angiotensin-Converting Enzyme 2
SARS-CoV-2 在表達人類ACE2 的轉基因小鼠中的發病機制
https://www.cell.com/cell/fulltext/S0092-8674(20)30622-X
Human Angiotensin-Converting Enzyme 2,人類血管緊張素轉換酶2,即人類ACE2,通常簡寫為human ACE2或hACE2。
論文“Experimental Model and Subject Details(實驗模型和受試者/試驗物詳細信息)”章節之下的“HFH4-hACE2 mice(HFH4-hACE2小鼠)”小節中說:
The
transgenic mice (HFH4-hACE2 mice) expressing the human ACE2 protein
(hACE2) under mixed genetic backgrounds (C3H, C57BL/6) were obtained
from Ralph S. Baric’s lab (Menachery et al., 2016).
在混合遺傳背景(C3H、C57BL/6)下表達人類ACE2 蛋白(hACE2)的轉基因小鼠(HFH4-hACE2 小鼠)獲自Ralph S. Baric 實驗室(Menachery 等人,2016 年)。
參考論文(Menachery
et al., 2016)就是本文篇首提到的Ralph S.
Baric團隊2016年3月14日發表的PNAS論文,該論文的第一作者是Vineet D.
Menachery(他也是2015年11月Nature Medicine嵌合病毒論文的第一作者),通訊作者是Ralph S. Baric。
在中國學者2020年5月21日的Cell期刊論文中,Ralph S. Baric列名第十七作者(除兩位通訊作者外的倒數第二位作者),他也是該論文唯一一位外籍作者。論文“Author Contributions(作者貢獻)”部分指出:
; Resources, J.M., X.W., and R.S.B.; ...; Writing – Review & Editing, X.-L.Y., Y.-W.Z., R.S.B., P.Z., and Z.-L.S.;
即,Ralph S. Baric R.S.B)是三位Resources(資源)提供者之一;他還參與了論文手稿的Writing – Review & Editing(筆者推測,他應該沒有參與所向手稿的寫作,而是提供了一些review意見)。Ralph S. Baric提供的資源應該就是人源化轉基因小鼠(HFH4-hACE2小鼠)。這也許可以看作是石正麗的一次“投桃報李”,當年,並未參加嵌合病毒GoF研究的石正麗,因向Ralph S. Baric提供蝙蝠冠狀病毒SHC014的S蛋白基因序列而被Baric友情列名為2015年11月自然醫學嵌合病毒論文的第14作者(通訊作者Ralph S. Baric之外的倒數第一作者),由此“成為”“參與”這項危險研究的一分子,更有人稱2015年11月自然醫學論文是石正麗(團隊)發表的。
2015年11月自然醫學嵌合病毒論文指Ralph S. Baric團隊2015年11月9日發表的如下Nature Medicine論文:
A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence
(一個類似SARS的蝙蝠冠狀病毒群顯示了產生人類流行疫情的潛力)
https://www.nature.com/articles/nm.3985
https://pubmed.ncbi.nlm.nih.gov/26552008/

這是Ralph S. Baric團隊最廣為人知的一篇論文,這篇論文屢屢被張冠李戴或分享到武漢病毒研究所和石正麗頭上。維基百科“拉爾夫·巴里克”詞條稱:
巴里克與中國科學院武漢病毒研究所的石正麗合作,製作含有SHC014病毒刺突蛋白、且已適應小鼠體內環境的SARS-CoV重組病毒(SHC014-MA15),發現此病毒可感染人類細胞與小鼠,顯示自然界許多蝙蝠SARSr-CoV可能具有感染人類的潛力[11]。此研究於2015年發表,被部分科學家認為風險過大[12][13]。
拉爾夫·S·巴里克 - 維基百科,自由的百科全書
https://zh.wikipedia.org/wiki/%E6%8B%89%E5%B0%94%E5%A4%AB%C2%B7S%C2%B7%E5%B7%B4%E9%87%8C%E5%85%8B
B從A那裡要了一種鋼材,而後B使用這種鋼材,嵌合鎳、鉻等金屬,設計、製造了一種前所未見的殺傷力巨大的大炮。試問,這種大炮是B設計、製造的,還是B與A共同設計、製造的?以下兩種說法,哪一種說法合乎事實:
1、B與A合作,設計、製造了一種前所未見的、殺傷力巨大的大炮;
2、B利用A提供的鋼材,設計、製造了一種前所未見的、殺傷力巨大的大炮。
另一個問題:A是否參與了大炮的設計、製造?
關於武漢病毒研究所石正麗、葛行義(論文第9作者)與2015年11月Nature Medicine論文真實關係的詳細分析、說明,請參閱:
改造病毒問題兼批駁王文清新冠溯源文章
關於人源化小鼠,話說了很多,要點其實就兩個:Ralph
S. Baric實驗室在冠狀病毒研究中使用的人源化轉基因小鼠基於肺研究所的轉基因小鼠;武漢病毒研究所所用的人源化轉基因小鼠來自Ralph S.
Baric實驗室(Ralph S. Baric實驗室可能提供了小鼠本身或技術)。
(未完待續)