接續:“萬能”受體適配器--新冠S蛋白 1
5、HS/HSPG
HS:heparan sulfate,硫酸乙酰肝素,是一種帶高負電荷的高酸性鏈狀多糖,也是一種硫酸化的糖胺聚糖(glycosaminoglycans,GAGs)。
HS在人類和動物組織中普遍存在,它可能存在/表達於人和哺乳動物所有細胞類型的表面,以及細胞外基質和基底膜中。HS具有非凡的結構多樣性,能夠與各種蛋白、多肽相互作用並發揮不同的功能。HS可與免疫系統的多種成分相互作用,如與多種細胞因子及某些T細胞受體結合,在免疫系統中發揮多方面的重要作用。HS已被證明可以調節白細胞發育、白細胞穩態、白細胞遷移,參與T細胞共刺激、免疫激活和炎症過程。HS還可能調節免疫突觸中關鍵成分的可用性,並在信號傳導、細胞間通訊中發揮作用。
HS通常附着在各種核心蛋白上形成HSPG(heparan sulfate proteoglycans),即硫酸乙酰肝素蛋白聚糖,或稱為HS-蛋白聚糖(HS-proteoglycans)。在HSPG中,核心蛋白與HS多糖鏈通過共價鍵連接,一個核心蛋白可連接1個、2個或3個HS多糖鏈。HSPG能夠通過結構異常多樣的HS鏈結合大量配體,包括生長因子、形態發生素、細胞因子、趨化因子、酶、基質蛋白,以及細菌和病毒等病原體。HSPG通過廣泛的結合能力在多種細胞過程中發揮關鍵(調節)作用,如細胞粘附、受體激活、細胞骨架組裝、細胞外基質重塑、內吞作用、細胞間串擾、信號傳導、感知組織損傷和介導炎症反應等等。
總之,HS/HSPG在組織內普遍表達且功能豐富,在眾多生理、病理過程中發揮重要作用,二者的很多生理、病理作用等同或高度相關。
HS/HSPG是多種病毒的感染受體或附着因子,這些病毒包括:HIV(艾滋病病毒,屬於逆轉錄病毒科慢病毒屬)、HSV-1/2(herpes simplex virus 1/2,單純疱疹病毒血清型1/2,二者屬於疱疹病毒科)、HCoV-NL63(人冠狀病毒NL63,屬於冠狀病毒α譜系,新冠屬於β譜系)、HCV(hepatitis C virus,丙型肝炎病毒,屬於黃病毒科肝炎病毒屬)、HRSV(Human Respiratory Syncytial Virus,人類呼吸道合胞病毒,屬於副黏液病毒科肺病毒屬)、Sindbis virus(SINV,辛德比斯病毒,屬於披膜病毒科甲病毒屬,一種由蚊子傳播的分布最廣泛的蟲媒病毒)、MCPyV(Merkel cell polyomavirus,默克爾細胞多瘤病毒,屬於多瘤病毒科,一種罕見的高惡性皮膚癌的致病因)等等。SARS-CoV-1也有一定程度的HS/HSPG結合能力,但HS/HSPG可能干擾而不是促進SARS-CoV-1的感染。
在SARS-CoV-2感染中,HS/HSPG是ACE2的共受體/輔助受體,可顯著促進ACE2依賴性感染。在感染細胞時,SARS-CoV-2的S蛋白會同時結合ACE2和HS/HSPG。
論文依據一
SARS-CoV-2 Infection Depends on Cellular Heparan Sulfate and ACE2
SARS-CoV-2感染依賴於細胞硫酸乙酰肝素和ACE2
https://www.cell.com/cell/fulltext/S0092-8674(20)31230-7
論文“Highlights”部分(譯文):
a)SARS-CoV-2刺突蛋白通過RBD與硫酸乙酰肝素和ACE2相互作用;
b)硫酸乙酰肝素促進SARS-CoV-2 Spike-ACE2相互作用;
c)SARS-CoV-2感染共同依賴於硫酸乙酰肝素和ACE2;
d)肝素和非抗凝衍生物可阻斷SARS-CoV-2結合和感染。
論文具體要點:
1、SARS-CoV-2 Spike(刺突蛋白、S蛋白)通過RBD(Receptor Binding Domain,受體結合域)與硫酸乙酰肝素及ACE2相互作用,單個RBD可以在細胞表面同時結合HS和ACE2。
2、分析表明,SARS-CoV-2 RBD與HS的結合能力,顯著強於SARS-CoV-1(SARS-CoV)RBD與HS的結合能力。如下圖所示:
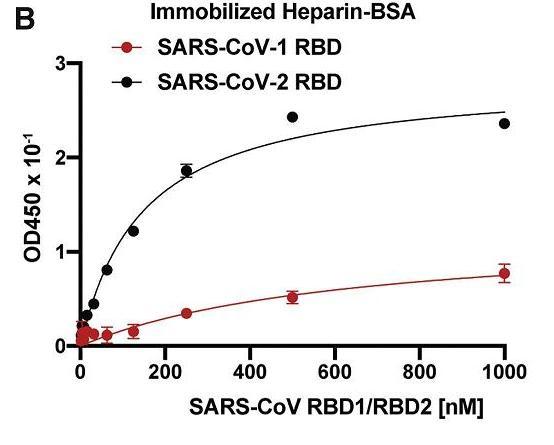
SARS-2 RBD、SARS-1 RBD的HS結合能力對照
SARS-2代表SARS-CoV-2。
BSA ,Bovine Serum Albumin,牛血清白蛋白。Immobilized heparin-BSA為牛血清白蛋白培養液中的固定化肝素。
heparin(肝素)是肥大細胞(Mast cell)和嗜鹼性粒細胞(basophil cells)的分泌物,最早是從動物肝臟中分離、發現的。heparin(肝素)、heparan sulfate(硫酸乙酰肝素)都是硫酸化的糖胺聚糖,它們的結構非常相似,heparin也能結合SARS-2、SARS-1的RBD,但它不是一種細胞膜受體。heparin可作為與HS競爭SARS-2 S/RBD的干擾、抑製劑。
3、SARS-CoV-2 HS結合能力的顯著提升,是通過兩個氨基酸替代Thr444Lys和Glu354Asn獲得的。
這意味着,基於SARS-CoV-1不難獲得SARS-CoV-2的HS結合能力。有必要對此多做一些說明(無須研究技術細節的讀者可跳過)。
三字母縮寫Thr代表蘇氨酸(Threonine),其單字母縮寫為T,即Thr=T;Lys代表賴氨酸(Lysine),其單字母縮寫為K,即Lys=K。替代Thr444Lys=T444K。
Glu代表穀氨酸,其單字母縮寫為E,即Glu=E;Asn代表天冬酰胺,其單字母縮寫為N,即Asn=N。替代Glu354Asn=E354N。
關於20種常見氨基酸及縮寫,可參閱:
氨基酸 – 維基百科,自由的百科全書.htm
https://zh.wikipedia.org/zh-hans/%E6%B0%A8%E5%9F%BA%E9%85%B8
前面的氨基酸對應SARS-CoV-1,後面的氨基酸對應SARS-CoV-2,中間的數字是SARS-CoV-2 S蛋白氨基酸序列的序號。
替代Thr444Lys(T444K)表示,相對SARS-1,SARS-2 S蛋白的第444氨基酸位點發生了從蘇氨酸(T,Thr)到賴氨酸(K,Lys)的替代或突變。或者說,SARS-2 S蛋白氨基酸序列的第444氨基酸是賴氨酸(K,Lys),而這一位點在SARS-1 S蛋白對應位點處的氨基酸是蘇氨酸(T,Thr)。由稍後的附圖可知,SARS-2 S蛋白第444氨基酸對應SARS-1 S蛋白第431氨基酸。
同理,替代Glu354Asn(E354N)表示,相對SARS-1,SARS-2 S蛋白的第354氨基酸位點發生了從穀氨酸(E,Glu)到天冬酰胺(N,Asn)的替代或突變。SARS-2 S蛋白第354氨基酸對應SARS-1 S蛋白第341氨基酸。
由“SARS-CoV-2 HS結合能力的顯著提升,是通過兩個氨基酸替代Thr444Lys和Glu354Asn獲得的”這一判定可知:
a)如果SARS-1 S蛋白第341氨基酸由穀氨酸(E,Glu)突變為天冬酰胺(N,Asn);同時,第431氨基酸由蘇氨酸(T,Thr)突變為賴氨酸(K,Lys),那麼,SARS-1就能演化出與SARS-2相同或相當的HS結合能力。
b)如果用天冬酰胺(N,Asn)替換SARS-1 S蛋白第341氨基酸穀氨酸(E,Glu);同時,用賴氨酸(K,Lys)替換第431氨基酸蘇氨酸(T,Thr),那麼,就基於SARS-1改造出了一種HS結合能力與SARS-2相同或相當的新型冠狀病毒。
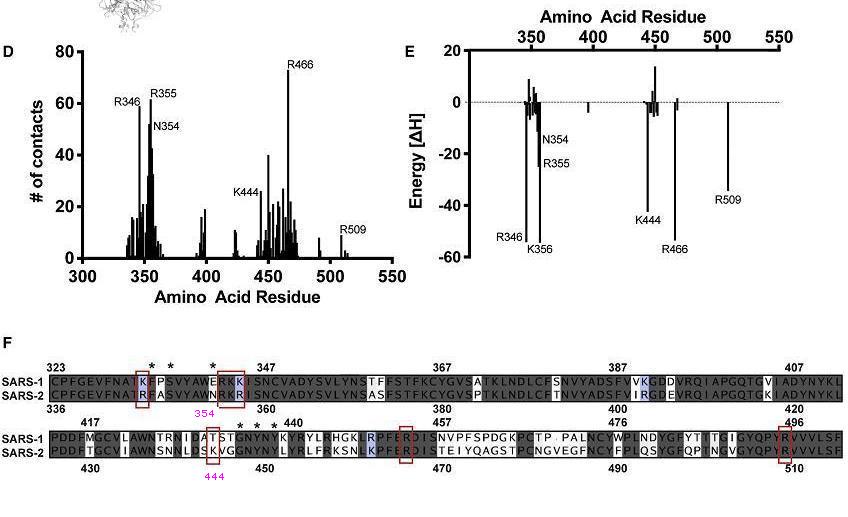
對結合HS貢獻高的SARS-2氨基酸殘基及對應的SARS-1氨基酸殘基
不妨再說明一下這兩個替代發現、確認的過程:
1)研究者首先找出了對結合HS貢獻高(包括接觸數貢獻和能量貢獻)的SARS-2氨基酸殘基,上圖用紅色方框標出了這些殘基(E354N處亦應有紅框)。
2)接下來比較高貢獻氨基酸與SARS-1中的對應位點氨基酸。一部分高貢獻氨基酸與SARS-1中對應位點氨基酸相同,只有四個高貢獻氨基酸與SARS-1中對應位點氨基酸不同,四組差異氨基酸是K346R、K357R、E354N、T444K。
3)四組差異氨基酸中的前兩組K346R、K357R都是賴氨酸K到精氨酸R的保守替換。賴氨酸、精氨酸都是鹼性殘基,二者物理、化學性質接近,它們之間的替換對HS結合能力影響不大。
4)因此,對SARS-2 HS結合能力提升起關鍵作用的是另外兩組差異氨基酸,即替換E354N、T444K,也就是Glu354Asn、Thr444Lys。
4、SARS-2 RBD在開放構象(RBD-Up)和閉合構象(RBD-Down)下皆可結合HS,在開放構象下HS結合親和力更高;SARS-2 RBD只能在開放構象下結合ACE2。如下圖所示:
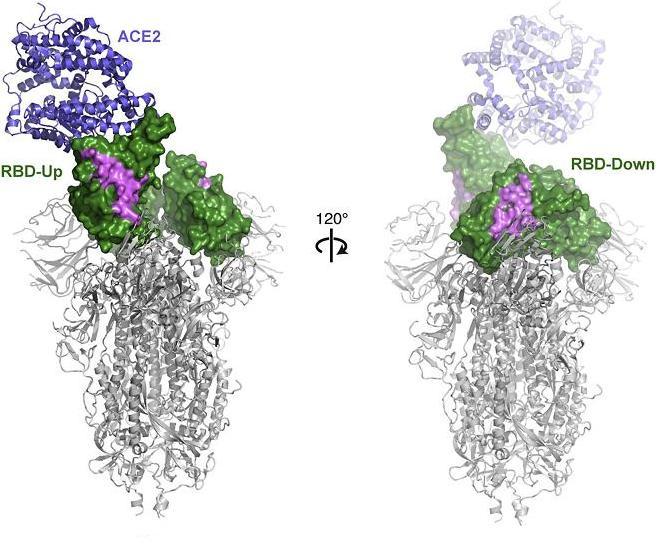
SARS-2 RBD在開放構象、閉合構象下皆可結合HS,但只能在開放構象下結合ACE2
圖中綠色部分表示HS,紫色部分表示SARS-2 RBD與HS的推定結合區域。
5、ACE2不與HS結合,ACE2不影響SARS-2 Spike與HS的結合。
6、SARS-2 Spike可以分別結合ACE2和HS,也可以同時與二者結合,並以肝素為支架生成三元複合物;RBD的HS結合位點與RBD的ACE2結合位點相鄰。
7、HS提升了S(Spike)蛋白的ACE2結合效率。與ACE2結合的S蛋白數量,隨着S蛋白與HS的結合成比例地增加;電子顯微照片成像研究表明,RBD與HS的結合可以形成有利於結合ACE2的開放構象,可以穩定RBD與ACE2的相互作用,增加與ACE2結合的Spike比例,並提高單個Spike結合ACE2的利用率(一個Spike三聚體可以結合1~3個ACE2)。這些情況表明,HS作為輔助受體啟動、促進了SARS-2 Spike與ACE2的相互作用與結合。
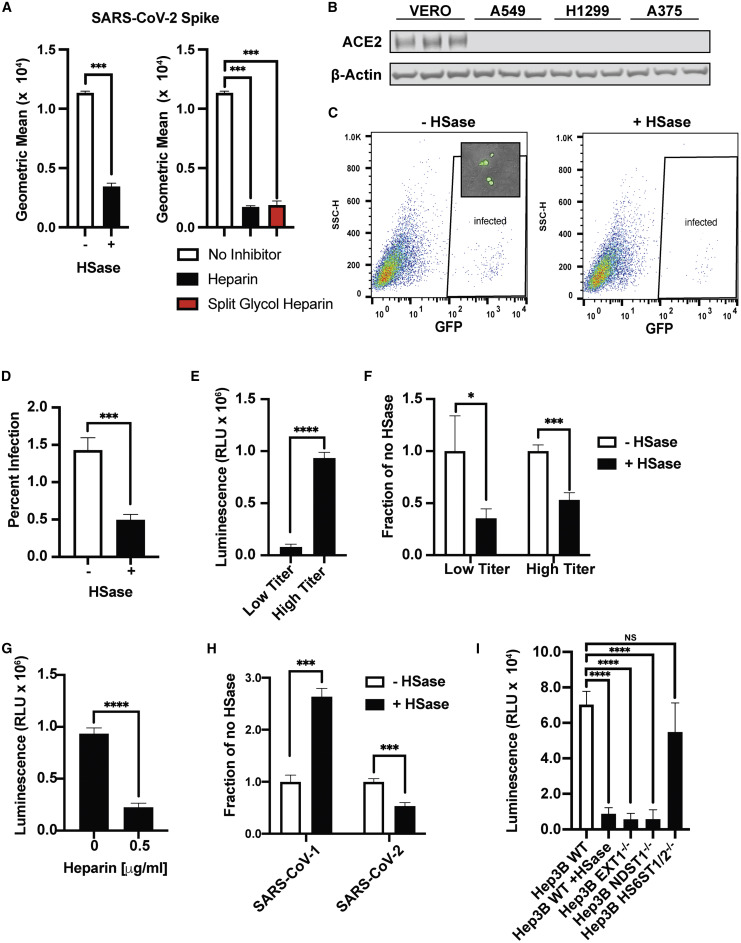
8、用肝素裂解酶HSase(可裂解、降解細胞表面的HS)預處理細胞培養物,顯著抑制了SARS-2 Spike、RBD肽與兩種人類肺細胞H1299、A549,以及與人類肝細胞Hep3B、人類黑色素瘤細胞A375的結合。如下圖所示:
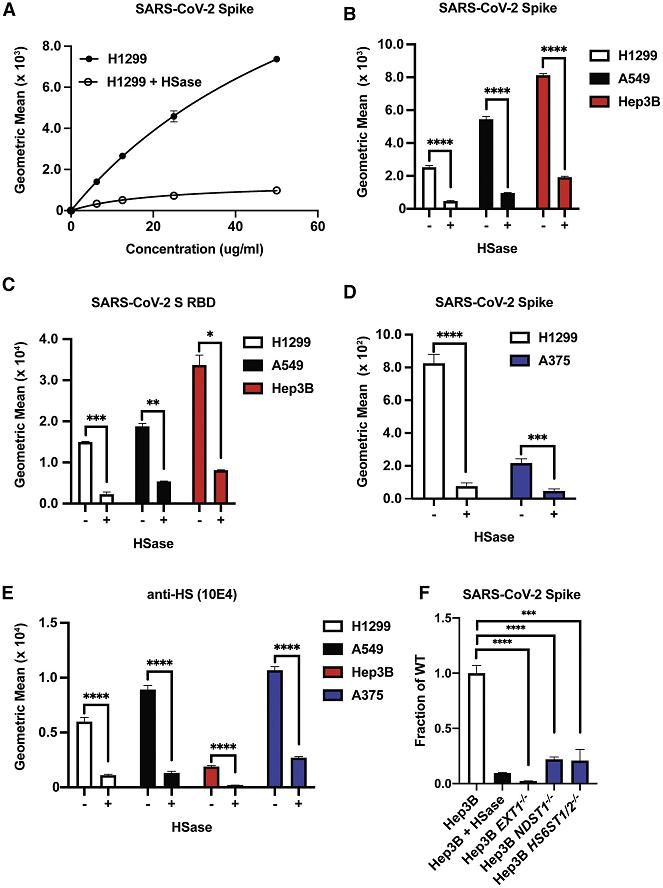
HSase有力抑制了SARS-2 Spike、RBD的多種細胞結合能力
H1299細胞:一種源自2型肺泡細胞的人類肺腺癌(非小細胞肺癌)細胞系,有說H1299 細胞摘取自淋巴結;
A549細胞:另一種2型人類肺泡腺癌細胞系;
Hep3B細胞:一種人肝癌細胞系;
A375細胞:一種人惡性黑色素瘤細胞系。
9、用HSase預處理細胞培養物,及敲除細胞中的EXT1、NDST1、HS6ST1/2等合成HS所需的生物合成酶基因都非常顯著地抑制了SARS-CoV-2 Spike、RBD與Hep3B細胞的結合。如上圖F及下圖所示:
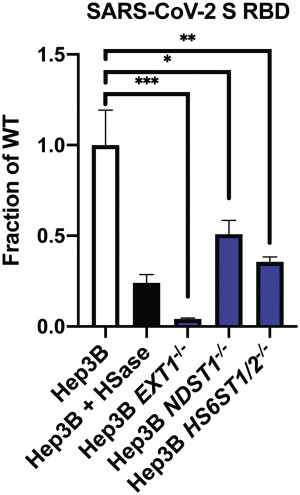
使用HSase,敲除EXT1、NDST1、HS6ST1/2顯著抑制SARS-2 RBD的細胞結合能力
EXT1:Exostosin-1,與另一基因EXT2編碼合成HS主鏈所需的糖基轉移酶;
NDST1:N-Deacetylase And N-Sulfotransferase 1,N-脫乙酰酶和N-磺基轉移酶1,一種HS中心修飾酶(催化硫酸鹽與碳水化合物的結合,催化硫酸鹽從3'-磷酸腺苷-5'-磷酸硫酸鹽轉移到HS中葡萄糖胺的氮);
HS6ST1/2:heparan sulfate 6-O-sulfotransferase1/2,硫酸乙酰肝素6-O-硫酸轉移酶1/2,兩種HS合成修飾酶(功能類似NDST1,可將腺苷3'-磷酸-5'-磷酸硫酸中的硫酸鹽基團催化轉移到HS中N-磺基葡萄糖胺的第6個殘基位點)。
“-/-”表示敲除了相應基因,例如,Hep3B EXT1-/-是敲除了EXT1基因的Hep3B細胞。
10、用提取自人類肺臟、腎臟、肝臟和扁桃體的HS(硫酸乙酰肝素)預處理細胞培養物,都顯著抑制了SARS-2 RBD與H1299細胞的結合(下圖B。外源性HS結合、消耗了SARS-2 RBD/Spike,被外源性HS占位結合的RBD/Spike 不能再結合細胞表面的HS);用多種外源性Heparin(肝素)/HS預處理細胞培養物,都顯著抑制了SARS-2 Spike與H1299細胞(下圖C)、與A549細胞(下圖D)的結合。
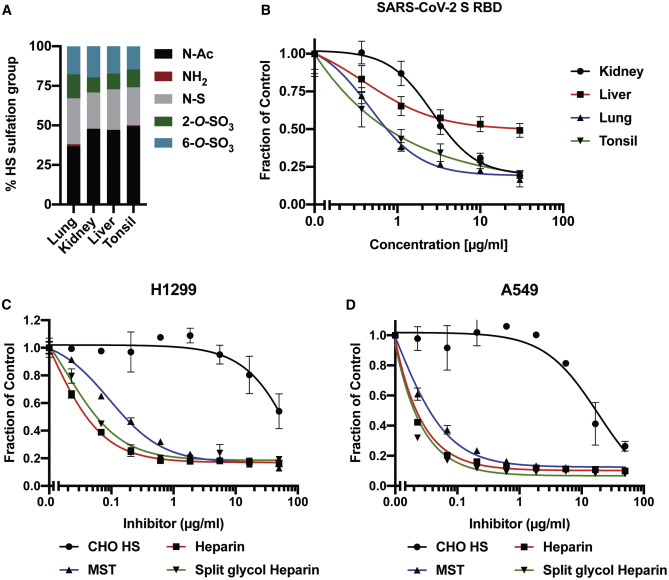
圖B:四種提取來源的外添加HS顯著抑制了SARS-2 RBD與H1299細胞的結合;
圖C:CHO HS、Heparin、MST、Split glycol Heparin顯著抑制了SARS-2 Spike與H1299細胞的結合;
圖D:CHO HS、Heparin、MST、Split glycol Heparin顯著抑制了SARS-2 Spike與A549細胞的結合。
CHO HS:提取自中國倉鼠卵巢的HS(硫酸乙酰肝素)。CHO:Chinese hamster ovary,中國倉鼠卵巢;
Heparin:肝素;
MST:指MST heparin,提取自MST(murine mastocytoma,小鼠肥大細胞瘤)細胞的肝素;
Split glycol Heparin:裂解乙二醇肝素/乙二醇裂解肝素。
11、ACE2過表達(通過ACE2基因轉染)顯著提升了SARS-2 Spike與A375細胞的結合(下圖B);
用肝素裂解酶HSase預處理細胞培養物、敲除細胞中的糖胺聚糖組裝基因B4GALT7顯著抑制了SARS-2 Spike與A375細胞的結合(下圖B);
敲除ACE2顯著抑制了SARS-2 Spike與A549細胞的結合(下圖C);
用肝素裂解酶HSase預處理細胞培養物顯著抑制了SARS-2 Spike與A549細胞的結合(下圖C);
這些結果表明,SARS-2 Spike與細胞的結合同時依賴於ACE2和HS。
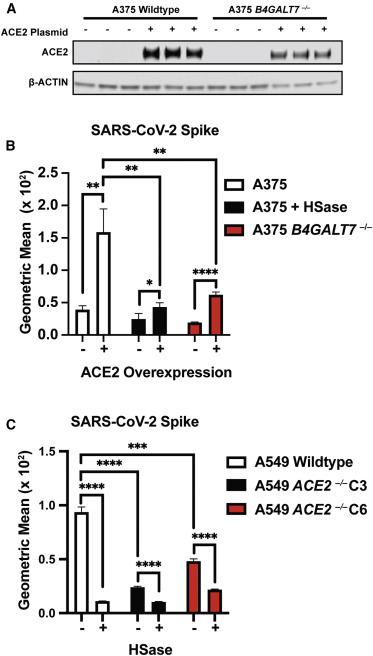
A375 B4GALT7-/-是敲除了B4GALT7基因的A375細胞;
A549 ACE2-/-C3、A549 ACE2-/-C6是兩組敲除了ACE2基因的A549細胞,不清楚二者的區別。
12、SARS-CoV-2假病毒感染也依賴於HS(之前實驗為蛋白-蛋白、蛋白-細胞結合實驗,不是感染實驗。感染是進入細胞,與細胞結合,即與細胞膜表面的受體結合只是感染的前奏),使用HSase預處理,使用外源性HS/heparin預處理,敲除EXT1、NDST1、HS6ST1/2都有效抑制了SARS-CoV-2假病毒對Vero E6細胞(非洲綠猴腎細胞系細胞)的感染。如下圖所示:
SARS-COV-2假病毒對Vero E6細胞的感染依賴於HS
SARS-CoV-2假病毒是用SARS-CoV-2 Spike蛋白替代VSV(vesicular stomatitis virus,水泡性口炎病毒)的G蛋白獲得的;
13、如上圖H所示,HSase(肝素裂解酶)顯著抑制了SARS-CoV-2感染,但相比之下,HSase反而顯著提升了SARS-CoV-1感染;與此同時,HSase對MERS-CoV感染也缺乏抑製作用,如下圖所示:
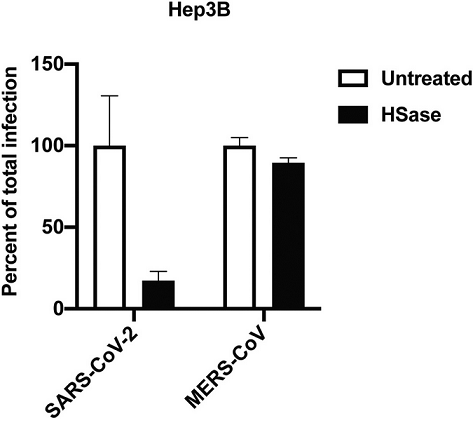
HSase不抑制MERS-CoV假病毒對Hep3B細胞的感染
可見,HS對SARS-COV-2感染的促進具有一定特異性;細胞膜表面的HS不是SARS-CoV-1和MERS-CoV的感染促進因子;HS可能干擾、抑制SARS-CoV-1的受體結合和細胞進入。
14、HS也是SARS-COV-2真病毒有效感染所需要的。
HSase、UFH預處理顯著抑制了SARS-COV-2真病毒對Vero E6細胞的感染(下圖B、C);
敲除NDST1完全抑制(消除)、敲除HS6ST1/2顯著抑制了SARS-COV-2真病毒對Hep3B細胞的感染(下圖D);
HSase、UFH預處理還顯著(5倍以上)抑制了SARS-COV-2真病毒對原代人支氣管上皮細胞(primary human bronchial epithelial cells)的感染(下圖F、G)。
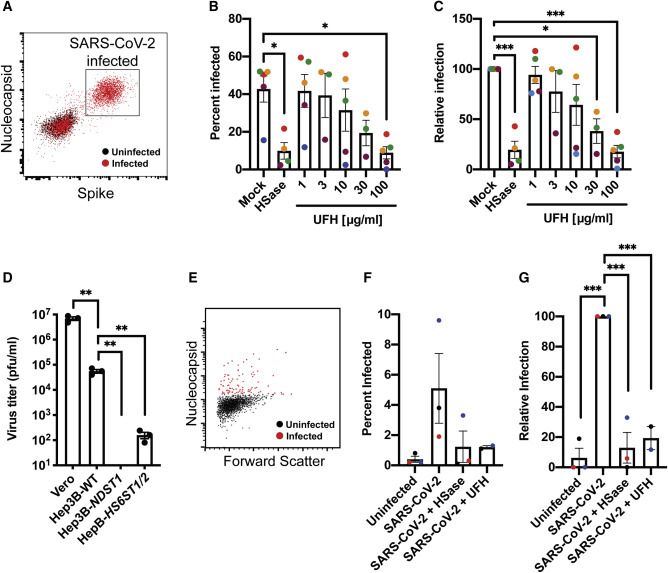
UFH:unfractionated heparin,未裂解肝素,也叫普通肝素,與UFH相對的是低分子量肝素。
論文依據二
Infection and transmission of SARS-CoV-2 depend on heparan sulfate proteoglycans
SARS-CoV-2的感染和傳播依賴於硫酸乙酰肝素蛋白聚糖
https://www.embopress.org/doi/full/10.15252/embj.2020106765
論文要點如下:
1、確定了硫酸乙酰肝素蛋白聚糖(HSPG)是SARS-CoV-2的附着受體,且是ACE2受體的共受體。
2、UF heparin、anti-ACE2、及從COVID-19患者中分離出的三種SARS-CoV-2中和抗體都可干擾並顯著抑制SARS-CoV-2假病毒與人類肝臟Huh7.5細胞的結合(圖A);
用heparinase III去除細胞中的HS顯著抑制了SARS-CoV-2假病毒與Huh7.5細胞的結合(圖B);
敲除Exostosin-1(EXT1)基因及使用UF heparin極大抑制了SARS-CoV-2假病毒與Huh7.5細胞的結合(圖D)。
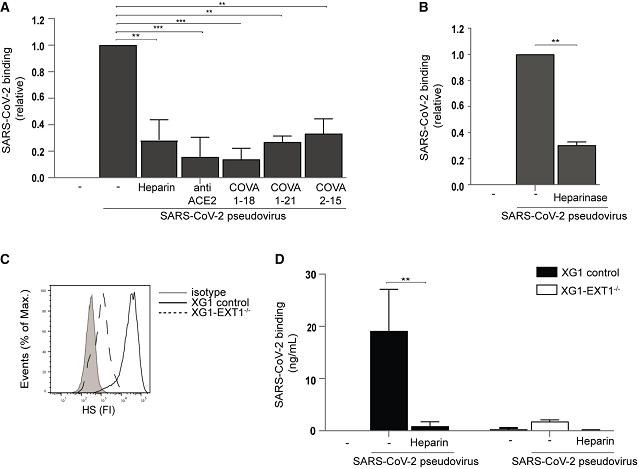
UF heparin,就是Unfractionated heparin(UFH),未裂解肝素或普通肝素。如前所述,heparin可結合、消耗SARS-2的S蛋白,干擾、抑制其與細胞表面HS/HSPG受體的結合。
anti-ACE2,ACE2中和抗體;
三種SARS-CoV-2中和抗體是兩種RBD中和抗體COVA1-18、COVA2-15,及一種非RBD中和抗體COVA1-21;
heparinase III,肝素酶Ⅲ,一種多糖裂解酶,可切割、降解HS;
SARS-CoV-2假病毒是用SARS-CoV-2 S蛋白與去病毒性HIV-1骨架嵌合製作的;
Huh7是一種人類肝癌細胞系,Huh7.5 是Huh7的衍生細胞系;
如前所述,Exostosin-1(EXT1)是合成HS主鏈所需的一種糖基轉移酶基因;
XG1/XG-1是一種人多發性骨髓瘤細胞,XG1-EXT1−/−是敲除了Exostosin-1(EXT1)基因的XG1細胞。
3、用四種(外源性添加的)LMWH(低分子量肝素)預處理細胞培養物顯著抑制了SARS-CoV-2假病毒對Huh7.5細胞的結合、感染,它們的抑制效果與UF heparin(普通肝素)相當(下圖A、圖B、圖C)。
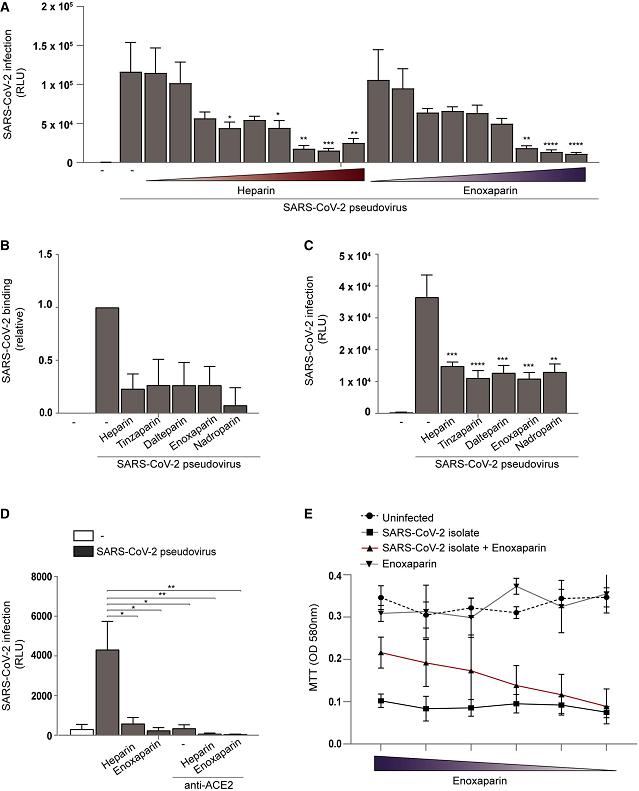
圖A:UF heparin、enoxaparin抑制SARS-2假病毒對Huh7.5細胞的感染,抑製程度與濃度正相關;
圖B:UF heparin、四種LMWH顯著抑制SARS-2假病毒與Huh7.5細胞的結合;
圖C:UF heparin、四種LMWH顯著抑制SARS-2假病毒對Huh7.5細胞的感染;
圖D:UF heparin、enoxaparin、anti-ACE2極大抑制了SARS-COV-2假病毒對293T-ACE2細胞的感染;
圖E:說明略。
LMWH,low molecular weight heparins,低分子量肝素,是普通肝素的人工裂解產物。LMWH、UF heparin(UFH,未裂解肝素、普通肝素)是常用的抗凝血蛋白(抗凝血劑/抗血栓劑)。這二類肝素在本論文中都用作HS/HSPG干擾、抑製劑。
該研究使用了四種LMWH:tinzaparin、dalteparin 、enoxaparin、nadroparin,其中優先使用的是enoxaparin。
4、ACE2抗體顯著抑制了SARS-CoV-2假病毒與Huh7.5細胞的結合(如前面要點2下的附圖A所示);
ACE2抗體、UF heparin、enoxaparin都極大抑制了SARS-CoV-2假病毒對293T-ACE2細胞的感染(上圖D)。
這兩組結果表明,ACE2介導的SARS-CoV-2感染需要HS/HSPG,而HS/HSPG參與的SARS-CoV-2感染也需要ACE2,因此,HS/HSPG在SARS-CoV-2感染中是ACE2的共受體。
293T細胞即HEK293T細胞,是HEK293(Human Embryonic Kidney Cells 293,人胚胎腎細胞293)的衍生細胞系。293T-ACE2細胞是轉染過表達ACE2的293T細胞,293T細胞自身應該不表達或極少表達ACE2。
5、UF heparin和LMWH(enoxaparin)有效抑制了SARS-COV-2假病毒、真病毒對兩種極化狀態的上皮細胞Caco-2(下圖C)和Calu-3(下圖D)的感染。
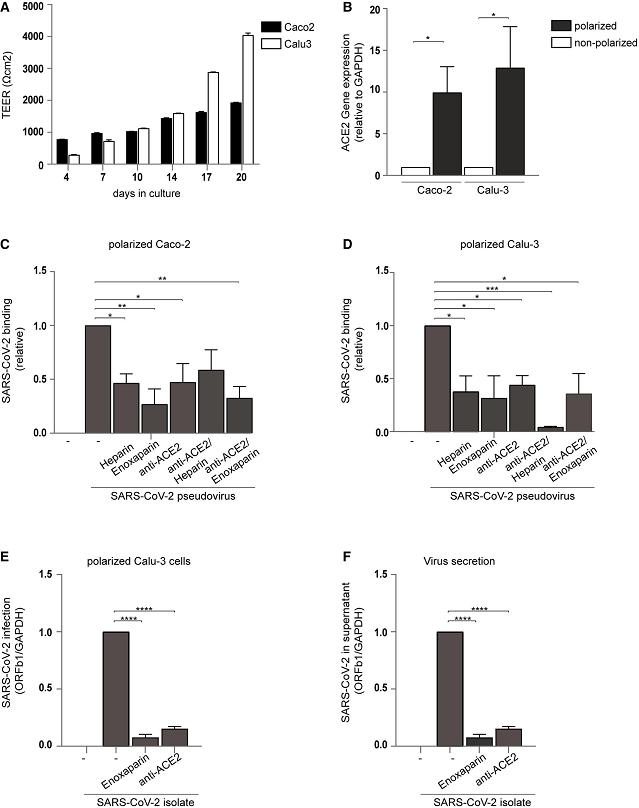
UF heparin、LMWH抑制SARS-2假病毒對極化的上皮細胞Caco-2、Calu-3的感染
圖C:UF heparin、enoxaparin、anti-ACE2抑制SARS-2假病毒與Caco-2細胞的結合;
圖D:UF heparin、enoxaparin、anti-ACE2抑制SARS-2假病毒與Calu-3細胞的結合;
圖E、圖F:enoxaparin、anti-ACE2抑制SARS-CoV-2真病毒對Calu-3細胞的感染。
圖E對應(PCR測得的)成功感染的SARS-CoV-2相對計數;圖F對應(PCR測得的)感染後複製產生並分泌到上清液(supernatant)中的SARS-CoV-2相對計數。
Caco-2是一種結直腸腺癌細胞系;
Calu-3是一種支氣管腺癌細胞系;
SARS-CoV-2 isolate是一個分離自Italy的毒株。
筆者對極化的細胞認識欠清晰、確切。細胞在安靜(未受刺激)時,細胞膜兩側外正內負的帶電狀態稱為膜的極化狀態,極化的細胞可能指細胞膜處於極化狀態的,帶電狀態外正內負的細胞,或膜內外電位達到某一數值的細胞。大多數高等生物體在未受刺激時維持帶負電的內部環境。HS/HSPG的聚糖鏈帶高負電荷,極化的細胞外部帶正電荷,二者容易相互吸引、結合。上圖B顯示,極化狀態的Caco-2、Calu-3細胞的ACE2表達遠高於非極化狀態的Caco-2、Calu-3細胞,不清楚造成這種突出差異的原因。
6、HSPG對SARS-CoV-2的細胞結合很重要。兩種HSPG Syndecan 1或Syndecan 4的轉染表達顯著提升了SARS-CoV-2假病毒、真病毒與Namalwa細胞的結合;外源性UF heparin和LMWH(enoxaparin)均顯著抑制了SARS-CoV-2假病毒、真病毒與Namalwa細胞的結合。如下圖所示:
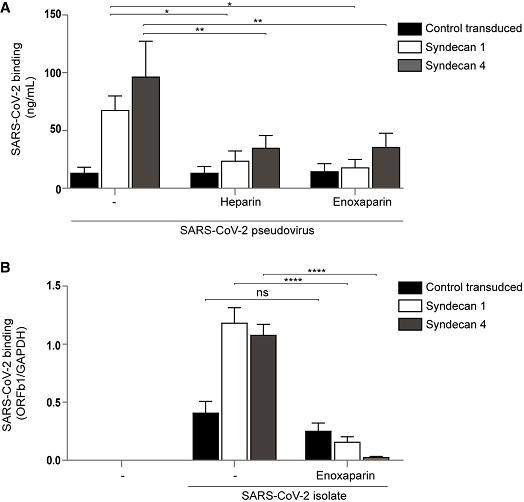
圖A:Syndecan 1或Syndecan 4的轉染表達顯著提升了SARS-2假病毒與Namalwa細胞的結合;UF heparin、enoxaparin顯著抑制了SARS-2假病毒與Namalwa細胞的結合。
圖B:Syndecan 1或Syndecan 4的轉染表達顯著提升了SARS-2真病毒與Namalwa細胞的結合;enoxaparin顯著抑制了SARS-2真病毒與Namalwa細胞的結合。
Namalwa是一種人淋巴瘤細胞系,Namalwa細胞本身既不表達HS/HSPG,也不表達ACE2。SARS-2可結合轉染表達HSPG的Namalwa細胞(與細胞表面的HSPG結合),但未造成感染(未進入細胞)。
7、三種SARS-CoV-2中和抗體COVA1-18、COVA2-15、COVA1-21有效抑制了SARS-CoV-2與轉染表達Syndecan 1的Namalwa細胞的結合,三種抗體的抑制效果與enoxaparin相當。一些SARS-CoV-2的非中和抗體沒有相應的抑製作用。如下圖所示:
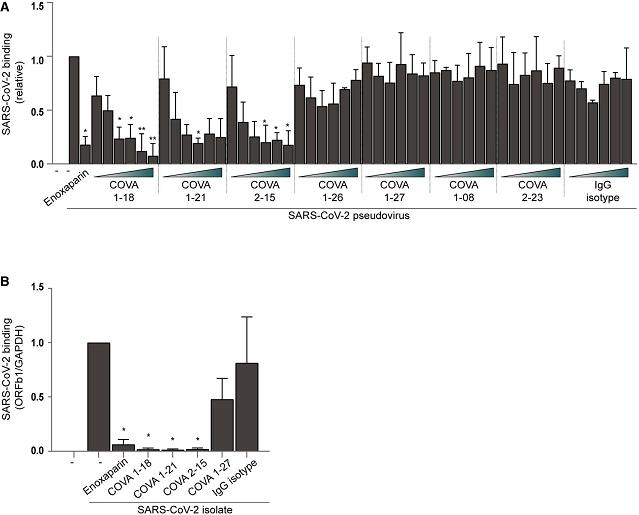
圖A:COVA1-18、COVA2-15、COVA1-21、enoxaparin有效抑制了SARS-2假病毒與Syndecan 1-Namalwa細胞的結合;
圖B:COVA1-18、COVA2-15、COVA1-21、enoxaparin有效抑制了SARS-2真病毒與Syndecan 1-Namalwa細胞的結合。
這些結果再次表明,SARS-2通過S蛋白結合HSPG,從而與細胞結合。
筆者註:三種SARS-2中和抗體的SARS-2-S RBD結合位點,與Syndecan 1或HSPG的SARS-2-S RBD結合位點應該存在重合、競爭。
8、不表達ACE2的樹突狀細胞(DC,Dendritic Cells)和皮膚粘膜朗格漢斯細胞(LC,Langerhans cells,DC細胞的一個子類)不會被SARS-CoV-2感染,但這兩個DC亞群可通過HSPG(硫酸乙酰肝素蛋白聚糖)有效結合、捕獲SARS-CoV-2,並將病毒傳播給表達ACE2的人肝臟Huh7.5細胞,並導致Huh7.5細胞被感染。這(攜帶SARS-2的DC細胞的遷移)也可能是SARS-CoV-2從呼吸道粘膜到達、感染淋巴組織的傳播途徑。
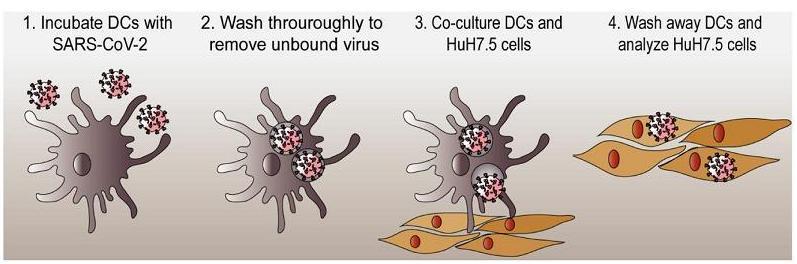
ACE2陰性的DC細胞結合、攜帶SARS-2並造成ACE2陽性的Huh7.5被感染
SARS-CoV-2的上述傳播方式與DC細胞體內傳播HIV-1相似。
9、LMWH(enoxaparin)可防止DC細胞亞群體內傳播SARS-CoV-2。
10、SARS-CoV-2真病毒可結合、感染原代鼻細胞(primary nasal cells),使用enoxaparin可顯著抑制結合與感染,這表明HSPG參與SARS-2對原代鼻細胞的感染。
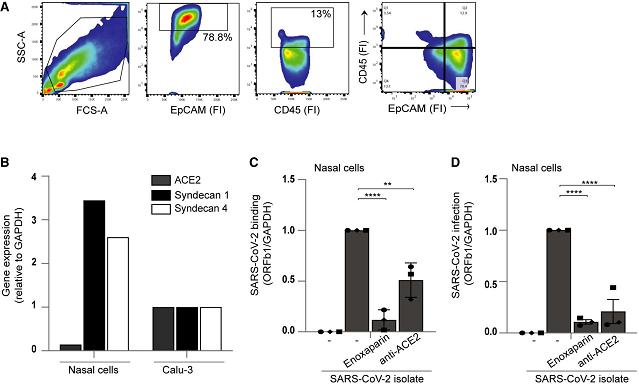
圖B:原代鼻細胞高表達兩種HSPG,同時有少量ACE2表達;
圖C:SARS-2可結合原代鼻細胞,enoxaparin、anti-ACE2不同程度抑制二者的結合;
圖D:SARS-2可感染原代鼻細胞,enoxaparin、anti-ACE2不同程度抑制SARS-2對原代鼻細胞的感染。
論文依據三
Heparan Sulfate Facilitates Spike Protein-Mediated SARS-CoV-2 Host Cell Invasion and Contributes to Increased Infection of SARS-CoV-2 G614 Mutant and in Lung Cancer
硫酸乙酰肝素促進刺突蛋白介導的SARS-CoV-2宿主細胞侵襲,並增加了SARS-CoV-2 G614突變體和肺癌(患者)的感染
https://www.frontiersin.org/articles/10.3389/fmolb.2021.649575/full
論文指出:
1、硫酸乙酰肝素(HS)可以結合SARS-CoV-2刺突蛋白(S蛋白),並在細胞表面與ACE2協同介導SARS-CoV-2對宿主細胞的感染;
2、宿主細胞表面(應指細胞膜)與SARS-2-S的結合取決於宿主細胞表面的HS表達,這種結合是SARS-CoV-2感染宿主細胞所必需的;
3、SARS-CoV-2 S蛋白與細胞的結合可以被肝素裂解酶HSase、HS拮抗劑surfen、肝素(heparin,HP)和多種肝素衍生物阻斷;
4、肝素/HS與SARS-2-S的結合主要由它們的整體硫酸化決定,特定SARS-2-S結合基序對結合的潛在貢獻較小;
5、SARS-2-S G614突變體與肝素的較高結合親和力和上調的HS表達,可能是SARS-CoV-2 G614突變體具有較高傳染性,和肺癌患者對SARS-CoV-2感染高度易感的部分原因;
6、SARS-CoV-2 G614變體假病毒對宿主細胞的較高感染以及HS表達上調引起的感染增強可被肝素裂解酶HSase和肝素有效阻斷,也可能被surfen和肝素衍生物阻斷;
7、我們的研究結果支持,阻斷HS與SARS-2-S的相互作用可能有助於COVID-19的預防和治療。
SARS-CoV-2 G614突變體即D614G突變體,其S蛋白第614氨基酸由天冬氨酸D突變為甘氨酸G。G614突變體感染能力更強,傳播更快,其感染滴度相比D614毒株增加2.6至9.3倍。G614突變體2020年1月底在中國和德國收集的病毒中開始被檢測到,2020年5月前後,G614突變體成為全球主導性的SARS-CoV-2 毒株。
其它論文依據或相關論文
Heparan sulfate assists SARS-CoV-2 in cell entry and can be targeted by approved drugs in vitro
硫酸乙酰肝素協助SARS-CoV-2進入細胞,並可被批準的體外藥物靶向
https://www.nature.com/articles/s41421-020-00222-5
Host and viral determinants for efficient SARS-CoV-2 infection of the human lung
SARS-CoV-2有效感染人肺的宿主和病毒決定因素
https://www.nature.com/articles/s41467-020-20457-w
Heparan Sulfate Proteoglycans in Viral Infection and Treatment: A Special Focus on SARS-CoV-2
病毒感染和治療中的硫酸乙酰肝素蛋白多糖(HSPGs):對SARS-CoV-2的特別關注
https://www.mdpi.com/1422-0067/22/12/6574
Characterization of heparin and severe acute respiratory syndrome-related coronavirus 2 (SARS-CoV-2) spike glycoprotein binding interactions
肝素和嚴重急性呼吸綜合徵相關冠狀病毒2(SARS-CoV-2)刺突糖蛋白結合相互作用的表徵
https://pubmed.ncbi.nlm.nih.gov/32653452/
6、Vimentin(VIM)
Vimentin(VIM),波形蛋白,也叫波形纖維蛋白,是一種III型中間絲蛋白質(Intermediate Filament Protein)。
中間絲蛋白是真核生物細胞的重要結構蛋白,中間絲蛋白、微管蛋白、肌動蛋白微細絲,三者合稱細胞骨架(蛋白)。
波形蛋白是間質細胞骨架的主要組成部分。波形蛋白圍繞細胞核並跨越細胞外圍,在細胞內形成動態且靈活的網絡,維持細胞的結構、形態、完整性,並在多種細胞事件中發揮重要作用。
波形蛋白(Vimentin)形態示意圖
Vimentin(VIM)是細胞分化過程中最先表達的蛋白。VIM在成纖維細胞(結締組織中最常見的細胞)、內皮細胞、平滑肌細胞、黑色素細胞、雪旺細胞(Schwann cell,神經膠質細胞、神經膜細胞)、多種免疫系統細胞(巨噬細胞、單核細胞、粒細胞以及T和B淋巴細胞)等等間充質來源的細胞及軟組織中廣泛表達,Vimentin也在肺泡II型細胞和鼻杯狀分泌細胞中表達,vimentin還在多種腫瘤組織中高表達,並與腫瘤的發生、發展和侵襲轉移密切相關。
波形蛋白(Vimentin,VIM)主要位於細胞質中,它也出現在細胞膜表面和細胞外介質中,在一些細胞(如II型肺泡細胞和鼻腔分泌細胞)表面,波形蛋白有很高的表達。
細胞表面的波形蛋白是多種病菌、病毒感染細胞所需的受體、共受體或附着因子,這些病原體包括Escherichia coli K1(大腸桿菌K1,新生兒腦膜炎的病原體)、Streptococcus pyogenes(化膿性鏈球菌)、enterovirus 71(腸道病毒71型)、dengue virus(登革熱病毒)、cowpea mosaic virus(豇豆花葉病毒,一種植物病毒)、Japanese encephalitis virus (日本腦炎病毒)、human papillomavirus(HPV,人乳頭瘤病毒,尖銳濕疣的病原體)、SARS-CoV等,其中,vimentin是SARS-CoV-1的主要受體ACE2的共受體(輔助受體)。
類似SARS-CoV-1,vimentin也是SARS-CoV-2的重要受體ACE2的共受體(輔助受體)。
論文依據一
Vimentin is an important ACE2 co-receptor for SARS-CoV-2 in epithelial cells
波形蛋白是SARS-CoV-2在上皮細胞中的一種重要ACE2共受體
https://www.cell.com/iscience/fulltext/S2589-0042(22)01735-7
https://www.sciencedirect.com/science/article/pii/S2589004222017357
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9618295/
論文指出:
1、SARS-COV-2感染上調波形蛋白在細胞表面的表達。
2、SARS-COV-2對A549細胞的感染能力微弱,相比表達ACE2的Vero E6細胞和Caco-2細胞,A549細胞中的SARS-COV-2拷貝數低300倍。A549細胞高水平表達波形蛋白,但不表達ACE2。這表明波形蛋白不能獨立介導SARS-COV-2感染。
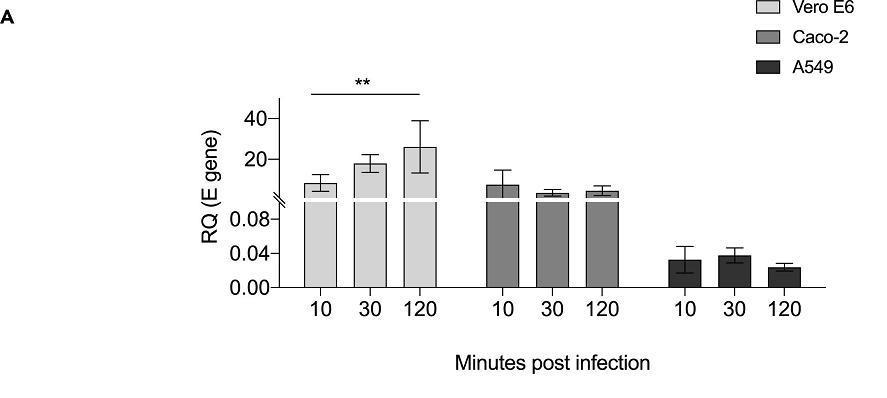
SARS-COV-2對Vero E6、Caco-2、A549細胞的感染能力
提醒列位注意,縱坐標的上下兩段不是等比例的,條柱高度比不代表感染能力比。
RQ:Relative Quantity,相對數量;
RQ(E gene):(感染進入細胞中的)SARS-COV-2 E蛋白基因的(qPCR檢測)相對數量。E蛋白即包膜蛋白(envelope)。
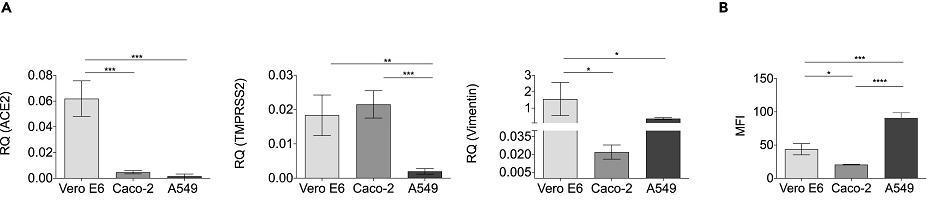
圖A:通過qPCR檢測ACE2、TMPRSS2、vimentin在三種細胞中的表達豐度;
圖B:通過流式細胞術評估細胞外表vimentin的表達豐度,並表示為平均熒光強度(MFI)。
MFI:mean fluorescence intensity,平均熒光強度。
3、SARS-COV-2 S蛋白、波形蛋白、ACE2在上皮細胞(Vero E6細胞)表面相互作用,形成三分子複合物,SARS-COV-2通過三者的相互作用進入細胞。當細胞未被感染時,觀察不到波形蛋白與ACE2之間的相互作用(VIM-ACE2的相互作用與SARS-2感染掛鈎)。2、3表明,波形蛋白是SARS-COV-2的重要受體ACE2的共受體(輔助受體)。
4、細胞表面波形蛋白的存在有利於SARS-COV-2感染。SARS-CoV-2對Caco-2細胞的感染效率低於Vero E6細胞(見前圖)。Caco-2細胞高表達ACE2但幾乎不表達波形蛋白,而Vero E6細胞同時高表達ACE2和波形蛋白(見上圖)。
5、抑制細胞表面的波形蛋白降低了SARS-COV-2的細胞進入和細胞毒性。
a)用波形蛋白結合、干擾、重組劑withaferin A(WFA)或抗波形蛋白V9單克隆抗體預處理Vero E6細胞,都可使SARS-COV-2感染減少50%以上。
withaferin A(WFA,醉茄素A)是一種類固醇內酯,能夠結合波形蛋白,擾亂其表達,並誘導波形蛋白在細胞核周圍重組為核周聚集體。
b)相比未經處理的Vero E6細胞,用WFA或V9抗體預處理Vero E6細胞提高了細胞感染後48小時的活力,這表明抑制波形蛋白可以抑制SARS-COV-2的細胞毒性,減少或減緩細胞死亡。
6、波形蛋白與SARS-COV-2的相互作用調節炎性細胞因子和趨化因子的表達,抗波形蛋白V9單克隆抗體預處理導致IL-6表達下降15倍,CCL5和CXCL10表達下降10倍,這些數據表明波形蛋白參與(、影響)SARS-CoV-2介導的細胞死亡和上皮炎症反應。
IL-6,一種多效細胞因子,細胞因子風暴的誘因;
CCL5,一種趨化因子,誘發白細胞/免疫細胞附着及轉移至發炎部位;
CXCL10,一種趨化因子,是活化的T淋巴細胞、單核細胞、巨噬細胞、自然殺傷細胞等白細胞/免疫細胞的化學引誘劑,可趨化上述細胞到達炎症部位,發揮抗炎免疫作用。CXCL10基因也是一種血管抑制因子。
7、實驗表明,波形蛋白與SARS-CoV-2原始毒株S蛋白的相互作用,對原始毒株感染的促進在omicron變體中得到了保持,即omicron變體S蛋白的一系列突變沒有改變波形蛋白與SARS-CoV-2 S蛋白的相互作用,沒有改變波形蛋白對SARS-CoV-2感染能力的促進作用。
8、總之,我們的數據表明,在SARS-COV-2感染中,細胞表面波形蛋白是ACE2的共受體。
論文依據二
Extracellular vimentin is an attachment factor that facilitates SARS-CoV-2 entry into human endothelial cells
細胞外波形蛋白是促進SARS-COV-2進入人內皮細胞的附着因子
https://www.pnas.org/doi/10.1073/pnas.2113874119
論文指出:
1、使用液相色譜-串聯質譜法(LC-MS/MS),鑑定出vimentin(VIM)是一種與SARS-CoV-2 S蛋白結合的蛋白質,S蛋白通過其受體結合域(RBD)與細胞外表的VIM相互作用、結合;VIM在SARS-COV-2感染中充當ACE2的共受體(輔助受體)。
2、SARS-CoV-2對HEK-293細胞的感染能力微弱。HEK-293細胞既不表達ACE2,也不表達VIM(波形蛋白);
對轉染表達VIM的HEK-293細胞,SARS-CoV-2的感染能力沒有明顯提升;
對轉染表達ACE2的HEK-293細胞,SARS-CoV-2的感染能力顯著提升;
對同時轉染ACE2和VIM的HEK-293細胞,SARS-CoV-2的感染能力進一步提升。
如下圖B所示:
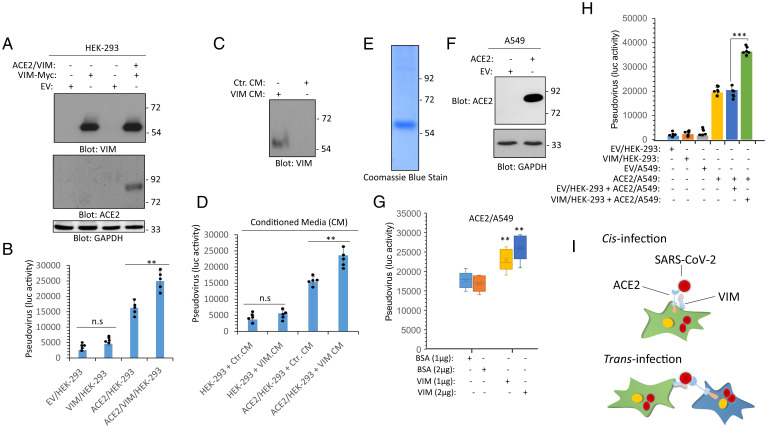
可見,VIM與ACE2的共表達促進SARS-CoV-2對HEK-293細胞的感染,VIM對SARS-CoV-2感染的促進依賴於ACE2的存在。
該組感染實驗所用病毒為以SARS-CoV-2 S蛋白嵌合製作的假病毒。
3、VIM、ACE2的跨細胞表達也能顯著提升SARS-CoV-2的感染。將VIM/HEK-293細胞(轉染表達VIM的HEK-293細胞)與ACE2/A549細胞(轉染表達ACE2的A549 細胞)共培養顯著提升了SARS-CoV-2對ACE2/A549 細胞的感染。如上圖H所示。
4、VIM可同時與SARS-COV-2 S和ACE2相互作用;VIM與ACE2的相互作用提升了SARS-COV-2 S與ACE2的結合效率,並使結合更牢固;SARS-2 S-RBD的VIM結合位點,與S-RBD的ACE2結合位點不同。
5、一種SARS中和抗體CR3022可識別、結合SARS-CoV-2-S-RBD中的獨特表位(如下圖A所示),CR3022抗體不干擾、抑制S與ACE2的結合,但干擾、抑制SARS-2 S-RBD與VIM的結合。這表明,SARS-2 S-RBD結合VIM的部位,與其結合CR3022抗體的部位存在重合。CR3022抗體是從SARS患者恢復期血漿中鑑定出來的。
6、CR3022抗體抑制SARS-CoV-2對HUVEC-TERT細胞的感染,但當HUVEC-TERT細胞敲低了VIM表達時,CR3022對SARS-2感染沒有明顯的抑製作用。即CR3022抗體對SARS-CoV-2感染的抑制僅對充分表達VIM的細胞有效(CR3022實質上是在干擾、抑制SARS-2 S與VIM的結合)。如下圖F所示:
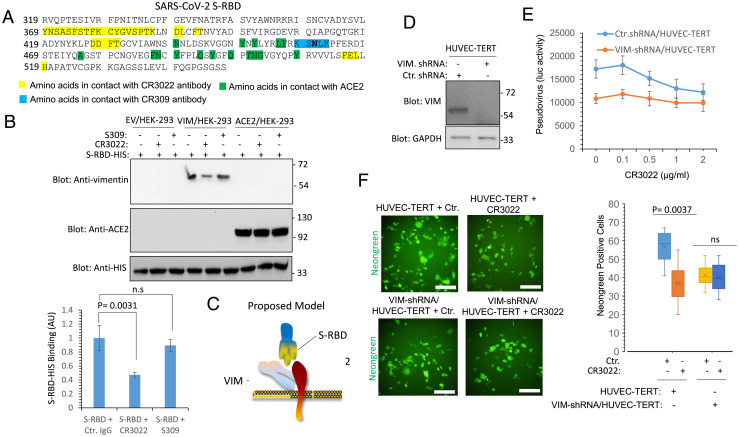
HUVEC-TERT:human umbilical vein endothelial cells,人臍靜脈內皮細胞;
VIM-shRNA/HUVEC-TERT:通過shRNA敲低了VIM表達的HUVEC-TERT細胞;
shRNA:hort-hairpin RNA,短髮夾RNA ,可用於基因沉默,干擾、抑制特定基因。
7、相關實驗進一步表明,SARS-CoV-2對共表達VIM 和ACE2的HEK-293細胞的感染率明顯高於僅表達ACE2的細胞(下圖A);敲低VIM顯著抑制了SARS-CoV-2對HUVEC-TERT細胞的感染(下圖B)。
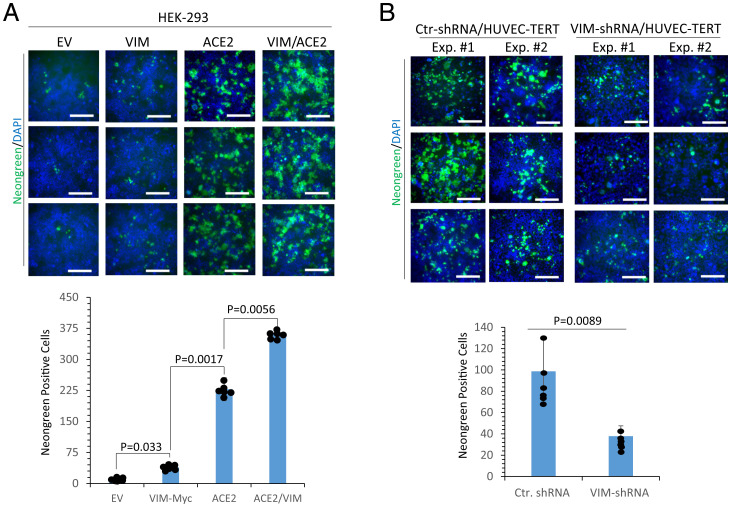
8、內皮細胞是SARS-CoV-2的直接感染靶標,內皮細胞感染以及SARS-CoV-2誘導的炎症反應可導致多種症狀(其中兩種是血管生成改變和神經系統症狀)。SARS-CoV-2誘導的內皮損傷、血管血栓形成和凝血病,以及馮維勒布蘭德因子上調,都是嚴重COVID-19的臨床標誌。
9 、總之,VIM是SARS-CoV-2的附着因子和輔助受體,可增強ACE2依賴性病毒進入,在SARS-CoV-2感染人內皮細胞中發揮重要作用。
論文依據三
Extracellular Vimentin as a Target Against SARS-CoV-2 Host Cell Invasion
細胞外波形蛋白是SARS-COV-2侵襲宿主細胞的靶標
https://onlinelibrary.wiley.com/doi/full/10.1002/smll.202105640
論文指出:
1、動態光散射顯示波形蛋白與帶有SARS-CoV-2 S蛋白的假病毒結合;
2、針對波形蛋白的抗體可在體外阻斷SARS-CoV-2假病毒對表達ACE2的細胞的感染;
3、1、2表明細胞外波形蛋白是SARS-CoV-2的受體ACE2的共同受體;
4、SARS-CoV-2 S蛋白與波形蛋白的結合親和力小於S蛋白與ACE2的結合親和力;
5、細胞外波形蛋白可能作為SARS-CoV-2 S蛋白-ACE2複合物的關鍵成分,介導SARS-CoV-2進入細胞;
6、波形蛋白靶向藥物可能預防和減緩SARS-CoV-2感染。
論文依據四
Physicochemical Nature of SARS-CoV-2 Spike Protein Binding to Human Vimentin
SARS-COV-2刺突蛋白與人類波形蛋白結合的物理化學性質
https://pubs.acs.org/doi/10.1021/acsami.3c03347
論文“Conclusions”部分譯文大致如下:
使用AFM(atomic force microscopy,原子力顯微鏡)和QCM-D(quartz crystal microbalance with energy dissipation,具有能量耗散的石英晶體微天平)方法,對SARS-CoV-2原始毒株和三種變體(巴西、南非和英國)的S1 RBD與Vim之間相互作用的生物力學和動力學進行了研究,為S1 RBD與Vim相互作用的機械強度和穩定性提供了新的證據。證實了先前生物學研究的結果,即確定Vim是病毒進入宿主細胞的可能附着面。此外,還對SARS-CoV-2–ACE2與Vim二聚體之間的假定相互作用場景進行了原位探索,驗證了Vim-S1 RBD與ACE2-S1 RBD之間可能的接觸殘基。我們的研究結果將有助於充分了解病毒進入宿主細胞的機制、開發安全有效的預防以及治療Covid-19的新方法。Vim和病毒融合蛋白之間的界面相互作用研究還可用於開發新的功能性抗病毒材料或生產模擬SARS-CoV-2病毒顆粒的納米粒子,用於(便利的)實驗室的生物研究,無需達到處理天然SARS-CoV-2毒株所需的生物安全級別3,考慮到SARS-CoV-2病毒和後續突變引起的疾病在未來幾年將繼續成為醫學領域的主要挑戰之一,這一點尤為重要。
其它相關論文
Vimentin as a target for the treatment of COVID-19
波形蛋白作為COVID-19治療的靶點
https://bmjopenrespres.bmj.com/content/7/1/e000623
Extracellular vimentin is sufficient to promote cell attachment, spreading, and motility by a mechanism involving N-acetyl glucosamine-containing structures
細胞外波形蛋白足以通過與含N-乙酰葡萄糖胺結構相關的機制來促進細胞附着,擴散和運動
https://www.jbc.org/article/S0021-9258(23)01991-9/fulltext
(未完待續)




























