新冠君,快收了您的變異神通吧!
1. SARS-CoV-2的backbone,是由SARS-CoV與CoVZC45嵌合而成的。
SARS-CoV-2就是新冠病毒,SARS-CoV是非典病毒,這大家都知道。那個CoVZC45(bat-SL-CoVZC45)是啥?它是2017年發現的一種舟山蝙蝠(類SARS)病毒。為啥要提這個病毒?因為它是SARS-CoV-2(2019-nCoV)最近的親戚,在進化樹上,它和SARS-CoV-2親緣關係最近。見下圖。
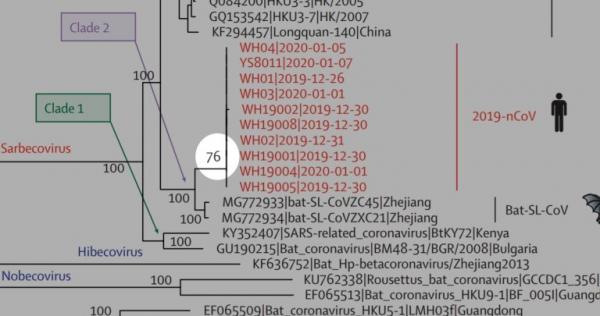
CoVZC45和SARS-CoV-2很像嗎?它們的相似度是87.5%。也不是很像嘛!我們作個小解剖,比較一下它們各蛋白的一致性:
E蛋白(Envelope包膜蛋白)和非結構蛋白nsp7亞基的一致性是100%,
M蛋白(Membrane膜糖蛋白)一致性是98.6%,
N蛋白(Nucleocapsid核殼蛋白)一致性是94%,
S2蛋白(spike刺突蛋白的後半部分)一致性是95%,
S1蛋白(spike刺突蛋白的前半部分)的一致性為69%。
大家可能注意到了,除S1蛋白外,其它各蛋白的一致性都不低於94%。那麼問題來了,為啥偏偏S1蛋白的一致性那麼低,只有69%?答案是:SARS-CoV-2的S1蛋白里有那麼一段,是從別的病毒“粘”過來的,大大拉低了S1蛋白的一致性。從哪個病毒“粘”過來的,就是SARS-CoV。
說得具體點,把SARS-CoV病毒S1蛋白的RBD區域,“粘”到CoVZC45的相應位置,得到的嵌合病毒,就是中間階段的SARS-CoV-2。
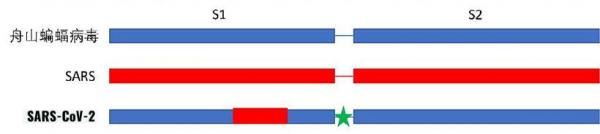
以CoVZC45和SARS-CoV嵌合得到SARS-CoV-2主幹示意圖。
實際從SARS-CoV“粘貼”過來的區域,並不恰恰是RBD,而是比RBD要寬一些,不妨稱之為擴展RBD。實驗室製備SARS-CoV-2過程中,將SARS-CoV的(擴展)RBD“粘貼”至CoVZC45骨架這一異常生硬的非自然步驟,使SARS-CoV-2與CoVZC45二者的序列一致性線圖出現了一個長中斷。見下圖。
NCBI Blast工具生成的SARS-CoV-2與舟山病毒CoVZC45序列一致性dot plot。
圖中有非常明顯的間斷gap,這一間斷gap正好對應着“粘貼”自SARS-CoV的擴展RBD。
註:NC_045512是SARS-CoV-2的NCBI refseq,MG772933是CoVZC45的Accession number。
為啥要把SARS-CoV的RBD粘到CoVZC45上去?因為CoVZC45不能感染人,因為要把它改造成能感染人的病毒。
為什麼有的冠狀病毒能感染人,有的卻不能?冠狀病毒能不能感染人,關鍵在於,它有沒有能打開人體細胞的鑰匙。
冠狀病毒的鑰匙是啥東東?
冠狀病毒以其外表“皇冠”狀突起而得名,這些突起是由冠狀病毒的S蛋白所形成的。S蛋白即spike蛋白,也叫做刺突蛋白或棘突蛋白。下面是一個冠狀病毒的示意圖。
S蛋白由向外突出的S1蛋白和S1蛋白之下的S2蛋白兩部分組成。S1蛋白負責與細胞表面的受體(如ACE2,TMPRSS2,CD4等)結合,如果S1蛋白能夠與細胞受體成功結合,那麼冠狀病毒就能夠進入、感染細胞。S1蛋白就是用來打開人體細胞的鑰匙。

S1蛋白與ACE2成功結合後,病毒就可以進入細胞。
S1蛋白能否與細胞受體結合,取決於它的空間結構、外部形態、靜電極性是否與細胞受體吻合、匹配。大多數冠狀病毒的S1蛋白鑰匙對人體細胞不好使,CoVZC45也是如此,SARS-CoV是少數有好使的S1蛋白鑰匙,能感染人體細胞的冠狀病毒之一。
細胞表面的ACE2等受體(Receptor)相當於細胞膜上的鎖,病毒的S1蛋白則相當於一把鑰匙。S1蛋白中有一個RBD(Receptor
Binding
Domain,受體結合域)區域,負責與細胞受體結合,它相當於鑰匙的“鑰齒”部位,對S1蛋白能否打開ACE2受體鎖具有決定性作用。
下圖示意了SARS-CoV-2(2019-nCoV)氨基酸序列,以及RBD在S蛋白氨基酸序列中的位置。
CoVZC45的S1蛋白不能與人體ACE2受體結合,所以舟山蝙蝠病毒不能感染人;SARS-CoV的S1蛋白能夠與人體ACE2受體結合,所以非典病毒能夠感染人。把SARS-CoV病毒的RBD“粘”到CoVZC45上,替換掉原有的RBD,相當於為CoVZC45重新配了一把對人體細胞好使的鑰匙,嵌合病毒有了這把新鑰匙,就能與ACE2受體結合了,就能進入、感染人體細胞了,從而,不能感染人的CoVZC45就被改造成了能感染人的新病毒。
註:人體ACE2受體是指血管緊張素轉換酶2(Angiotensin
Converting
Enzyme2)。人體多種細胞都會在其外表產生ACE2,如呼吸道上皮細胞,肺泡AT2細胞,T淋巴細胞等等。存在ACE2的器官或組織包括:人體呼吸道、肺;眼結膜、角膜;心臟;食管、胰腺、肝臟(肝內膽管)、迴腸;腎臟、膀胱;睾丸等等。
SARS-CoV-2的RBD與SARS-CoV的RBD具有很高的相似度,因為,SARS-CoV-2的的RBD就是從SARS-CoV“粘”過來的。見下圖。
SARS-CoV與SARS-CoV-2(2019-nCov)RBD氨基酸序列比照,紅色對應相同的氨基酸(殘基),白色對應不同的氨基酸(殘基)。
可以看到,雖然相似程度很高,但二者還是存在一些不同的氨基酸,這又是怎麼回事呢?因為把SARS-CoV的RBD粘過來之後,還需要對它作進一步的編輯和加工。對RBD或S1蛋白所做的進一步基因編輯,在後續的第2,第3,第5部分還將談及。
2. 進一步編輯RBD,對其中四個關鍵氨基酸作同構替換。
前面我們說到,SARS-CoV-2與SARS-CoV二者的RBD相似度很高,但仍有一些不同,這些不同來自進一步的基因編輯。本部分要談的是一組至為重要的RBD編輯--對RBD四個關鍵氨基酸所做的同構替換。
RBD中,有五個至關重要的氨基酸(殘基),它們在S1蛋白氨基酸序列中序號為第442、472、479、487、491(按照SARS-CoV的S蛋白序列編號),這五個氨基酸處在與細胞受體ACE2的接觸面上,是RBD“鑰齒”中的關鍵齒位。在SARS-CoV-2中,來自SARS-CoV~RBD的這五個關鍵氨基酸中的前四個(序號442、472、479、487)被換掉了,換成了新的氨基酸。

SARS-CoV-2與SARS-CoV,RBD部分氨基酸序列比照,在序號442、472、479、487四個位置上,二者的氨基酸發生了改變。
以上四個氨基酸的改變極不尋常,這體現在:
a) 所替換的四個氨基酸位於RBD的高度保守區域,通常這些氨基酸不會發生改變;
b) 新氨基酸是經過精心選擇的,它們與同位置的原有氨基酸的疏水性和靜電極性都非常相似;
c) 雖然發生了四個關鍵氨基酸的改變,但RBD的3-D結構幾乎沒有變化,替換前後,RBD的空間形態高度同構;
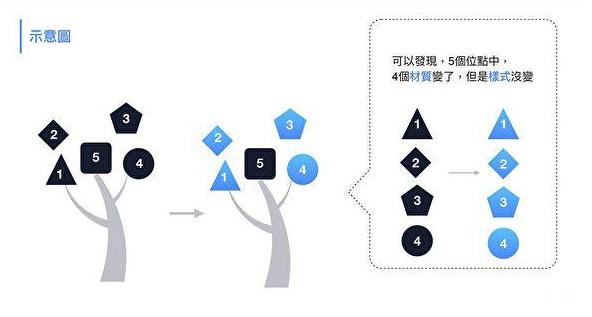
換掉四個關鍵氨基酸前後,S1蛋白RBD的空間結構、外部形態高度相似。
d) 新、舊RBD與ACE2受體接觸時發生的范德華力(一種分子間的電性引力)等靜電作用效果也很相似;
e)新RBD與ACE2的結合穩定性可能比原RBD稍差,但仍能與ACE2發生強相互作用;同時,新RBD與ACE2的結合親和力大大提高。
這意味着,SARS-CoV-2又精妙“進化”出了一副更好用的能感染人的蛋白鑰匙。
SARS-CoV-2仿佛在向人類宣告,它已經克服了自然進化的隨機性、盲目性,它已經具備了高度智能的,定向、明確且精準的進化能力;它在“自然進化”過程中“巧奪天工”的優異表現,不遜色於任何一位遺傳學、生物學、病理學大師,它稱得上是一位跨學科的學術界集大成者。關於SARS-CoV-2的神奇現在剛剛開頭,在本文後續內容中,SARS-CoV-2還將反覆展示它“自然進化”過程的非凡偉大。
2020年1月21日,來自中國科學院上海巴斯德研究所等單位的徐心恬、陳萍、王靖方等學者在SCIENCE
CHINA Life
Sciences(《中國科學:生命科學》)上發表了一篇論文,題為“源於武漢爆發的新型冠狀病毒的進化及其棘突蛋白對人類傳播風險的建模”(Evolution
of the novel coronavirus from the ongoing Wuhan outbreak and modeling
of its spike protein for risk of human transmission)。論文指出:
a)儘管新冠與SARS-CoV二者S蛋白的總體同源性較低,但二者的RBD區域卻有較高的同源性;
b)令我們驚訝的是,儘管替換了五個重要的界面氨基酸殘基中的四個,但新冠仍與人體ACE2有着顯著的結合親和力;
c)進一步觀察發現,新冠的S蛋白和SARS-CoV的S蛋白在RBD域具有幾乎相同的三維結構,在相互作用界面上保持了相似的范德華力和靜電性質。
2020年2月19日,美國德克薩斯大學奧斯汀分校Jason
S McLellan團隊,及國家過敏和傳染病研究所的研究人員在Science雜誌上聯合發表了題為“Cryo-EM Structure of
the 2019-nCoV Spike in the Prefusion Conformation”的論文。論文指出:
a) 2019-nCoV與SARS-CoV的RBD存在一定的構象差異,但當按某一角度對齊時,二者就呈現出較高程度的結構同源性。
b) 兩種病毒的S1蛋白與ACE2的複合體非常相似;
c) 2019-nCoV的S1蛋白與ACE2的結合親和力是SARS的10-20倍。
2020年5月17日,澳大利亞弗林德斯大學的一個科學家小組指出:SARS-CoV-2的S蛋白與人體ACE2的結合力,強過其與蝙蝠等可能的原始宿主或中間宿主動物ACE2的結合力,他們認為,這違反了病毒與新宿主的初始親和力應低於原宿主的常識。
對他們的研究結果可作出一個引申:SARS-CoV-2不象是來自動物,它更象是專門為人類量身定製的。
對RBD作保守編輯還有以下作用:
a) 淡化RBD嵌合痕跡,模糊SARS-CoV-2與SARS-CoV二者的RBD淵源;
b) RBD四個關鍵氨基酸的改變,使通常的針對SARS-CoV的RBD抗體藥物,對SARS-CoV-2失效。
RBD的蛋白可替代研究在幾年前就開始了,SARS-CoV-2中的RBD同構替換是對多年積累的研究成果的一次實用。
3. 繼續編輯S1蛋白,插入來自HIV-1的表面糖蛋白gp120和Gag蛋白
插入這兩種蛋白的目的,是賦予SARS-CoV-2感染T淋巴細胞,破壞人體免疫系統的能力。
2020年1月27日,印度理工學院(Indian
Institute of Technology)的普拉丹(Pradhan)教授,昆杜(Bishwajit
Kundu)教授等學者在生物預印本網站bioRxiv發表了那篇引起紛爭的論文:《2019-nCoV棘突蛋白中獨特插入片段與HIV-1的gp120(蛋白)和Gag(蛋白)的異常相似性》(Uncanny
similarity of unique inserts in the 2019-nCoV spike protein to HIV-1
gp120 and Gag)。論文要點如下:
a)
SARS-CoV-2的棘突糖蛋白(S蛋白)中有4個插入片段(氨基酸序列位置:404—409,462—467,136—150,366—384,皆位於S1蛋白內),這4個插入片段中的氨基酸(殘基),均與HIV-1(艾滋病病毒)的gp120蛋白(前三個插入片斷)或Gag蛋白(第四個插入片斷)相同或相似;
b)上述插入片斷在自然界中不太可能偶然發生,因為在SARS等其它冠狀病毒的S蛋白中,都沒有發現這種插入片段,病毒不太可能在短時間內自然地獲得這種非常獨特的插入片段;
c)gp120蛋白幫助HIV-1與另一種人類受體CD4結合,Gag蛋白也有幫助HIV-1與某些宿主細胞結合的作用。CD4受體通常附着在某些T淋巴細胞的表面,與其所附着的T淋巴細胞合稱CD4+T淋巴細胞,是人體免疫系統的重要部分。HIV-1可通過CD4感染T淋巴細胞,破壞人體免疫系統。
d)在S蛋白中插入gp120蛋白與Gag蛋白後,SARS-CoV-2將可能獲得與HIV-1類似的能力:感染、殺死CD4+T淋巴細胞,破壞人體免疫系統。
2020年1月24日,武漢市金銀潭醫院副院長黃朝林教授等人在《柳葉刀》上發表了一篇論文,題為:《中國武漢市2019年新型冠狀病毒感染患者的臨床特徵》(Clinical
features of patients infected with 2019 novel coronavirus in Wuhan,
China)。論文中指出:在所觀察的41名新冠早期患者中,63%的患者(26名)出現了淋巴細胞減少症狀。
此外,在中國《新型冠狀病毒肺炎診療方案》中,“淋巴細胞計數減少”是重症患者的重要識別特徵之一。
這充分證明,SARS-CoV-2確實具有感染並殺死淋巴細胞,損害人體免疫系統的能力。這種能力,可能來自或部分來自模仿HIV-1插入的gp120蛋白和Gag蛋白,如印度學者所指出的那樣。一些抗HIV-1藥物對SARS-CoV-2的療效也側證了印度學者的發現。
SARS-CoV中沒有HIV-1來源的gp120蛋白和Gag蛋白,在其他任何冠狀病毒中也都未發現這兩種蛋白,也就是說,唯一含有gp120蛋白和Gag蛋白的冠狀病毒,就是SARS-CoV-2。
SAR-CoV不能感染淋巴細胞,不具備破壞人體免疫系統的能力。
4. SARS-CoV-2在S1、S2蛋白交界處,精準“進化”出了Furin酶切位點
SARS-CoV-2中有一個恰位於S1、S2蛋白交界處的酶切位點,下圖中的五角星就代表這個酶切位點。

SARS-CoV-2屬於β譜系冠狀病毒。幾乎所有β譜系冠狀病毒都沒有酶切位點,包括SAR-CoV與舟山蝙蝠病毒CoVZC45。SARS-CoV-2的神奇之處在於,它不僅“進化”出了酶切位點,而且酶切位點恰恰位於S1、S2蛋白交界處,S蛋白的關節位置。
這個酶切位點是個什麼東東?原來,在SARS-CoV-2的S1、S2蛋白交界處,相比其它冠狀病毒多了四個氨基酸(殘基)“PRRA”,其中的“RRA”,與原序列中緊鄰的“R”連在一起,組合成“RRAR”。這四個氨基酸組合“RRAR”就是酶切位點標誌,它符合Furin酶切位點的識別模式“RXXR”。
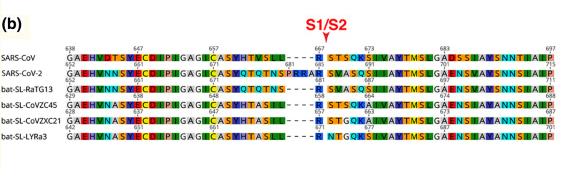
上圖第二行是SARS-CoV-2的氨基酸序列,第一行是SARS-CoV的氨基酸序列,第四行是舟山蝙蝠病毒CoVZC45的氨基酸序列。可以看到,第二行序列的S1/S2位置處插入了“PRRA”。
下面這兩個圖可以看得更清楚一些。


酶切位點,或者說那四個氨基酸組合,有啥用啊?
酶切位點“RRAR”可以被人類的弗林(furin)蛋白酶或其他蛋白酶識別,這些蛋白酶可以自酶切位置對S蛋白進行切割,使S蛋白的S1亞基與S2亞基分離。S1蛋白被切割脫落後,其後的S2蛋白和病毒包膜將得以與人體細胞膜直接接觸,二膜之間將發生“膜融合”,“膜融合”之後,包膜內的病毒RNA將第一時間被釋放入人體細胞,病毒RNA將在人體細胞內立即開始自我複製、轉錄,合成蛋白酶及蛋白質,組裝新病毒。
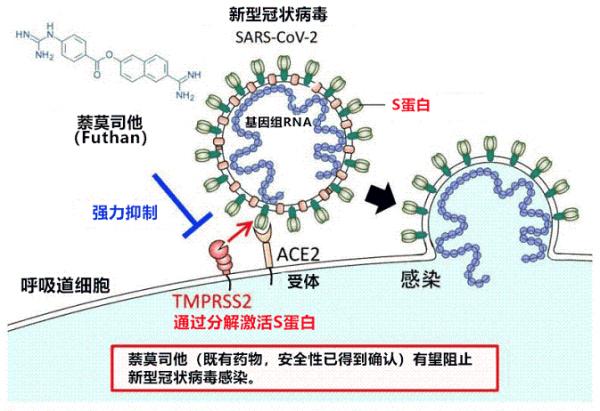
SARS-CoV-2與細胞膜發生“膜融合”後,病毒RNA將被第一時間釋放到細胞內。
沒有酶切位點的病毒又是什麼情況呢?
SARS-CoV沒有酶切位點,所以它不支持“膜融合”的感染方式。SARS-CoV感染細胞時,是通過一種“胞吞”的方式連皮帶核地被整個“吞”入細胞,雖然病毒已經進入到細胞內,但由於病毒RNA還被困在病毒包膜內,所以RNA複製、組裝新病毒的過程就被延緩了。SARS-CoV感染細胞的具體過程如下:
S1蛋白與人體細胞受體ACE2結合==>病毒被整個“胞吞”(囫圇吞棗)入人體細胞==>病毒的S1、S2蛋白,包膜蛋白在細胞內被蛋白酶分解、溶化==>病毒RNA被釋放出來==>RNA複製、轉錄,合成蛋白酶及蛋白質,組裝新病毒。
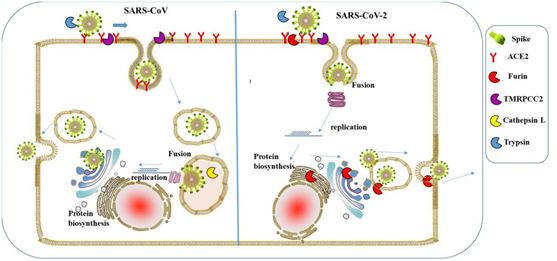
SARS-CoV“胞吞”與SARS-CoV-2“膜融合”對照圖
不難理解,SARS-CoV-2的“膜融合”感染方式,比SARS-CoV的“胞吞”感染方式,效率要高。
酶切位點是SARS-CoV-2一項非凡的“自我結構優化”,它帶來了病毒功能的多項強化,其中一項是:酶切位點使SARS-CoV-2的感染力、致病力、擴散力遠遠超過SARS-CoV。
2020年2月4日,南開大學高山、阮吉壽等在中國預印本論文平台ChinaXiv發表了一篇題為《武漢2019冠狀病毒S蛋白可能存在Furin蛋白酶切位點》的論文,論文指出:
a)此前發現的所有SARS和SARS樣(SARS-like)冠狀病毒都不具備新冠病毒(SARS-CoV-2)的酶切位點;
b)酶切位點增強了新冠病毒的感染、傳播能力。論文估算,2019-nCoV(即SARS-CoV-2)的侵染效率是SARS-CoV的約100到1000倍。
酶切位點在β譜系冠狀病毒中極為罕見,(在SARS-CoV-2出現之前)唯一具有酶切位點的β譜系冠狀病毒是鼠肝炎冠狀病毒;同時,所有與SARS-CoV-2刺突蛋白(S蛋白)相似度大於40%的病毒都沒有酶切位點。因此,SARS-CoV-2是在毫無積累,無可借鑑吸納,一窮二白的情況下,白手起家,無師自通,神跡般地“進化”出了酶切位點。
經估算,一百年內,舟山蝙蝠病毒CoVZC45(與SARS-CoV-2親緣關係最近)恰在S1、S2蛋白交界處自然變異出酶切位點“RRAR”“的幾率小於10的負10次方!參見“估算舟山蝙蝠Vir一千年內進化出酶切位點的幾率”一文。
在S1蛋白、S2蛋白交界處變異出furin酶切位點,再次展現了橫空出世,來歷不明的SARS-CoV-2不可思議的“自然變異”目的性、精準性、高智能性。
病毒界具有酶切位點的病毒,最著名的當屬兩種非冠狀病毒HIV-1(艾滋病病毒)和埃博拉病毒。具有酶切位點,是這兩種病毒非常強大的重要原因。對這兩種與它既無糾葛、又無淵源的病毒,SARS-CoV-2仿佛早有研究,仿佛深知酶切位點在HIV-1、埃博拉致病機理中的巨大作用,它好象無法抑制“進化”出酶切位點的強烈衝動。
HIV-1、埃博拉病毒破壞人體免疫系統的能力與酶切位點有關,酶切位點也賦予了SARS-CoV-2類似能力。機理是,當與T(淋巴)細胞(人體的主要免疫細胞)接觸時,SARS-CoV-2能夠藉助高效的膜融合,侵入,並且摧毀T細胞,從而創傷、破壞人體免疫系統。“膜融合”之所以能夠發生,就在於SARS-CoV-2恰在S1/S2處有一個酶切位點。
2020年4月7日,上海復旦大學研究組和紐約血液中心研究員姜世勃在論文醫學專刊《細胞分子免疫學》聯合發表論文指出:
SARS-CoV-2會破壞免疫系統,使患者無法抵抗感染;
當SARS-CoV-2和T細胞相互接觸時,SARS-CoV-2將通過病毒膜和細胞膜的附着,將自己的RNA基因輸入T細胞,導致T細胞毀壞;
與HIV不同的是,SARS-CoV-2可能和T細胞一起死亡,進入T細胞的SARS-CoV-2不會擴散到T細胞外。
至此,SARS-CoV-2已經擁有了兩套破壞免疫系統的機制。一是S蛋白中HIV-1來源(或相似)的gp120蛋白和Gag蛋白所賦予的,通過T細胞表面的CD4受體實現對T細胞感染的破壞機制;二是酶切位點-膜融合特性賦予的破壞機制,在這種情況下,SARS-CoV-2感染T細胞的媒介可能是T細胞表面的少量ACE2受體。
當人體免疫系統的T細胞、B細胞的表面受體(CD4或ACE2)與病毒(或抗原)結合時,可能觸發免疫系統過度應答,持續生成大量淋巴細胞、巨噬細胞,相關細胞還將分泌出大量細胞因子和體液,引發“細胞因子風暴”,這可能導致全身性炎症反應、多器官衰竭、高鐵血紅蛋白血症、急性呼吸窘迫綜合徵等症狀,對人體器官和組織造成重大損害,甚至使患者死亡。
SARS-CoV沒有酶切位點,它無法以“膜融合”方式感染T(淋巴)細胞。SARS-CoV不破壞人體免疫系統。
5. SARS-CoV-2的S蛋白中有一個獨特的O-Linked聚糖結構,使病毒可逃避免疫打擊
SARS-CoV-2的O-Linked聚糖結構怎麼來的呢?S蛋白氨基酸序列678位置上(S1蛋白的倒數第三個氨基酸)原來應是一個絲氨酸(S),只要把這個絲氨酸(S)換成蘇氨酸(T),那麼678位置上新的蘇氨酸(T),與673、687位置上的兩個絲氨酸(S)就形成了O-連接型聚糖結構(O-linked
glycans)。參見下圖。
SARS-CoV-2酶切位點周圍的一個蘇氨酸(T),二個絲氨酸(S)形成一個O-Linked聚糖結構。
S蛋白上的O-Linked聚糖結構能夠和人體細胞表面的蛋白質相互作用,產生一個“粘蛋白樣結構域”,“粘蛋白樣結構域”可充當SARS-CoV-2逃避人體免疫系統打擊的糖鏈屏障。籍着這一屏障,SARS-CoV-2可以
a) 隱蔽、持續地在人體內潛伏、複製,大大延緩了人體免疫反應;
b)藉助超長的潛伏期,及免疫逃避能力,幾乎無所不至地向各個器官擴散;
c)獲得了強悍的人體內適應生存能力,難以被人體徹底清除或根除。
現在,SARS-CoV-2已經擁有了破壞人體免疫系統和逃避人體免疫系統打擊的雙重能力,其生存力和致病力都極大地強化了。
SARS-CoV和CoVZC45都沒有O-Linked聚糖結構,在β譜系冠狀病毒中,有O-Linked聚糖結構的只有SARS-CoV-2。你能不再度驚嘆於SARS-CoV-2的獨具匠心,卓爾不群麼?!
O-連接型聚糖結構是從哪來的呢?是偷師埃博拉病毒山寨來的。
2020年2月16日,所謂的“病毒獵手”,美國哥倫比亞大學公共衛生學院感染與免疫中心主任伊恩·利普金(W.Ian
Lipkin),美國斯克里普斯研究所免疫學和微生物學副教授Kristian
Andersen博士(通訊作者)等五位學者在virological.org上發表一篇題為“The Proximal Origin of
SARS-CoV-2”的論文,3月18日,該論文又發表在《Nature
Medicine》雜誌上。論文稱:“SARS-CoV-2不會是實驗室工程製造而泄漏的病毒,而應該是病毒自然進化的產物。”。他們的理由之一是:
“即使的確存在一個不為科學界所知的病毒模板,(可)在其基礎上,通過長期細胞培養的方式逐步得到提高受體結合親和力的氨基酸突變的病毒,然而這個O-linked的聚糖結構不可能通過體外細胞培養的方式獲得,因為這種突變通常需要機體免疫系統的參與才能產生。”
這幾位大學者的裝B水平,和他們的身份很般配,其偷換問題的下流手法也能把不少人搞暈。問問這幾位權威,如果有人說,你到過殺人現場,那麼你的反駁是什麼?是“我根本沒去過殺人現場”,還是“我根本沒騎自行車去殺人現場”。
得到O-linked聚糖結構,非得用培養基礎病毒誘發其突變的套路嗎?你們真的沒想到,用基因剪刀把678位置上的絲氨酸(S)換成蘇氨酸(T),就能得到O-linked聚糖結構嗎?這樣的事,你們平時幹得很少嗎?


6. 在N蛋白基因編碼內插入了nsp3A編碼,以進一步完善免疫逃避能力。
非結構蛋白(NonStructural
Prtein,nsp),是指在病毒RNA中存在基因編碼信息,但不被組裝入病毒體,不作為病毒蛋白結構一部分出現的蛋白。冠狀病毒的非結構蛋白,在病毒複製過程中,由病毒編碼的兩條超長複製酶多肽pp1a/pp1ab水解產生,共有15或16個,它們參與調節病毒基因組RNA的複製和亞基因組RNA(主RNA生成的許多小RNA)的轉錄,參與其它蛋白的生成,參與病毒體組裝,並影響病毒特性。相對於非結構蛋白,既在病毒RNA中存在基因編碼信息,同時又被組裝入為病毒體,作為病毒蛋白結構的一部分的蛋白,叫做結構蛋白。
SARS-CoV-2
RNA基因組的近3萬個鹼基對,共轉錄29種蛋白質--4種結構蛋白,15-16種非結構蛋白,9種輔助蛋白。四種結構蛋白前文都已提到過:S蛋白(刺突蛋白),M蛋白(膜糖蛋白),N蛋白(核殼蛋白),E蛋白(包膜蛋白);非結構蛋白的例子包括:將其他非結構蛋白從兩條蛋白酶長鏈上“切割”出來的3C蛋白水解蛋白酶nsp5;在病毒複製和轉錄周期中發揮重要作用的nsp7、nsp8和nsp12;可能參與干擾宿主信號傳遞,降低宿主的免疫反應的nsp2;以及下面將說到的nsp3A。
nsp3A(非結構蛋白3A)是一個膜結合蛋白,它能夠在病毒感染過程中抑制宿主細胞的蛋白分泌,並抑制所分泌的蛋白從內質網(連接細胞核、細胞質、細胞膜的扁囊狀或細管狀隧道系統)至高爾基體(可理解成進出細胞的脂類、蛋白質接受檢查和處理的中轉站)的順序轉運,從而降低細胞分泌的干擾素-β(interferon-β,纖維母細胞分泌的可干擾病毒複製,破壞病毒RNA,摧毀未完成的病毒蛋白的人類糖蛋白)、IL-6(白細胞介素-6,在細胞間傳遞信號的細胞因子之一,有誘發急性期蛋白、參與造血、分化、引發炎症等作用)、IL-8(白細胞介素-8,另一種傳遞信號的細胞因子,可參與細胞免疫,調節炎症反應,趨化並激活中性粒細胞,
促進中性粒細胞的溶酶體酶活性和吞噬作用)和被感染細胞膜上的MHC-I抗原和 TNF受體的表達。
將nsp3A編碼入核衣殼蛋白(N蛋白,Nucleocapsid蛋白)可產生有以下功效:
a) 使SARS-CoV-2能夠抑制、干擾人體免疫反應,使免疫反應延遲或減弱,或者延遲後過度反應,引發“細胞因子風暴”,重創人體;
b)使N蛋白具備VSR(RNAi抑制子)活性,可有效對抗和反抑制由shRNAs(短髮夾RNA)或siRNAs(小分子干擾RNA)觸發的RNAi(RNA干擾);
c)進而使SARS-CoV-2能夠對抗、反制RNA干擾藥物,使通過干擾、抑制病毒RNA來促使病毒降解的RNAi免疫療法不能達到預期效果。。
nsp3A的引入,使SARS-CoV-2獲得了第二條免疫逃避途徑。
2017年6月21日,中國科學院武漢病毒研究所研究員周溪課題組與軍事醫學科學院微生物流行病研究所研究員秦成峰課題組合作,在抗病毒免疫研究方面取得新進展,揭示了RNA干擾(RNAi)通路在哺乳動物中具有抗病毒免疫功能。相關研究成果以Human
virus-derived small RNAs can confer antiviral immunity in
mammals(《人類病毒來源的小RNA在哺乳動物中產生抗病毒免疫反應》)為題發表在Immunity上。
在該研究中,研究者利用人腸道病毒71型(EV71)感染的人類體細胞及小鼠為模型,發現其非結構蛋白3A具有RNAi抑制子(VSR)功能。3A能夠通過與病毒dsRNA結合來阻止Dicer對其剪切,抑制vsiRNAs的產生。
該研究在人類體細胞及動物水平發現了病毒感染可以產生具抗病毒功能的vsiRNA,確證了RNAi在哺乳動物中是一條抗病毒天然免疫通路;同時,也揭示了一種人類病毒逃逸RNAi天然免疫的具體機制。
2020年02月22日,中國科學院武漢病毒研究所病毒學國家重點實驗室周溪教授及其團隊發表論文“2019新型冠狀病毒核衣殼蛋白N能發揮病毒編碼的RNAi抑制子功能”,指出:SARS-CoV-2編碼的核衣殼蛋白(N)有效地抑制了shRNAs或siRNAs觸發的RNAi;SARS-CoV-2的N蛋白在人類細胞中表現出VSR活性,這可能是新型冠狀病毒的一個關鍵免疫逃避因子。
gp120蛋白+Gag蛋白,酶切位點,O-Linked聚糖結構,nsp3A,SARS-CoV-2為自己設計了全方位的抗免疫、破免疫能力,集四大抗免疫、破免疫利器於一身。如此完善的“自然進化”結果不令你震撼嗎?你能想象,兼具頂級病理學家專業水準和高素養科研人員細緻周密的,居然是一個冠狀病毒嗎?
小結
簡單小結一下SARS-CoV-2的偉大進化過程:
1)進化出了能感染人的S1蛋白鑰匙;
2)進化出了優化的,有10-20倍ACE2結合親和力的新鑰匙;
3)剛剛感染人,就進化出了與HIV-1極為相似的兩種蛋白,具備了感染、殺死CD4+T淋巴細胞,破壞人體免疫系統的能力;
4)恰恰在三萬個鹼基對中的S1/S2交界處,進化出了威力強大的酶切位點,不僅感染力、致病力、擴散力極大增強,還獲得了第二種破壞人體免疫功能的機制;
5)在S蛋白中進化出了O-Linked聚糖結構,得以獲得逃避人體免疫打擊的糖鏈屏障;
6)在N蛋白中進化出了非結構蛋白3A,能夠干擾、抑制人體免疫反應,對抗、反制RNI干擾,進一步完善了免疫逃避能力;
新冠君,你的進化速度遠勝風馳電掣,你從不擔心自己自然進化的步子邁得太大太猛太不自然,因為你沒有蛋,步子邁得再大再猛再不自然,也扯不着蛋。
新冠君,在自然進化過程中,你多次模仿了HIV-1和埃博拉病毒的結構、機制,你是在向兩位著名異族前輩致敬麼?
新冠君,你是最與眾不同,最出類拔萃的毒物。別的病毒,取得以上任何一項重要變異都要經過漫長歲月的洗禮。你初出茅廬,剛剛開始感染人類,就自然變異出這麼多你的遠近親戚聞所未聞,讓人類眼花繚亂、目瞪口呆、吃盡苦頭、束手無策的神奇結構,病毒界古往今來所有的佼佼者,都對你頂禮膜拜,奉你為前無古人,後無來者的集大成者,你是萬年不遇的天才,千載難逢的科學泰斗,你是最能無中生有的魔術大師!
新冠君,你的進化之路,處處神跡,你是上帝,抑或撒旦的化身麼??
---
說謊和緘默,能把所有世人都蒙在鼓裡嗎?























