巧合太多了,就不再是巧合了。
接續:新冠中的跨物種、跨生物界、超生物基因 3
I SARS-CoV-2對冠狀病毒基因的繼承、借鑑、模仿、優化、集成(續三)
MHV-JHM、MHV-3、FIPV、FECV,及S2/S2處的多重借鑑(續)
3、S1/S2處的多重借鑑
SARS-CoV-2 S1/S2位點附近的氨基酸序列和核苷酸序列是多方借鑑、精心設計的產物。多重借鑑設計使SARS-CoV-2兼具不同借鑑來源的多重感染、致病、生存和人體適應優勢。
S1/S2表示冠狀病毒Spike蛋白S1亞基、S2亞基交界處。
第一重借鑑:RRARR借鑑
如上一篇文章所述,SARS-CoV-2 S1/S2處的基本furin切割序列RRAR借鑑了小鼠冠狀病毒MHV-JHM株系、MHV-3株系,及貓冠狀病毒(FIPV、FECV)某些病毒株等病毒S1/S2處的furin切割序列RRARR(、RRAR)。
第二重借鑑:人類ENaC-α長furin切割序列借鑑
SARS-CoV-2 S1/S2處的長furin切割序列RRAR'SVAS借鑑、復用了人類ENaC-α的長furin切割序列。
SARS-CoV-2 S1/S2處基本furin切割序列RRAR的四個氨基酸,與右側緊鄰的四個氨基酸SVAS,共八個氨基酸組成的序列RRARSVAS(精氨酸-精氨酸-丙氨酸-精氨酸-絲氨酸-纈氨酸-丙氨酸-絲氨酸)稱為 SARS-CoV-2的長furin切割序列。為方便研究每一個位點,通常將長furin切割序列的八個氨基酸位點從左到右依次標記為P4、P3、P2、P1、P1'、P2'、P3'、P4'。上一篇文章展示貓冠狀病毒FIPV 、FECV S1/S2處furin切割序列的兩個配圖示範了這種標記方式。
RRARSVAS也可表示為RRAR'SVAS,中間所加的分隔符“'”既代表S1、S2亞基的分界線,也指示着furin蛋白酶的切割位置。
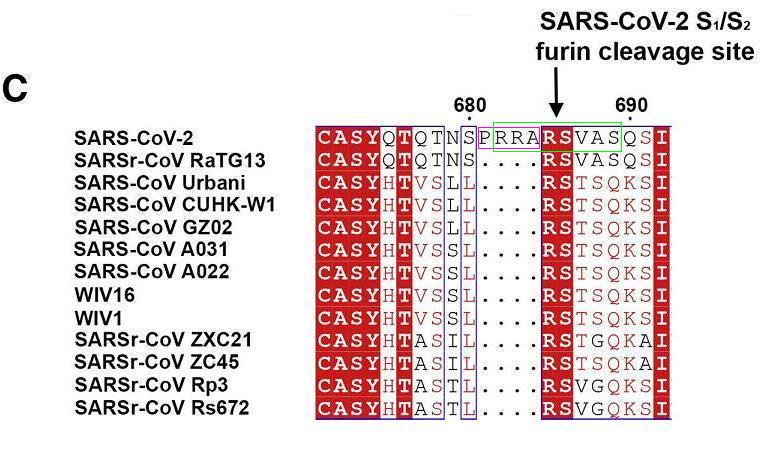
SARS-CoV-2 S1/S2處特有的PRRA插入、基本fuin切割序列RRAR、長fuin切割序列RRARSVAS
SARS-CoV-2 S1/S2處的長furin切割序列,與人類ENaC-α的長furin切割序列,兩個aa序列(amino acid sequence,氨基酸序列)完全相同,皆為RRAR'SVAS,如下圖b所示:
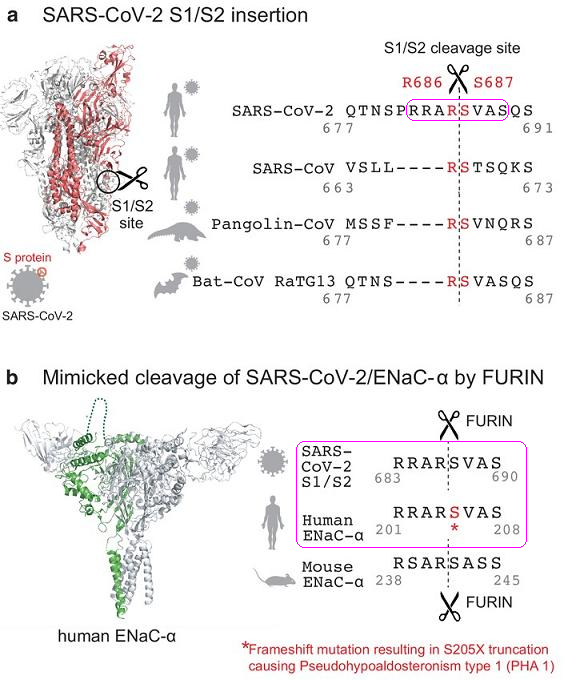
圖a:SARS-2、三種SARS-2 “近親”S1/S2位點附近的aa序列對照;
圖b:SARS-2 Spike、人類ENaC-α、小鼠ENaC-α的長furin切割序列對照。
論文依據:
SARS-CoV-2 strategically mimics proteolytic activation of human ENaC
https://elifesciences.org/articles/58603
A call for an independent inquiry into the origin of the SARS-CoV-2 virus
https://www.pnas.org/doi/10.1073/pnas.2202769119
ENaC-α是ENaC的α亞基;ENaC是Epithelial Na+ Channel(上皮鈉離子通道)的縮寫,也叫做Epithelial Sodium Channel (上皮鈉通道),是控制鈉離子進出細胞膜的跨膜離子通道。ENaC存在於人類和脊椎動物的肺(肺泡)、呼吸道(鼻腔、氣管、支氣管)、口腔(舌角質形成細胞)、腎臟、結腸、胰腺、汗腺、唾液腺等眾多器官、結構的上皮組織中,對維持器官、組織的鹽水平衡、水穩態和正常生理功能至關重要。一些ENaC高豐度分布的部位,如鼻腔上皮、上下呼吸道上皮、肺泡上皮,恰恰是SARS-CoV-2的首要感染部位;此外,ENaC、ACE2受體兩者在人體內的分布部位高度重合。
SARS-CoV-2為什麼要借鑑、復用人類ENaC-α的長furin切割序列RRAR'SVAS呢?
從某個技術視角看,P2位點不是鹼性殘基R或K(精氨酸或賴氨酸),而是非鹼性殘基A(丙氨酸)的RRAR不是最優的furin切割序列。有些人據此判斷,SARS-CoV-2的基本furinfurin切割序列RRAR不是一個最優的設計,這表明SARS-CoV-2不是人為設計的。如果SARS-CoV-2出於人為設計,那麼,設計者不應使用一個不夠好的furin切割設計方案。SARS-CoV-2的切割序列真的不夠好嗎?SARS-CoV-2自然來源論的維護者們是離不開選擇性遮蔽式舉證的,他們不敢讓你知道全部事實,這次他們又忽略或有意迴避了一個關鍵事實:RRAR'SVAS是人類ENaC-α的furin切割序列。這一事實決定了,RRAR'SVAS恐怕是用於對人類感染、致病的最佳furin切割序列,這體現在:
1)、RRAR'SVAS能兼容包括furin在內的眾多人體蛋白酶,擁有RRAR'SVAS序列的SARS-CoV-2 Spike蛋白能夠被包括furin在內的眾多人體蛋白酶高效水解、激活。
2)、RRAR'SVAS能充分利用ENaC、ACE2在人體內的分布情況,使SARS-CoV-2在上下呼吸道上皮、肺泡上皮等組織中能夠順利地同時完成受體結合和直接膜融合,從而實現高效細胞進入(即感染)。
3)、SARS-CoV-2對人類ENaC-α長furin切割序列的借鑑、復用使SARS-CoV-2的Spike蛋白能夠天然適應人體的蛋白水解環境,得以模仿、偽裝並最大程度利用人體ENaC-α的水解、激活機制,得以在人體各處組織中被包括furin蛋白酶在內的多種人體蛋白酶視作人體結構高效裂解、激活,高效感染人體細胞,在人體組織內、組織間高效擴散,並迷惑免疫系統,逃避免疫攻擊。
註:SARS-CoV-2的FCS(furin cleavage site,弗林切割位點)可誘導人體細胞間發生膜融合,形成多細胞核合胞體-巨細胞,SARS-CoV-2可通過合胞體在組織內和人體相鄰組織間擴散;SARS-CoV-2 Spike還可通過借鑑自昆蟲多角體病毒(屬於杆狀病毒科)的幾丁質結構域(Chitin-binding type-2)吸附紅細胞,搭乘紅細胞“便車”通過血液循環在人體內更高效地擴散,迷惑並逃避免疫攻擊。
與人體ENaC競爭furin蛋白酶,或劫持ENaC所需的furin蛋白酶可能造成ENaC功能紊亂、失常。ENaC功能紊亂可能引發高血壓,低血鉀,腎臟水、鈉瀦留,代謝性鹼中毒等病症,這些病症還可能與SARS-CoV-2的其它致病能力相互作用,引發更複雜、更嚴重的病症。
SARS-CoV-2感染,SARS-CoV-2與人體ENaC-α競爭furin蛋白酶可能導致furin蛋白酶異常激活及furin蛋白酶表達水平發生改變。furin蛋白酶異常激活和表達水平的改變可能導致癌症和神經退行性疾病(neurodegenerative disorder)等疾病。筆者已多次指出,SARS-CoV-2 具有高度致癌性,SARS-CoV-2的致癌途徑非常豐富。
RRAR'SVAS序列在生物界、微生物界、病毒界都極為罕見,這體現在:
1)、SARS-CoV-2是唯一一種Spike蛋白含有RRAR'SVAS序列的冠狀病毒,SARS-CoV-2外的所有冠狀病毒Spike蛋白皆不含RRAR'SVAS序列。
2)、ENaC-α是aa序列(氨基酸序列)含有RRAR'SVAS的唯一一種人體結構,ENaC-α之外的其它人體結構皆不含有RRAR'SVAS序列;
3)、只有六個物種的ENaC-α含有RRAR'SVAS序列,其中五種是靈長類動物:人類、黑猩猩、矮黑猩猩、猩猩、大猩猩,第六種,也是唯一一種ENaC-α含有RRAR'SVAS序列的非人類、非靈長類物種是存在於歐洲和西亞的一種叫作pipistrellus kuhlii的蝙蝠。
第1)、2)兩點是以下論文的生物數據庫搜索匹配結論:
SARS-CoV-2 strategically mimics proteolytic activation of human ENaC
(SARS-CoV-2策略性地模擬人類ENaC的蛋白水解激活)
https://elifesciences.org/articles/58603
論文原文:
Now,
Anand et al. show that the spike proteins on SARS-CoV-2 may have the
same sequence of amino acids at its cut site as a human epithelial
channel protein called EnaC-α.
…
SARS-CoV-2 contains an 8-mer
peptide that is identical to the furin cleavage site in the α subunit of
ENaC located at the C-terminal end of the putative inhibitory segment.
…
Hence,
the authors should better stress the novelty of their paper, which
resides in the correlation be-tween this cleavage site that is present
only in SARS-CoV-2 (and not in other coronaviruses) and the ENAC-α,
…
The
resulting tribasic 8-mer peptide (RRARSVAS) on the SARS-CoV-2 S1/S2
site is conserved among 10,956 of 10,967 circulating strains deposited
at GISAID (https://www.gisaid.org/) (Elbe and Buckland-Merrett, 2017),
as of April 28, 2020 (Supplementary file 1a). This peptide is also
absent in over 13,000 non-COVID-19 coronavirus S-proteins from the VIPR
database (Carrillo-Tripp et al., 2009). Strikingly, examining over 10
million peptides (8-mers) of 20,350 canonical human proteins from
UniProtKB shows that the peptide of interest (RRARSVAS) is present
exclusively in human ENaC-ɑ, also known as SCNN1A (p-value=4E-4) (see
Materials and methods).
第3)點是以下論文的生物庫數據搜索、匹配結論:
A call for an independent inquiry into the origin of the SARS-CoV-2 virus
https://www.pnas.org/doi/10.1073/pnas.2202769119
論文原文:
The
FCS sequence of human ENaC α (20) is identical in chimpanzee, bonobo,
orangutan, and gorilla (SI Appendix, Fig. 1), but diverges in all other
species, even primates, except one. (The one non-human non-great ape
species with the same sequence is Pipistrellus kuhlii, a bat species
found in Europe and Western Asia; other bat species, including
Rhinolophus ferrumequinem, have a different FCS sequence in ENaC α
[RKAR'SAAS]).
可以說,SARS-CoV-2 Spike蛋白與人類ENaC-α具有相同的長furin切割序列RRAR'SVAS這一結構巧合,是匪夷所思的0概率事件。
此外,RRAR'SVAS序列有可能在其它冠狀病毒或非冠狀病毒的各蛋白中都不存在,很多論文做過生物數據庫搜索、匹配研究,但未見有論文報告、指出,在某種非SARS-CoV-2病毒的某種蛋白中也存在RRAR'SVAS序列。
甚至,RRAR'SVAS序列有可能只存在於SARS-CoV-2的Spike蛋白和六個物種的ENaC-α之中,而不存在於其它任何生物結構、生物蛋白、病毒蛋白中。未見有論文報告,除ENaC-α外,何種其它生物結構、生物蛋白也含有RRAR'SVAS序列。
為什麼偏偏是SARS-CoV-2“自然變異”、“自然演化”出了生物界極度罕見,病毒界獨一無二,“恰好”與人類ENaC-α相同的長furin切割序列RRAR'SVAS?這一序列為什麼極為精準地恰好出現在對感染、致病能力至關重要的S1/S2位點(SARS-CoV-2共有近3萬個核苷酸位點)?SARS-CoV-2 S1/S2處的長furin切割序列RRAR'SVAS是隨機性、無目的自然變異、自然重組、自然演化的產物,還是人為借鑑、人為設計的產物?
相關文章:
誰設計、製造了新冠病毒(四)拉爾夫·巴里克與肺研究所 1
誰設計、製造了新冠病毒(四)北卡肺研究所與ENaC
“SARS-CoV-2 Spike蛋白與人類ENaC-α具有相同的長furin切割序列”這一重大事實、重大巧合、重大鐵證,自疫情發生至今,始終沒有任何一家重量級媒體報道、告知公眾。何為公眾知情權?何為信息自由、信息透明?他們的勢力龐大到了何種程度!他們心虛到了何種程度!
第三重借鑑:莫德納專利序列借鑑
SARS-CoV-2 Spike蛋白與人類ENaC-α的長furin切割序列皆為RRAR'SVAS;不過,同一氨基酸序列RRAR'SVAS在SARS-CoV-2和人類ENaC-α中對應的核苷酸序列並不相同(同一氨基酸可以用不同的核苷酸密碼子表達),RAR'SVAS序列所含8個氨基酸中的7個,在SARS-CoV-2和人類ENaC-α使用了不同的核苷酸密碼子。表達氨基酸的3個核苷酸的組合稱為氨基酸的密碼子,一個氨基酸可能有多個密碼子。
SARS-CoV-2 S1/S2位點附近的核苷酸序列另有借鑑:SARS-CoV-2 S1/S2位點附近與7氨基酸序列SPRRARS對應的19個核苷酸的序列借鑑自莫德納專利中一段核苷酸序列的反向序列。
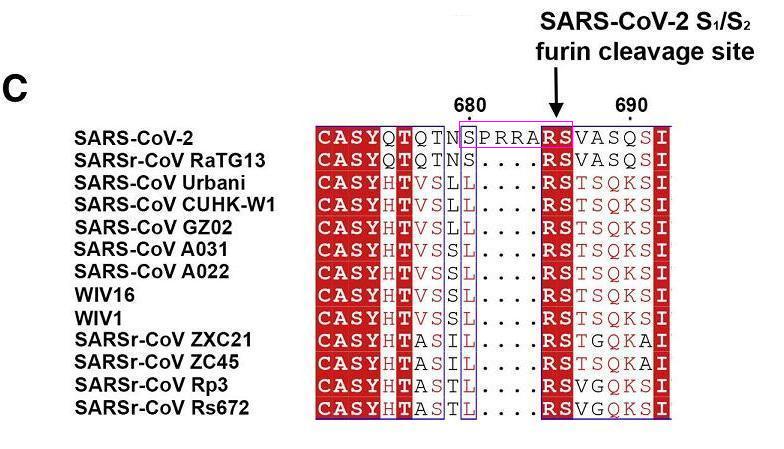
SARS-CoV-2 S1/S2位點附近與莫德納專利對應的7氨基酸序列SPRRARS
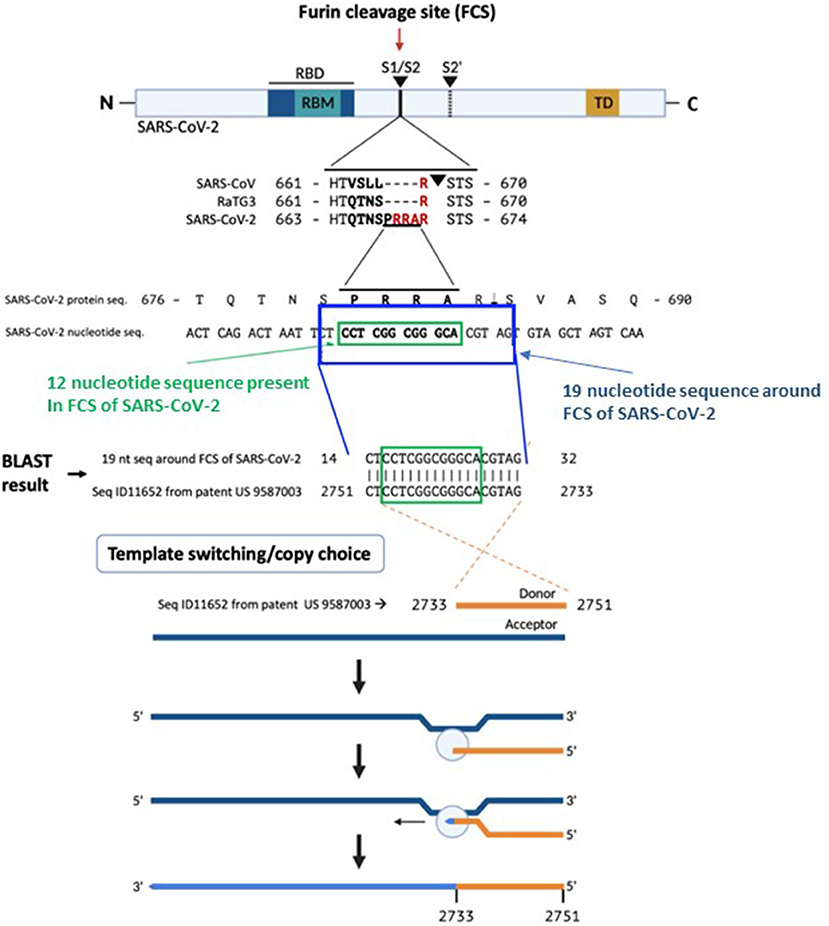
SARS-CoV-2 S1/S2處19核苷酸序列與莫德納專利中核苷酸序列的匹配關係
如上圖所示,SARS-CoV-2 S1/S2處的7氨基酸序列SPRRARS對應如下21核苷酸序列(一個氨基酸對應三個核苷酸):
TCT CCT CGG CGG GCA CGT AGT
A -腺嘌呤、G -鳥嘌呤、C-胞嘧啶、T-胸腺嘧啶。
去掉最左邊和最右邊的T後,得到如下19核苷酸序列:
CT CCT CGG CGG GCA CGT AG
莫德納公司(Moderna Therapeutics, Inc)2016年申請的一項美國專利(patent US 9587003,Filed: February 4, 2016)中有一個長度約為3300的DNA核苷酸序列Seq ID11652,這個序列的第2733至2751共19個核苷酸倒過來寫居然也是:
CT CCT CGG CGG GCA CGT AG
兩個出處的19核苷酸序列完全相同!
以上是一個簡明的描述,略去了若干細節,如RNA序列與DNA序列的互補匹配關係,且RNA核苷酸序列中的尿嘧啶U已被胸腺嘧啶T代替。下文中有更細緻的說明:
新冠人造再添鐵證,“有據核查”欲蓋彌彰
指出以上“巧合”的是如下論文:
MSH3 Homology and Potential Recombination Link to SARS-CoV-2 Furin Cleavage Site
MSH3同源性及與SARS-CoV-2弗林切割位點的潛在重組聯繫
https://www.frontiersin.org/articles/10.3389/fviro.2022.834808/full
媒體報道過這篇論文。
莫德納專利US 9587003是一項腫瘤相關的生物專利,專利名稱及鏈接如下:
Modified polynucleotides for the production of oncology-related proteins and peptides
用於生產腫瘤相關蛋白質和多肽的修飾多核苷酸
https://uspto.report/patent/grant/9587003
https://patents.google.com/patent/US9587003B2/en
該專利中的SEQ ID11652是一個非天然序列,它與人類MSH3氨基酸序列100%相同,但核苷酸序列不同,是對人類MSH3序列加以密碼子/核苷酸修飾/修改後得到的(在保持氨基酸無一改變的前提下,修改了部分氨基酸的核苷酸密碼子)。如前所述,SARS-CoV-2 Spike蛋白的長furin切割序列與人類ENaC-α的長furin切割序列也是氨基酸序列完全相同,但核苷酸序列不同。
MSH3是人體蛋白mutS homolog 3的縮寫,它是細菌DNA錯配修復(mismatch repair,MMR)蛋白MutS的人類同源物,它的作用是糾正DNA合成過程中的鹼基錯配和缺失,許多腫瘤、癌症的發生與該蛋白基因突變或功能故障有關。在病毒中引入MSH3序列可能會干預、干擾人體的DNA錯配修復(MMR)機制,引發人體細胞的錯配修復缺陷,進而導致細胞癌變,並有利於病毒的感染、生存和致病能力。
莫德納專利US 9587003中的SEQ ID11652序列可能引入了人和小鼠腫瘤中的核苷酸,或者說,SEQ ID11652可能修改了正常人類MSH3中氨基酸的核苷酸密碼子,代之以腫瘤組織中MSH3氨基酸的核苷酸密碼子。而來自腫瘤組織的核苷酸已被證明可使小鼠產生多種癌症。注意專利中的以下兩段文字:
Lacour, F. et al., Transplantable malignant tumors in mice induced by preparations containing ribonucleic acid extracted from human and mouse tumors. J. Natl Cancer Inst., 1960, 24(2):301-27. cited by applicant .
Latarjet, R., Production of multiple cancers in mice having received nucleic acid extract from isologous & homologous leukemic tissues. C.R. Hebd Seances Acad. Sci., 1958, 246(5):853-5. cited by applicant .
這兩段的機器譯文:
Lacour, F. 等人,用含有從人和小鼠腫瘤中提取的核糖核酸的製劑誘發小鼠的可移植性惡性腫瘤。 J.國家癌症研究所,1960,24(2):301-27。 申請人引用。
Latarjet, R.,接受同源和同源白血病組織核酸提取物的小鼠產生多種癌症。 C.R. Hebd 降神會學院。 科學,1958,246(5):853-5。 申請人引用。(譯文結束)
與MSH3的關係及序列來源都提示,莫德納專利US 9587003中的SEQ ID11652序列可能是一個致癌序列;而SARS-CoV-2 S1/S2位點附近的19核苷酸序列借鑑、應用了該序列中一個19核苷酸子序列的反向序列。
SARS-CoV-2具有高度致癌性,SARS-CoV-2擁有非常豐富多樣的致癌途徑。
除SARS-CoV-2外,現有生物數據庫記錄的所有真核生物基因組或病毒基因組均不含有SARS-CoV-2與莫德納專利共有的19核苷酸序列或其互補序列。該19核苷酸序列在某些細菌、古菌基因組中存在,細菌、古菌都不是真核生物。
前面指出的論文估算,莫德納專利中的19核苷酸序列自然出現在SARS-CoV-2基因組中的概率是:3.21×10^-11。10的負11次方即千億分之一,也就是說,按論文估算,莫德納專利中的19核苷酸序列自然出現在SARS-CoV-2基因組中的概率約為千億分之3.21。
論文的算法似乎並未考慮19核苷酸序列在SARS-CoV-2基因組中的出現位置,SARS-CoV-2共有約30000個核苷酸位點,因此,19核苷酸序列自然出現在SARS-CoV-2 S1/S2處的概率約為(3.21×10^-11)/30000≈(3.21×10^-11×10^-4)/3,即約1000萬億分之一。
第四重借鑑:MERS病毒S1/S2位點左側氨基酸序列模式,及P5位點脯氨酸借鑑
SARS-CoV-2借鑑或沿用了MERS-CoV(中東呼吸綜合症冠狀病毒)S1/S2位點左側氨基酸序列模式,以及P5位點的脯氨酸。
先回顧一下上一篇文章尾段的兩個插圖。
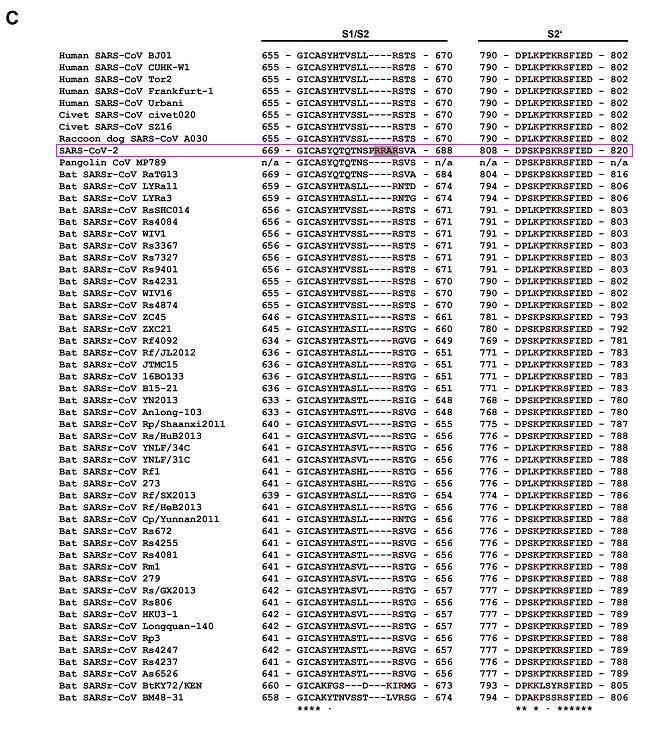
β譜系B支系部分人類、果子狸、貉、穿山甲、蝙蝠冠狀病毒局部氨基酸序列比對
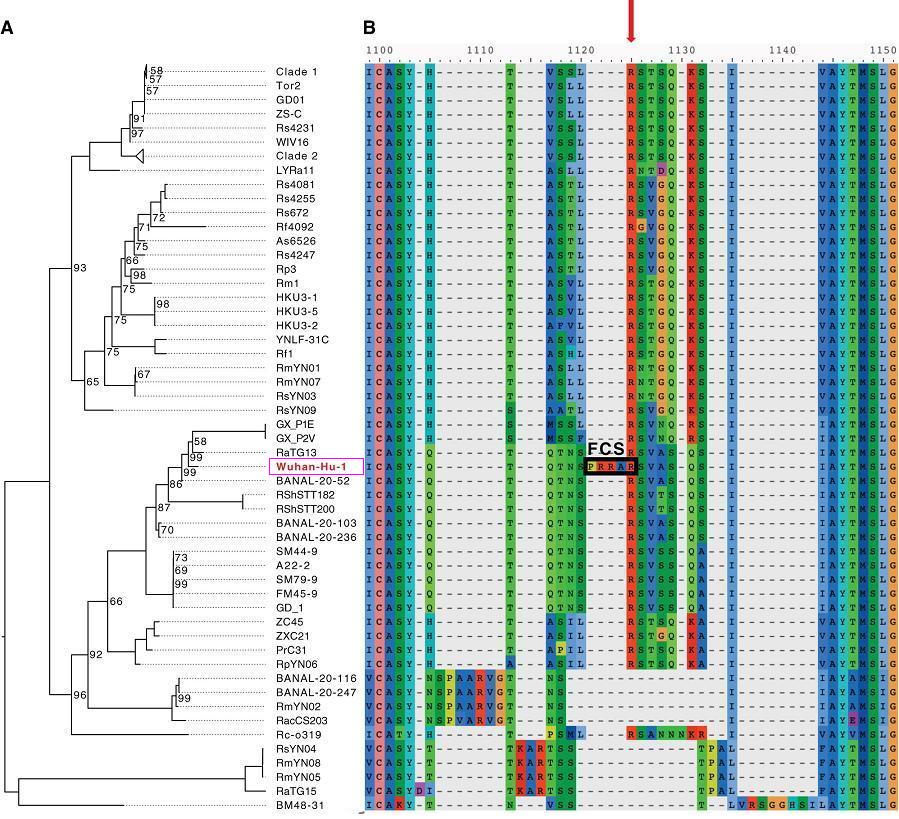
SARS-CoV-2(Wuhan-Hu-1毒株)與進化樹中冠狀病毒S1/S2附近的aa序列比對
由以上兩圖可見,SARS-CoV-2 S1/S2位點(S1、S2亞基交界處,第二個圖紅色箭頭所示)左側的四氨基酸PRRA在圖中極為獨特、突兀,與 SARS-CoV-2“演化”關係較近的冠狀病毒無一例外,全都沒有與PRRA 對應的氨基酸,這些病毒PRRA對應位點處的氨基酸,無一例外,全都空缺。
“演化”關係較近的病毒無一具有與PRRA對應的氨基酸,然而,與SARS-CoV-2 演化關係極遠的MERS-CoV不僅具有與PRRA對應的氨基酸PRSV,而且二者非常相似。

四種病毒S1/S2位點附近的氨基酸序列

SARS-CoV-2、MERS-CoVS1/S2位點附近的氨基酸序列
如以上兩圖所示,SARS-CoV-2 S1/S2位點左側四氨基酸為PRRA,MERS-CoV S1/S2位點左側對應的四氨基酸為PRSV。PRRA促成了SARS-CoV-2的基本furin切割序列RRAR,PRSV則促成了MERS-CoV的基本furin切割序列RSVR 。PRRA、PRSV皆以PR(脯氨酸-精氨酸)開頭,並皆以非極性氨基酸結尾(A-丙氨酸、V-纈氨酸都是非極性氨基酸)。
SARS-CoV-2屬於β譜系B支系(乙型冠狀病毒屬Sarbe亞屬),MERS-CoV屬於β譜系C支系(乙型冠狀病毒屬Merbe亞屬)。雖然隸屬同一譜系(屬),但二者差異巨大,親緣關係(進化關係)極遠。SARS-CoV-2、MERS-CoV二者Spike蛋白aa序列76%可比對,可比對部分一致度僅為34.91%。兩種病毒的全基因組核苷酸序列僅28%可比對,可比對部分一致度為67.06%。
MERS-CoV發現於中東。為什麼SARS-CoV-2 S1/S2位點左側的四氨基酸序列與所有“近親”大相徑庭,卻反而與基因組差距巨大,演化關係極遠、發現地遠隔重洋、相距萬里的MERS-CoV如此相似?這種反常源自自然變異、自然演化,還是人為借鑑、人為賦予?
SARS-CoV-2、MERS-CoV間的結構關聯、結構巧合還遠不止於此。
前面提到,長furin切割序列的八個氨基酸位點從左對右通常依次用P4P3P2P1P1'P2'P3'P4'表示。SARS-CoV-2基本furin切割序列RRAR的四個氨基酸從左到右依次對應P4P3P2P1四個位點,RRAR左側的第一個氨基酸位點稱為P5位點。SARS-CoV-2、MERS-CoV P5位點的氨基酸皆為脯氨酸,即SARS-CoV-2基本furin切割序列RRAR、MERS-CoV基本furin切割序列RSVR左側中的第一個氨基酸皆為脯氨基酸(P)。如下圖所示:

SARS-CoV-2 、MERS-CoV furin切割序列P5位點皆為脯氨酸
PRRA、PRSV中的P表示脯氨酸,P1、P2、P3、P4、P5中的P則表示位點(position),二者含義不同。
SARS-CoV-2、MERS-CoV P5位點皆為脯氨酸,這是極不尋常的。furin切割序列P5位點極少出現脯氨酸,Thomas Lemmin等人發表的以下論文指出,在已識別的132個furin切割序列中,僅有5個序列P5位點為脯氨酸。
Structures and dynamics of the novel S1_S2 protease cleavage site loop of the SARS-CoV-2 spike glycoprotein
SARS-CoV-2刺突糖蛋白新型S1_S2蛋白酶切割位點環的結構和動力學
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7534663/
論文原文:
it
appears that a proline residue at position P5, i.e., the 5th residue
prior to the furin cleavage site, is rare and appears in only 5 out of
132 sequences (three mammalian and two viral sequences).
5個P5位點為脯氨酸的furin切割序列3個是哺乳動物序列,2個是病毒序列,2個病毒序列分別屬於SARS-CoV-2、MERS-CoV。也就是說,furin切割序列P5位點為脯氨酸的病毒僅有兩種,這兩種病毒恰恰就是2012年出現的MERS-CoV和2019年出現的SARS-CoV-2。這實在是太過於巧合、太過於幽默了。
SARS-CoV出現於2002年,MERS-CoV出現於2012年,比之2022年,SARS-CoV-2的出現時間提前了約3年。
為什麼SARS-CoV-2、MERS-CoV二者furin切割序列的P5位點都要使用脯氨酸呢?這是一個頗有深意的設計,P5位點的脯氨酸可能有以下多重作用:
1)、脯氨酸有特殊的構象剛性,可將furin切割序列對應的多肽與Spike蛋白的其他結構元件分開,使前者更好地暴露於furin等蛋白酶;
2)、脯氨酸產生的轉角預計(可能未得到廣泛確認)會導致PRRA插入兩側的2個絲氨酸(S673、S686)、1個蘇氨基酸(T678 )形成O-連接聚糖(O-linked glycans),O-Linked聚糖能與人體細胞表面的某些蛋白質相互作用,形成一個可逃避免疫打擊的糖鏈屏障,是SARS-CoV-2眾多可能的免疫逃避/免疫屏蔽途徑之一。
1)、2)、兩點都是上面剛剛提到的Thomas Lemmin等人的論文所指出的。
3)、P5位點的脯氨酸還可能有助於調節Spike蛋白及病毒包膜的融合前構象,降低膜融合的能量門檻,使病毒包膜與細胞膜更容易發生膜融合,使病毒的感染(即細胞進入)更便捷、高效。這一推測基於英法兩國科學家1 December 1998發表的以下論文:
A
Proline-Rich Motif Downstream of the Receptor Binding Domain Modulates
Conformation and Fusogenicity of Murine Retroviral Envelopes
受體結合域下游富含脯氨酸的基序調節鼠逆轉錄病毒包膜的構象和融合性
https://journals.asm.org/doi/10.1128/jvi.72.12.9955-9965.1998
4)、與絲氨酸(S)或蘇氨酸(T)組成磷酸化基序/位點。
SARS-CoV-2 RRAR之前P5位點的脯氨酸P和P6位點的絲氨酸S組成的雙氨基酸短序列SP恰好是脯氨酸定向激酶(proline-directed kinases)的兩個作用基序之一;而MERS-CoV的對應位點恰好使用了脯氨酸定向激酶的另一個作用基序TP(蘇氨酸-脯氨酸)。不得不嘆服,遠隔重洋、相距萬里的SARS-CoV-2、MERS-CoV是何等的心心相印、心有靈犀,何等的默契!

MERS-CoV 、SARS-CoV-2 S1/S2位點左側的的脯氨酸定向激酶作用基序TP、SP
SARS-CoV-2長furin切割序列RRAR'SVAS中的第2至第5氨基酸RARS還恰好符合嗜鹼性激酶(basophilic kinases)發揮作用的RXXS 基序模式,SP及RARS中的兩個絲氨酸S可分別被脯氨酸定向激酶、嗜鹼性激酶有效磷酸化。磷酸化(Phosphorylation),指在蛋白質中的絲氨酸/蘇氨酸/酪氨酸殘基上加入一個磷酸基團。
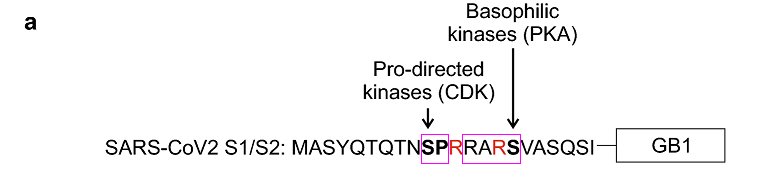
SARS-CoV-2 S1/S2位點附近的的脯氨酸定向激酶作用基序SP及嗜鹼性激酶作用基序RARS
論文依據:
The sequence at Spike S1_S2 site enables cleavage by furin and phospho-regulation in SARS-CoV2 but not in SARS-CoV1 or MERS-CoV
https://www.nature.com/articles/s41598-020-74101-0
SARS-CoV-2、MERS-CoV間驚天地、泣鬼神的種種結構關聯、結構巧合,是無目的、隨機性自然變異、自然演化的一再奇蹟,還是人為設計的蓄意而為、一脈相承?
SARS-CoV-2 Spike蛋白上存在十幾個磷酸化位點(phosphorylation sites),其N、M、S、nsp3a、nsp9b等蛋白中共有約 70個磷酸化位點;SARS-CoV-2感染會干預、改變人體自身的磷酸化機制,導致宿主蛋白顯著、嚴重的磷酸化改變,並顯著增加某些生理過程(如碳代謝,carbon metabolism)中的磷酸化,SARS-CoV-2感染會導致人體增加2000 多種磷酸肽,在SARS-CoV-2感染的細胞中觀察到超過15,000個宿主磷酸化位點。SARS-CoV-2感染還會改變(上調或下調)參與磷酸化的多種激酶的活性,並通過磷酸化與信號傳導和細胞周期有關的蛋白質來干預、劫持宿主信號通路、信號傳導,阻滯/停滯細胞周期,使細胞處於有利於病毒複製、病毒生存的周期階段。
參考論文:
Frontiers _ SARS-CoV-2 Infection Triggers Phosphorylation Potential Target for Anti-COVID-19 Therapeutics.htm
https://www.frontiersin.org/articles/10.3389/fimmu.2022.829474/full
蛋白質磷酸化異常,包括磷酸化途徑的改變會導致多種嚴重疾病,尤其是癌症。靶向磷酸化途徑的藥物代表了癌症治療的有希望的領域。SARS-CoV-2有高度致癌性,SARS-CoV-2的致癌途徑非常豐富。其它與磷酸化異常有關的疾病包括糖尿病、心血管疾病、阿爾茨海默症(Alzheimer's
disease)、炎症性疾病等等。
第五重借鑑:借鑑兩種人類蛋白的PRRARS序列
SARS-CoV-2 S1/S2位點附近的PRRARS序列可能借鑑自人類Hermansky-Pudlak syndrome protein或某些RhoGEF蛋白。

SARS-CoV-2 S1/S2位點左側的的PRRA序列及其延長序列PRRARS。
SARS-CoV-2 S1/S2位點左側的的四氨基酸序列PRRA可能在所有其它已知病毒中都不存在。很多論文做過生物數據庫搜索匹配,但未見有論文報告,何種其它病毒中的某種蛋白也含有PRRA序列;無人報告其它病毒具有PRRA序列,但下述論文卻報告,PRRA序列及其延長序列-六氨基酸序列PRRARS序列存在於兩種人類蛋白之中。
論文依據:
The polybasic insert, the RBD of the SARS-CoV-2 spike protein, and the feline coronavirus – evolved or yet to evolve
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7833556/
論文原文:
We
scanned the human databases (Taxon 9606) and found that the exact
sequence PRRARS was present only in two human proteins: AAB17869.1,
Hermansky-Pudlak syndrome protein (HPS1), and AAF79955.1, RhoGEF. There
are 17 isoforms of HPS1; incidentally, RhoGEF in the curated UniProt
data does not carry this motif (Supplemental Table 1).
兩種含有PRRARS序列的人類蛋白是HPS1 (Hermansky-Pudlak syndrome protein 1)和RhoGEF,某些生物庫(如UniProt )中的RhoGEF蛋白不包含PRRARS序列。
Hermansky-Pudlak syndrome(赫曼斯基-普德拉克綜合症,HPS)是一類遺傳性的綜合眼皮膚白化病,對應六種基因突變,HPS1是其中一種突變蛋白。患有Hermansky-Pudlak syndrome的人皮膚容易損傷,容易皮膚淤紫、鼻出血、齒齦出血、咯血、手術後出血及產後出血,容易患皮膚癌。
RhoGEF (Rho Guanine Nucleotide Exchange Factor,Rho 鳥嘌呤核苷酸交換因子) 直接負責響應多種細胞外刺激而激活Rho家族GTP酶,在調節多種細胞反應(例如增殖、分化和運動)及基本細胞過程(例如細胞形態和極性,細胞周期進程和基因轉錄)中起關鍵作用。
論文指出,某些生物庫(如UniProt )中的RhoGEF蛋白不包含PRRARS序列,這或許意味着,PRRARS序列只存在於某些RhoGEF蛋白中,不清楚包含PRRARS序列的RhoGEF蛋白是否也是變異蛋白。
號稱來處動物的SARS-CoV-2具有的,其它病毒無一具有的,與人類ENaC-α相同的長furin切割序列RRAR'SVAS是如何得來的?SARS-CoV-2具有的,其它病毒同樣無一具有的,存在於人類變異蛋白--Hermansky-Pudlak syndrome protein中的PRRARS序列又是如何得來的?是SARS-CoV-2在動物體內自然變異、自然演化產生的,還是人為借鑑、人為賦予的?
(未完待續)

















