2020年1月30日,美国匹兹堡大学高级研究员詹姆斯·莱昂斯-魏勒 (James Lyons-Weiler)在其个人网站发表了一篇题为“On the Origins of the 2019-nCoV Virus, Wuhan, China”的文章,
https://jameslyonsweiler.com/2020/01/30/on-the-origins-of-the-2019-ncov-virus-wuhan-china/
这篇文章还有一篇关联的辅助分析文章:Moderately Strong Confirmation of a Laboratory Origin of 2019-nCoV
https://jameslyonsweiler.com/2020/02/02/moderately-strong-confirmation-of-a-laboratory-origin-of-2019-ncov/
Lyons-Weiler的主要观点包括:
1)2019-nCoV与最相似的蝙蝠冠状病毒(舟山蝙蝠病毒CoVZC45)之间缺乏足够的基因序列同源性;
2)新冠基因组中的核苷酸子序列INS1378与SARS刺突蛋白的序列高度相似;
3)INS1378与实验室通用载体pShuttle-SN质粒也具有显著的序列相似性,该载体用途之一是生产SARS疫苗;
4)INS1378不太可能存在于其它冠状病毒中;
5)2019-nCoV非常可能是来自实验室的重组病毒,是作为SARS疫苗而制造的。
Lyons-Weiler的发现与判断揭示或折射出部分的本质和真相,与此同时,他的某些看法也有欠准确、深刻。
具体而言,我的判断或结论有以下四点:
1。INS1378与实验室载体pShuttle-SN的相似性,与SARS刺突蛋白的相似性,都不够充分;
2。INS1378是SARS-CoV-2的S1蛋白的一部分,同时,INS1378包含S1蛋白的RBD(Receptor Binding Domain,受体结合域)的大部分。
3。SARS-CoV-2的S1蛋白的RBD,克隆自SARS-CoV的S1蛋白的RBD(实际克隆的是一个比RBD要宽的区域,不妨称之为扩展RBD),实验室制作SARS-CoV-2时,对克隆自SARS-CoV的扩展RBD还做了少量的其它基因编辑。Lyons-Weiler观察到的INS1378与SARS-CoV刺突蛋白(即S蛋白,Spike蛋白,包括S1、S2两部分)的相似性,其实来自SARS-CoV-2的扩展RBD,与SARS-CoV的扩展RBD的高度同源性。
4。在将SARS-CoV的扩展RBD,克隆到SARS-CoV-2中时,使用的是已克隆有SARS-CoV的S1蛋白片断的实验室载体pShuttle-SN,这就是Lyons-Weiler观察到的,INS1378与pShuttle-SN存在相似性的原因。
(对SARS-CoV-2是否是一种疫苗用途的人造病毒,本文不展开评论。)
先分析、说明结论-“1。INS1378与实验室载体pShuttle-SN的相似性,与SARS刺突蛋白的相似性,都不够充分;”理由如下。
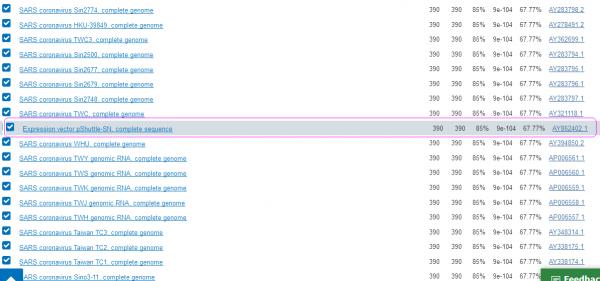
a)INS1378与SARV-CoV刺突蛋白(S蛋白)的序列一致性(可匹配度)并不高,仅为67.77%;它与pShuttle-SN的序列一致性也同样仅为67.77%。事实上,INS1378与pShuttle-SN,与所有SARV-CoV病毒株基因序列的一致性都是67.77%。对INS1378来说,pShuttle-SN与SARS-CoV并无不同。如果可以说,INS1378来自pShuttle-SN,那么,也可以说INS1378来自SARS-CoV。
下图是用NCBI(National
Center for Biotechnology
Information)工具Blast得到的INS1378在基因数据库中的搜索匹配结果列表(部分),中间一行是INS1378与“Expression
vector
pShuttle-SN”的基因序列匹配情况,二者的序列一致性(或者说可匹配度)为67.77%。这一行上下两侧是INS1378与一些SARS-CoV病毒株的匹配情况,匹配度也都是67.77%。

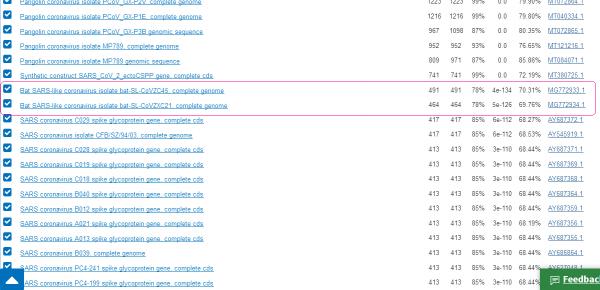
b)INS1378与两种舟山病毒CoVZC45,CoVZXC21的一致性分别为70.31%,69.76%,皆高于其与pShuttle-SN或SARS-CoV的一致性(67.77%)。因此,与其说INS1378来自pShuttle-SN,那么,还不如说INS1378来自CoVZC45或CoVZXC21。参见下图。

c)Expression
vector
pShuttle-SN质粒基因序列共有5607个碱基对,它自编号945开始的一段长为1525的碱基对序列,与SARS-CoV(以病毒株SARS
coronavirus
BJ162代表)自编号21447(位于SARS-CoV的S蛋白的起始位置21493之前,相距46个碱基对)开始的一段长为1526的碱基对序列高度匹配,在1526个对应位置上,匹配的碱基对有1520个,一致度(匹配度)高达1520/1526=99.61%。下图为使用Blast工具得到的比照结果截图(匹配段序列较长,截图只显示了前面一小部分匹配段)。
Blast Job Title AY862402:Expression vector pShuttle-SN, complete...
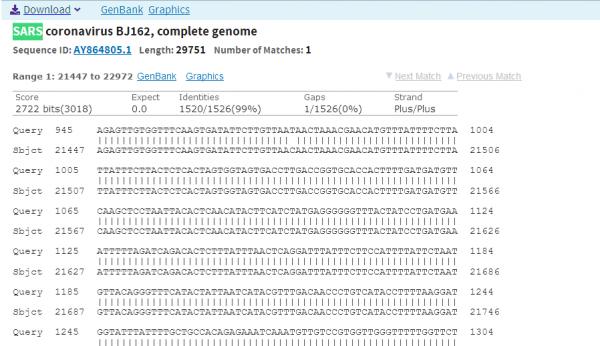
Expression vector pShuttle-SN与SARS-CoV(SARS coronavirus BJ162)基因序列匹配情况
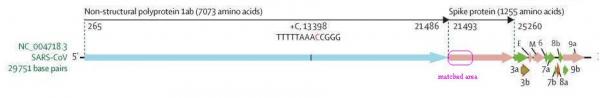
下图是SARS-CoV中,与pShuttle-SN高度匹配区域的位置。
d)Expression
vector
pShuttle-SN与SARS-CoV二者长为1525/1526的高度匹配区域,包含它们各自与INS1378(含1378个碱基对)的匹配区域,因而,二者与INS1378的匹配区域,几乎一模一样,这就是INS1378与二者的一致性相同,皆为67.77%的原因。
e)Expression
vector pShuttle-SN与SARS-CoV高度匹配的原因是,Expression vector
pShuttle-SN中那段长度为1525的碱基对序列,本来就是从SARS-CoV的S蛋白中克隆来的。相关背景是,在实验室用SARS-CoV的S蛋白与(缺陷型)腺病毒合成SARS疫苗时,其中一个实验步骤是,将SARS-CoV的S1蛋白的一部分(例如,碱基对编号from
−57 to 1468, SN),克隆到pShuttle-SN质粒中,这将得到一种含有SARS-CoV
S1蛋白片断的pShuttle-SN重组质粒,它就是Expression vector
pShuttle-SN,它所含的S1蛋白片断,就是它与SARS-CoV的高度匹配部分。Expression vector
pShuttle-SN的基因序列,由疫苗制作单位-中山大学肿瘤防治中心,于2004年12月21日提交至国际基因库GenBank。参见下图。
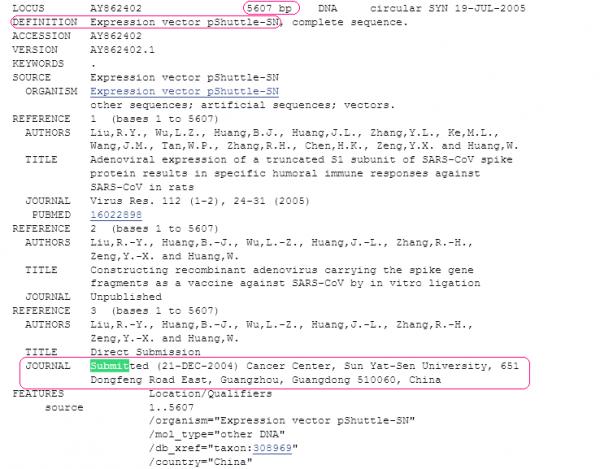
下图是腺病毒SARS疫苗的专利情况。
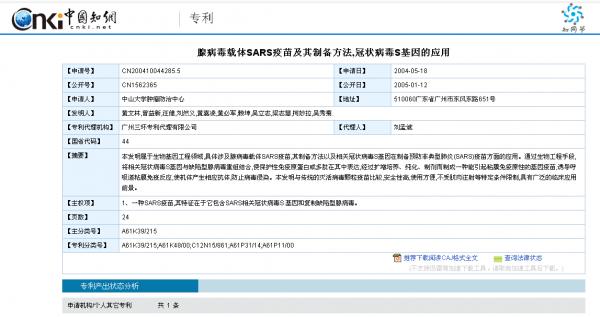
这是腺病毒SARS疫苗的制备方法。

请大家注意一个事实:早在2003-2004年间,中山大学就已经能够用SARS-CoV的S蛋白+腺病毒骨架来合成人工病毒(疫苗)了。
由以上5点可见,Lyons-Weiler对“新冠的INS1378”与“实验室通用载体pShuttle-SN”关系的判断比较模糊,有欠准确和深刻。
那么,SARS-CoV-2中的INS1378与实验室通用载体pShuttle-SN之间到底有没有关系?如果有关系,是什么样的关系?这种关系是如何产生的?下面回答这几个问题。
使用Blast比对Lyons-Weiler提供的INS1378序列与SARS-CoV-2基因序列可知,核苷酸(碱基对)序列INS1378在SARS-CoV-2基因序列中的起始位置是21643,终了位置是23020,它正好落在SARS-CoV-2的S1蛋白对应的基因序列内。INS1378在SARS-CoV-2(2019-nCoV)基因序列中的位置见下图。
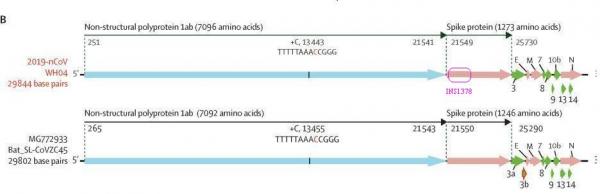
容易推算出,INS1378在S1蛋白基因序列中的起始位置是95(大致对应第95/3=32个氨基酸),终了位置是1472(大致对应第491个氨基酸),还有一个很重要的关系:INS1378涵盖了大部分的RBD(Receptor-Binding-Domain)。
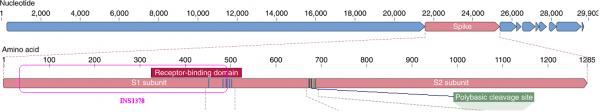
INS1378在SARS-CoV-2的S1蛋白中的位置,及它与RBD的位置关系及重合情况。上半图编号为碱基对编号,下半图编号为氨基酸编号。一个氨基酸(amino acids)对应三个碱基对。
至此,我们可得出本文的结论-2。
2。INS1378是SARS-CoV-2的S1蛋白的一部分,它包含S1蛋白RBD(Receptor Binding Domain,受体结合域)的大部分。
接着看本文的结论-3。
3。SARS-CoV-2的S1蛋白的RBD,克隆自SARS-CoV的S1蛋白的RBD(实际克隆的是一个比RBD要宽的区域,不妨称之为扩展RBD),实验室制作SARS-CoV-2时,对克隆得来的扩展RBD还做了少量的其它基因编辑。也说是说,SARS-CoV-2的扩展RBD乃至S1蛋白,与SARS-CoV的扩展RBD或S1蛋白,有很高的同源性。Lyons-Weiler观察到的INS1378与SARS-CoV的相似性,其实反映的是SARS-CoV-2与SARS-CoV二者扩展RBD的高度同源性。
不对此结论作过多的展开分析了,只给出两个简明的依据。
1)2020年1月21日,来自中国科学院上海巴斯德研究所等单位的徐心恬、陈萍、王靖方等学者在SCIENCE
CHINA Life
Sciences(《中国科学:生命科学》)上发表了一篇论文,题为“源于武汉爆发的新型冠状病毒的进化及其棘突蛋白对人类传播风险的建模”(Evolution
of the novel coronavirus from the ongoing Wuhan outbreak and modeling
of its spike protein for risk of human transmission)。论文的结论之一是:
尽管新冠与SARS-CoV二者S蛋白的总体同源性较低,但二者的RBD区域却有较高的同源性。
2)2020年1月30日,中国疾控中心、山东第一医科大学的陆柔剑等科研人员在柳叶刀(The
Lancet)上联合发表了一篇题为“Genomic characterization and epidemiology of 2019
novel coronavirus: implications for virus origins and receptor
binding”(2019年新型冠状病毒的基因组表征和流行病学:对病毒起源和受体结合的启示)的论文,论文的结论之一是:
虽然2019-nCoV(即SARS-CoV-2)与SARS-CoV的亲缘关系较远,但同源性建模显示,2019-nCoV具有与SARS-CoV相似的受体结合域结构,尽管某些关键残基处存在氨基酸差异。
Lyons-Weiler不仅观察到INS1378与SARS-CoV的相似性,还观察到INS1378与pShuttle-SN的相似性,这又是为什么呢?因为在将SARS-CoV的(扩展)RBD,克隆到SARS-CoV-2中时,使用的工具是实验室通用载体pShuttle-SN,pShuttle-SN中已克隆有SARS-CoV含RBD的S1蛋白片断(这与制作SARS疫苗时的做法如出一辙)。所以INS1378与SARS-CoV的相似性,等同于INS1378与pShuttle-SN的相似性。这就是本文的结论4。
综上所述,SARS-CoV-2基因序列的子序列INS1378的来源是:一部分来自CoVZC45(2017年发现的舟山蝙蝠冠状病毒,制造SARS-CoV-2的底版病毒)的S1蛋白,一部分来自SARS-CoV的S1蛋白(扩展RBD),INS1378中还有若干其它的基因编辑。也就是说,INS1378只是部分来自SARS-CoV或pShuttle-SN,它来自CoVZC45的比例应该还稍稍多于来自SARS-CoV或pShuttle-SN的比例。
为什么SARS-CoV-2要克隆SARS-CoV的RBD呢?因为制作SARS-CoV-2的底版病毒--舟山蝙蝠冠状病毒CoVZC45的RBD(Receptor-Bind-Domain)不能与人类细胞受体ACE结合,因而该病毒不能感染人,克隆一个能与ACE2结合的RBD,才能将病毒改造成能感染人的病毒。
虽然Lyons-Weiler对INS1378与pShuttle-SN关系的判断有欠准确、深刻,但他的判断仍折射出SARS-CoV-2的来源真相。Lyons-Weiler文章中有借鉴价值的内容还包括:
a)2019-nCoV(SARS-CoV-2)对应的进化树分支的bootstrap值(自展值)较低,仅为76,(可能)是冠状病毒家族成员中最低的。这说明SARS-CoV-2进化树分支(自然进化意义上)的可信度低,也说明SARS-CoV-2基因序列中,演化来源不明的成分比例高。
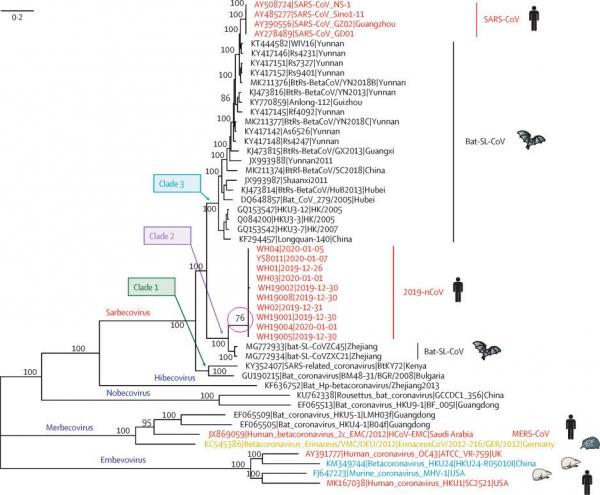
b)2019-nCoV与蝙蝠冠状病毒的基因序列同源性较差,且序列一致性关系不连贯,存在明显的间断gap,这也不是自然进化应有的现象。
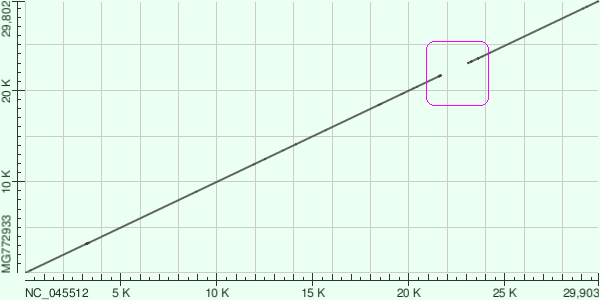
SARS-CoV-2与舟山蝙蝠病毒CoVZC45序列一致性关系dot plot图(来自Blast)。
图中有非常明显的间断gap,这一间断gap正好对应着来自SARS-CoV的扩展RBD。
注:NC_045512代表SARS-CoV-2(NCBI refseq),MG772933代表CoVZC45(Accession number);
在与SARS-CoV-2存在进化可能性的冠状病毒中,CoVZC45与之相似度最高。
众多证据指向一个结论:SARS-CoV-2是实验室制造的。想了解相关文章及更多证据的朋友,请移步我的博客。
(全文完)
(主要内容初作于6月25日,有修改)

















