重视、警惕转基因在病毒、病原体危险研究中的应用,特别是在冠状病毒GoF研究中的应用。冠状病毒具有最大的RNA基因组,可提供充裕的转基因改造空间,便于引入、替代、借鉴、模仿、叠加、荟萃大量跨物种基因(冠状病毒基因、非冠状病毒基因、致病细菌基因、寄生虫基因、生物毒素基因、医疗药剂基因、人类基因),便于引入、模仿、集成各种感染、致病、免疫对抗(免疫破坏、免疫逃避和屏蔽、免疫干扰、免疫抑制)机制。第一个括号内列举的跨物种基因或相似基因在SARS-CoV-2中全都出现了,第二个括号中的免疫对抗机制SARS-CoV-2也全部具备,SARS-CoV-2还拥有令所有病毒、所有病原体望尘莫及的超过30种人类细胞膜受体蛋白结合能力,和更多的一般人类因子(蛋白质、多肽)结合能力。
接续:“万能”受体适配器--新冠S蛋白 3
8、Hepcidin(铁调素)
Hepcidin(缩写hepc),铁调素,是由肝脏(肝细胞)合成、分泌的一种含25个氨基酸(残基)的小分子多肽类激素,人类铁调素由19号染色体上的Hamp基因编码。
铁调素(Hepcidin,hepc)有三种形式:Hepc25、Hepc20、Hepc22,前两者是Hepc的主要存在形式,后二者可能是Hepc25的降解产物。人类铁调素随血液在体内循环,以不同丰度水平存在于机体各组织中,并可穿透细胞膜进出细胞。部分铁调素随尿液排出体外。

hepcidin-25空间形态示意图
铁调素是人类和哺乳动物铁代谢、铁稳态、铁平衡的关键调节因子之一,它抑制铁吸收细胞、铁回收细胞、铁储存细胞、铁中转细胞等细胞的铁释放,下调血液中的循环铁,是铁代谢的负向调节因子。
铁调素对铁代谢的负向调节,即对铁释放的抑制,对循环铁的下调是通过结合、内化、降解铁转运蛋白来实现的。铁调素能够结合细胞膜上的铁转运蛋白,介导后者内摄(铁调素与铁转运蛋白结合后,二者的复合体将被摄入细胞)并在细胞内降解。铁转运蛋白是细胞释放、输出铁的唯一工具,铁转运蛋白的降解、缺乏将使小肠上皮细胞(铁吸收细胞)、巨噬细胞(铁回收细胞,吞噬衰老的红细胞,回收红细胞内的铁离子)、肝细胞(铁储存细胞)、胎盘细胞(向胎儿供应铁的中转站)等细胞的铁释放、铁输出被抑制,更多的铁将被保留、隔离在(这些)细胞内,释放到肝门静脉等血管,进入血液循环向各组织输送的铁将减少。铁调素也抑制小肠的铁吸收,铁释放不畅,细胞内铁水平较高的小肠上皮细胞将减少从食物中摄入铁。
铁转运蛋白(ferroportin,缩写为FPN,又称膜铁转运蛋白)是已知的唯一一种细胞铁输出蛋白,它结合细胞内的二价铁离子(Fe2+),并将其释放到细胞外。铁转运蛋白(ferroportin,FPN)服务于细胞的铁输出,上一篇文章介绍的转铁蛋白(Transferrin,Tf)和转铁蛋白受体(transferrin receptor,TfR)则服务于细胞的铁摄入。转铁蛋白(Tf)负责向各器官、组织中的细胞运送循环铁,细胞膜上的转铁蛋白受体(TfR)负责结合、接收转铁蛋白,将转铁蛋白及其携带的铁摄入细胞内。铁转运蛋白(FPN)结合、输出的是二价铁离子(Fe2+),转铁蛋白(Tf)结合、运送的是三价铁离子(Fe3+),铁转运蛋白(FPN)输出的Fe2+在被转铁蛋白(Tf)结合、运送前将被氧化为Fe3+。小肠(主要是十二指肠)从食物中吸收的也是Fe3+,它要被还原为Fe2+,而后由铁转运蛋白(FPN)结合、释放到细胞外。
总之,铁调素的(分子、生理)作用是结合、内化、降解唯一的细胞铁输出蛋白—铁转运蛋白(FPN),抑制铁释放、铁吸收,减少进入血液向机体各组织输送的循环铁。在某些特定条件下,如血清铁过载或肝脏铁过载时,肝脏将生成、分泌更多铁调素,反之,肝脏将减少铁调素的生成、分泌。
铁对所有活细胞都是必不可少的。任何对铁调素、对正常铁代谢的外在干预、干扰都可能造成铁代谢失调、紊乱,破坏机体铁稳态、铁平衡,引发一系列并发症,包括细胞铁死亡(ferroptosis)、多器官衰竭和患者死亡。
铁调素也是一种富含半胱氨酸和二硫键(含有8个半胱氨酸残基和4个二硫键)的抗菌多肽。在铁调素所属的β-发夹肽家族中,铁调素的二硫键数量最多(4个),是该家族潜在最有效的抗菌肽。铁调素具有广泛的抗菌、抗原生动物作用,参与机体免疫和天然防御,损伤、感染和炎症刺激可强烈引起铁调素基因表达的增加。铁调素也被称为肝脏表达的抗菌肽(liver-expressed
antimicrobial peptide,LEAP-1)。
铁调素(Hepcidin,Hepc)是多肽类激素,不是严格意义上的蛋白质,不是细胞膜跨膜受体蛋白,自然也不是SARS-CoV-2的感染受体/受体蛋白,但它是SARS-CoV-2 S蛋白的可结合人体因子。
SARS-CoV-2
S(Spike)蛋白有变构特性,能以多个区域(AMR、ACE2 binding-site
region、RBM)结合铁调素,并在不同构象或不同状态下优先以不同区域与铁调素结合;SARS-CoV-2
Spike、Hepc、ACE2可结合形成三元复合体;SARS-CoV-2
Spike与Hepc的作用、结合影响Spike与ACE2的作用、结合,这一影响具有两面性:一方面,SARS-CoV-2
Spike-Hepc的作用、结合适度增加了Spike-ACE2的结合亲和力;另一方面,Spike-Hepc的作用、结合将促使Spike从有利于结合ACE2的开放构象(open
conformation)转变为不利于结合ACE2的闭合构象(closed
conformation),与Hepc结合的Spike将在更多时间内处于闭合构象状态。
SARS-CoV-2可能是已论文报告的,唯一一种可结合铁调素的病毒(包括冠状病毒、非冠状病毒)。
SARS-CoV-2 S蛋白不仅能够结合人类铁调素,而且,其尾部区域与人类铁调素存在氨基酸序列相似性,这一尾部区域可能能够模仿铁调素的分子作用和生理功能,计算机模拟研究表明,SARS-CoV-2 S蛋白的尾部片断--Covidin多肽能够结合铁转运蛋白(ferroportin,FPN),Covidin多肽还可能能够进而降解铁转运蛋白。大量“Covidin”多肽的存在将过度抑制铁释放、铁吸收,导致血液中的循环铁水平低下,机体各组织铁供应贫乏,并引发一系列铁代谢紊乱并发症。
铁调素在SARS-CoV-2病理中发挥重要作用,可能是COVID-19发病机制的核心参与者。
论文依据一
Biophysical
Insight into the SARS-CoV2 Spike–ACE2 Interaction and Its Modulation by
Hepcidin through a Multifaceted Computational Approach
通过多方面的计算方法,对SARS-CoV-2 Spike-ACE2相互作用,以及这一作用的铁调素调节进行生物物理洞察
https://pubs.acs.org/doi/10.1021/acsomega.2c00154
Publication Date:May 10, 2022
论文主要研究了两方面的内容:1、在之前一篇论文的基础上进一步研究了SARS-CoV-2 Spike蛋白的变构调节区域(Allosteric Modulation Region,AMR);2、SARS-CoV-2 Spike与铁调素(Hepcidin)的相互作用,及Spike-Hepcidin相互作用对Spike-ACE2相互作用、对Spike构象的影响和调节。
论文使用了大量算法、公式、模型,应用了多种分析软件、工具,篇幅很长,阅读理解的难度较大。笔者忽略了论文建模、计算、分析的艰深细节,摘录、梳理出了关于Hepcidin的如下论文要点:
1、基于蛋白质构象变化和受体、配体结合的不同假设,应用多种模型和计算方法进行分析,结果一致表明Hepcidin与SARS-CoV-2的Spike蛋白之间存在潜在有效的相互作用;并且,SARS-CoV-2 Spike与Hepcidin的相互作用影响Spike的构象及Spike与ACE2的相互作用。
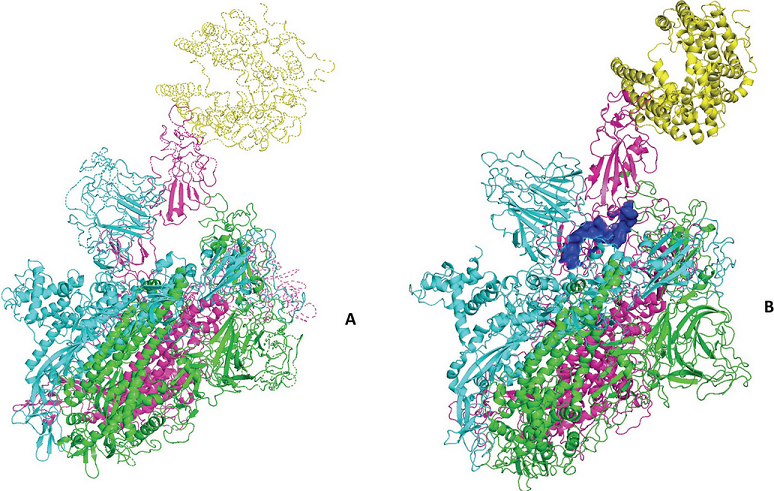
图A:SARS-CoV-2 Spike三聚体与human ACE2(右上黄色部分)的复合物模型;
图B:对接(结合)了hepcidin(中间深蓝色部分)的SARS-CoV-2 Spike三聚体与human ACE2的复合物模型。
2、SARS-CoV-2 Spike结合Hepcidin的区域,与Spike的变构调节区域(AMR)部分重叠。
对变构作一些说明。
变构即构象改变。蛋白质或分子的变构,指某些蛋白质/分子与其它物质结合后,构象发生改变,其结合特性、生物活性也随之改变的现象。使蛋白质/分子构象发生改变的结合物质称为配体或配基,与配体作用、结合的蛋白质/分子的特定部位称为蛋白质/分子的变构部位或变构区域。
有变构特性的蛋白称为可变构蛋白,最经典的可变构蛋白是红血球(红细胞)中的血红蛋白(hemoglobin,Hb)。血红蛋白含有四个亚基(两条α链,两条β链),每个亚基由一条肽链和一个血红素分子构成,每个血红素又由4个吡咯环组成,每个吡咯环中央有一个铁原子。如下图所示。
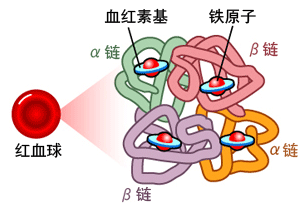
血红蛋白结构示意图
注。上图及部分血红蛋白变构的说明摘自:
什么是蛋白质的别构效应
https://www.sohu.com/a/101931503_374087
众所周知,血红蛋白的核心功能是运送氧气(O2)。血红蛋白结合、释放氧的过程都涉及变构。未与氧结合前,血红蛋白四个亚基间结合紧密,不易与外部的氧分子(O2)结合。氧分子不能一步到位直接结合到血红蛋白或血红素,它需要先与血红素吡咯环中央的铁原子结合,与铁原子的结合将先使氧分子变构,构象改变后的氧分子恰好能够进入、对接到血红素的吡咯环中,达成氧分子与血红蛋白某一亚基的结合。氧分子与某个亚基结合后,血红蛋白将发生变构,各亚基间的相互作用减弱,未结合氧的亚基构象变得更易于结合氧分子。下一个亚基与氧分子结合后,血红蛋白将继续变构,进一步扩大易与氧结合的趋势。血红蛋白最后一个(第4个)结合氧的亚基的O2结合亲和力是第1个结合氧亚基O2结合亲和力的数百倍。变构也同样发生在氧分子的释放过程中,每次氧的释放都促使血红蛋白变构,使它的含氧亚基更易于释放氧分子。
血红蛋白的变构区域或变构部位就是血红素上结合氧分子的吡咯环。稍后将看到,SARS-CoV-2 Spike的变构调节区域(Allosteric Modulation Region,AMR)可通过结合铁调素使SARS-CoV-2 Spike变构。
SARS-CoV-2 Spike也能够不借助配体自行变构。德国科学家2020年10月的《Science》论文指出,SARS-CoV-2 Spike中存在三个柔性铰链,这组铰链的运动机制与人体髋、膝、踝三个关节类似,它们赋予SARS-CoV-2 Spike很高的运动自由度,Spike能够通过三关节式铰链结构灵活调节姿态和构象,高效结合ACE2,有效逃避抗体结合,逃避免疫系统的搜索、攻击。SARS-CoV-2拥有多重免疫逃避、免疫屏蔽机制,比如,它还可通过“RRAR”furin酶切位点附近的O-Linked聚糖结构获得另一重免疫屏蔽、免疫逃避能力。关于德国科学家《Science》论文的更详细介绍,可参阅笔者之前的文章:
出自科学疯子之手的病毒集大成者(二)
3、SWARM对接分析表明,hepcidin25可与SARS-CoV-2 Spike三聚体开放构象下的变构调节区域(AMR)及AMR周边区域结合,结合能(binding energy)约为−22、−24 kcal/mol ;SWARM盲灵活对接(SWARM blind and flexible docking)表明,Hepcidin优先与AMR结合。
hepcidin25也能以高亲和力结合SARS-CoV-2 Spike三聚体(trimeric)或单体(monomeric)的ACE2结合位点区域(ACE2 binding-site region),这表明hepcidin25、ACE2可能对SARS-CoV-2 Spike存在结合竞争。下图展示了SWARM对接的结果。
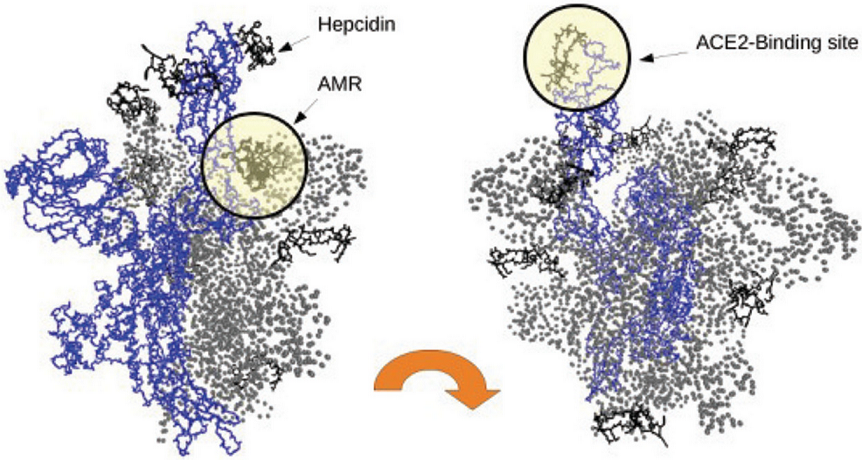
hepcidin25可与SARS-2 Spike的AMR、AMR邻近区域、ACE2结合区域结合
图中蓝色部分对应SARS-CoV-2 Spike三聚体(ABC)的C链(chain C,即单体C,monomeric C),灰色部分对应三聚体的另外两个链/单体(A、B);
图中较小的黑色丝条状物代表结合至Spike不同区域的hepcidin25;
左图、右图可能分别对应Spike三聚体的开放构象、闭合构象。
SARS-CoV-2的Spike蛋白为同源三聚体,三聚体中的三个单体结构相同,每个单体都由S1亚基(受体结合亚基)、S2亚基(膜融合亚基)构成。
关于SWARM对接(SWARM docking),论文以Web server SWARM为工具分析、研究蛋白质(包括多肽)间的相互作用情况。Web server SWARM基于SwarmDock算法,支持对蛋白质/多肽间的相互作用进行灵活的对接建模,确定或排除可结合性,模拟、计算、呈现结合细节(如对接姿态、结合部位、结合亲和力等等),并对可结合的蛋白/多肽生成、输出复合物的3D结构图。
4、多种算法的计算、分析结果表明,Spike与Hepcidin的结合增强了Spike与ACE2的结合亲和力和相互作用强度,增强了ACE2-spike复合物的稳定性;
当hepcidin25未与AMR结合时,Spike三聚体与ACE2的预测结合能为-47kcal/mol,当hepcidin25与AMR结合时,Spike三聚体与ACE2的预测结合能增至-52kcal/mol。
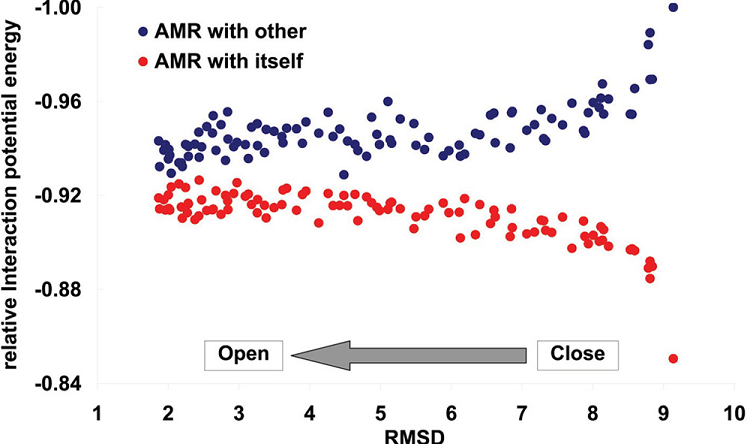
5、虽然我们预测hepcidin25与AMR在开放构象下的结合一定程度上提升了Spike与ACE2的结合亲和力,但我们还观察到,hepcidin25与AMR的结合将使Spike从RBD向上(挺立)的有利于结合ACE2的开放构象(open conformation)/开放状态(open state)转换为(RBD倒伏的)不利于结合ACE2的闭合构象(closed conformation)/闭合状态(closed state),与hepcidin25结合的Spike将在更多时间内处于闭合构象/闭合状态。
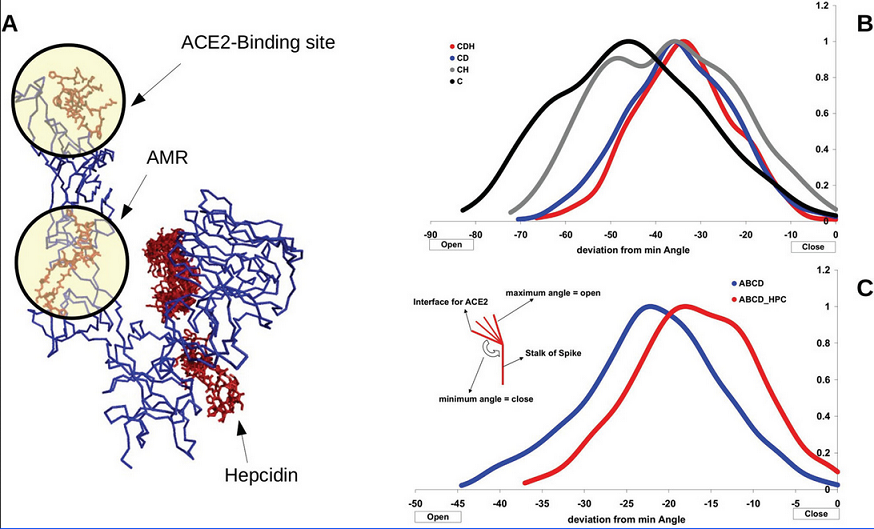
hepcidin25对SARS-CoV-2 Spike动力学(dynamics)的影响
图A:SARS-CoV-2 Spike三聚体C链上的hepcidin25对接结合位点(Docked binding sites);
图B:SARS-CoV-2 Spike三聚体C链在四种情况下的仰角(姿态)时长关系;
图C:SARS-CoV-2 Spike三聚体整体在两种情况下的仰角(姿态)时长关系。
Spike三聚体或其某个单体/链的角度/仰角反映其直立、躺伏、侧倾等姿态,仰角最大的直立姿态对应充分开放的构象,仰角最小的躺伏姿态对应高度闭合的构象,仰角较大的开放构象有利于结合ACE2。
Spike的构象、姿态、仰角是动态变化的,Spike可能只在某些时间段内处于某一构象/姿态/仰角。图B、图C反映了Spike三聚体或其单体/链在不同情况下处于不同仰角的相对时长。
研究者在SARS-CoV-2 Spike上选取了三个参照氨基酸残基,以它们的空间位置来测定Spike三聚体整体或某个单体/链的角度/仰角,如图C左上区域所示。三个参照残基分别位于Spike的ACE2结合位点区域、AMR附近、茎区(stalk of spike,应该指spike的跨膜区域,膜指病毒包膜),它们在Spike蛋白氨基酸序列中的序号分别为494、538、1042。SARS-CoV-2 Spike蛋白氨基酸序列的长度为1273或1269。
图B的四条曲线反映Spike C链在四种情况下处于不同仰角姿态的相对时长。
C:未结合hepcidin25、ACE2的Spike C链;
CH:AMR与hepcidin25结合的Spike C链;
CD:与ACE2结合的Spike C链;
CDH:AMR与hepcidin25结合,同时结合ACE2的Spike C链。
图C的两条曲线反映Spike三聚体整体在两种情况下处于不同仰角状态的相对时长。
ABCD:仅结合ACE2的Spike三聚体;
ABCD_HPC:AMR与hepcidin25结合,同时结合ACE2的Spike三聚体。
图B、图C的横坐标为相对仰角,即仰角与最小仰角的差值(deviation from min angle),纵坐标应该是处于某一仰角的相对时长(笔者没有看到对纵坐标的说明)。
图中的最小仰角(minimum angle)大致为180度,最大仰角(maximum angle)大致为90度(以直立为大,以侧倾、躺伏为小),相对仰角为负值,最大仰角与最小仰角的差值或偏离值大致为-90度。
由图B可见,相比未结合hepcidin25、ACE2的Spike C链(对应黑色曲线),AMR与hepcidin25结合的Spike C链(对应灰色曲线)处于较大仰角姿态(开放构象)的时间变短,处于较小仰角姿态(闭合构象)的时间变长;
由图C可见,相比仅与ACE2结合的Spike(对应蓝色曲线),同时与hepcidin25和ACE2结合的Spike(对应红色曲线)处于较大仰角姿态(开放构象)的时间变短,处于较小仰角姿态(闭合构象)的时间变长。
6、除AMR(及附近区域)、ACE2结合位点区域外,hepcidin25还能与SARS-CoV-2 Spike的RBM(receptor binding motif,受体结合基序,RBD的一部分)结合;
当Spike三聚体处于开放构象时,hepcidin25优先与RBM结合,与AMR结合的机会较低;当Spike处于闭合构象时,hepcidin25倾向于(优先)与AMR结合;hepcidin25与AMR结合后倾向于将Spike由开放构象转换为闭合构象,或使其维持在闭合构象状态;
当Spike三聚体接近开放构象时,AMR周围呈现出一个hepcidin25结合位点,hepcidin25将结合到AMR 的外壁,而非穿透AMR,结合到AMR腔中(The rectified spike chain in the trimeric form of spike protein presents a binding site around the AMR for hepcidin25 when it is near to the open conformation...but hepcidin25 is not successful for penetrating into the AMR; instead of binding into the AMR cavity it binds to the external wall of the AMR.);
当Spike三聚体转变为开放构象时,hepcidin25与AMR的结合亲和力降低,此时RBM成为hepcidin25的更佳结合位点(It is indicated in Figure 13B that the RBM is becoming a better binding site for hepcidin25 upon transition of trimeric spike to the open state...It is indicated in Figure 13C that the affinity of hepcidin25 is decreased for AMR upon transition of spike to the open state.);
Spike三聚体由闭合状态转换为开放状态后,AMR与Spike其它区域的接触减少,内部残基相互接触增加,AMR变得更紧密,这种紧密的结构不利于结合hepcidin,使hepcidin25与AMR的结合机会及结合亲和力降低;
当Spike由闭合构象转换为开放构象时,AMR与外部的作用减少,自身内部作用增加。
在Spike由闭合构象转变为开放构象过程中,RBM相应地发生结构变化,RBM对hepcidin25的SWARM预测的结合亲和力(SWARM-predicted affinity)也不断变化。
论文依据二
COVID-19 and iron dysregulation: distant sequence similarity between hepcidin and the novel coronavirus spike glycoprotein
COVID-19和铁失调:铁调素和新型冠状病毒刺突糖蛋白之间的远距离序列相似性
https://biologydirect.biomedcentral.com/articles/10.1186/s13062-020-00275-2
Published: 16 October 2020
论文所说的遥远(distant),可能指新型冠状病毒Spike蛋白,与人类和某些脊椎动物铁调素多肽在分类关系、物种进化关系上的遥远距离。
论文指出:
1、某些冠状病毒Spike蛋白的尾部区域(C-terminal region,C端区域),与某些脊椎动物的铁调素存在氨基酸序列相似性,SARS-CoV-2 Spike蛋白的尾部区域与人类铁调素存在显著的氨基酸序列相似性。如下图所示。
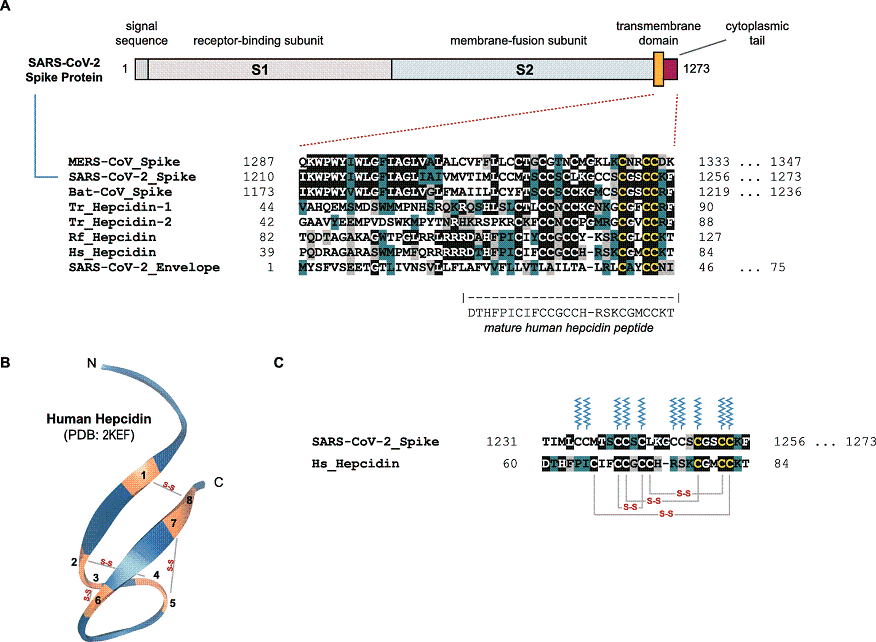
图A上图:SARS-CoV-2 Spike蛋白结构。
cytolasmic tail,直译为细胞质的尾部,原指细胞跨膜蛋白延伸至细胞膜内、细胞质中的尾部区域,此处指冠状病毒Spike蛋白延伸至病毒包膜内的尾部区域。
Spike的尾部区域(cytolasmic tail)对应C-端区域(C-terminal region/C-terminal domain),与之相对的是N-端区域(N-terminal region/N-terminal domain)。C-端指碳端、羧基端、COOH端,N-端指氮端、氨基端、NH2端,在图A中,Spike左端是N-端,右端是C-端。
图A下图:三种冠状病毒Spike尾段(C-terminal region/cytolasmic tail)、四种铁调素、SARS-CoV-2 Envelope(包膜蛋白)的氨基酸序列比对。
比对区域包括47个氨基酸(1210-1256)。
MERS-CoV_Spike,MERS-CoV(中东呼吸综合症病毒)的Spike蛋白;
SARS-CoV-2_Spike,SARS-CoV-2的Spike蛋白;
Bat-CoV_Spike,一种蝙蝠冠状病毒--JTMC15的Spike蛋白,JTMC15发现于中国吉林,样本收集于2013年,序列提交、共享于2015年,宿主为Rhinolophus ferrumequinum(马铁菊头蝠,又名大蝙蝠、花脸蝙蝠)。JTMC15 Spike蛋白的Genbank访问地址为:
https://www.ncbi.nlm.nih.gov/protein/ANA96027.1
Tr_Hepcidin-1,红鳍东方鲀/日本河豚的铁调素(hepcidin),‘Tr’表示Takifugu rubripes(红鳍东方鲀)/Japanese pufferfish(日本河豚);
Tr_Hepcidin-2,红鳍东方鲀/日本河豚的类铁调素(hepcidin-like),各个河豚物种都至少具有一个hepcidin基因和一个hepcidin-like 基因;
Rf_ Hepcidin,JTMC15的宿主--马铁菊头蝠(Rhinolophus ferrumequinum)的铁调素;
Hs_Hepcidin,智人(Homo sapiens)或人类的铁调素。
图中深绿色的残基为保守残基,灰色的残基为相似残基,黑色及黑色高光的残基为相同残基。
图B:人类铁调素(Human Hepcidin)的NMR(Nuclear Magnetic Resonance,核磁共振)结构。
图B展示了Human Hepcidin的反向平行β折叠(antiparallel beta-sheet fold)结构,黄色区段表示的八个半胱氨酸残基(cysteine residues),连线指示的半胱氨酸残基间的4个二硫键(disulfide bonds)。
图C:SARS-CoV-2_Spike尾部区域与Hs_Hepcidin的氨基酸序列局部比对。
图C比对区域包含26个氨基酸残基(1231~1256)。
SARS-CoV-2_Spike尾部区域和Hs_Hepcidin/Human Hepcidin都高度富集半胱氨酸(Cysteine,C),如图中纵向波纹线所示,SARS-CoV-2_Spike在比对区域内有10个半胱氨酸残基,论文称它们为potential palmitoylation residues(潜在的棕榈酰化残基);Hs_Hepcidin的8个半胱氨酸残基也都在比对区域内,图C用连线标出了4对半胱氨酸残基之间的4个二硫键(S-S)。
二者26个比对残基中有8个相同(CC、C、CG、CCK),同一性约为31%;比对区域后7个残基中有5个相同(CG、CCK),同一性约为71%;比对区域内的8个相同残基中,6个是半胱氨酸残基(Cysteine,C)。
2、SARS-CoV-2 (等某些冠状病毒)Spike尾部区域与铁调素的氨基酸序列相似性是独特且特异的,虽然硬骨鱼(teleosts)和脊椎动物(vertebrates)体内通常含有许多富含半胱氨酸的蛋白质(或多肽),
Moreover, there are many cysteine-rich protein sequences in teleosts and vertebrates in general, yet this similarity to the hepcidin gene family (not merely a one-off sequence) was unique and specific.
但Blast搜索未能发现与SARS-CoV-2 Spike尾部区域相似的其它蛋白或多肽。
The search that found hepcidin did not reveal a range of similarities with other teleost proteins.
也就是说,在现有生物数据库中,与SARS-CoV-2 Spike尾部区域氨基酸序列相似的蛋白或多肽只有铁调素(一种类型)。
硬骨鱼是所含物种最多的主要鱼类类别,常见鱼类、大部分有颌鱼类都属于硬骨鱼,广义上的硬骨鱼还包括由硬骨鱼演化产生的陆生脊椎动物。
Blast,Basic Local Alignment Search Tool(基于局部比对算法的搜索工具),一种基因/蛋白研究的有力工具,基本功能是在生物数据库中搜索指定的基因(核苷酸)序列(/片断)、氨基酸序列(/片断)的匹配序列,提供匹配列表、序列间的比对细节、各种匹配参数、图形化呈现。Blast由NCBI(美国国家生物技术信息中心)提供,可在线自由使用。
3、比对了已知的有人类致病能力的七种冠状病毒、一种蝙蝠冠状病毒的Spike尾部区域与四种铁调素的氨基酸序列,如下图所示。
上半图:七种人类致病冠状病毒、蝙蝠冠状病毒JTMC15的Spike尾部区域与四种铁调素氨基酸序列的局部比对;
下半图:上半图中的12个序列(比对区域内部分)两两间的氨基酸同一性、保守性(括号内数字)百分比。
比对区域同样包含26个氨基酸残基(1231~1256)。
同一性百分比指两个序列相同氨基酸残基的百分占比;保守性百分比应该指两个序列相同、相似、保守氨基酸的百分占比。
已知的有人类致病能力的冠状病毒共七种,它们是:HCoV-229E、HCoV-NL63、HCoV-HKU1、HCoV-OC43、MERS-CoV、SARS-CoV-1、SARS-CoV-2,前四种病毒通常只引起普通感冒,众所周知,后三种病毒可引发严重症状并可导致患者死亡。
如前所述,Bat-CoV指代马铁菊头蝠冠状病毒JTMC15。
上半图中的两个黑色箭头指示两个保守的半胱氨酸(cysteine,C)位点,这两个位点的半胱氨酸(C)残基为12个序列所共有;红色箭头指示一个甘氨酸(glycine,G)位点,它为四种冠状病毒(MERS-CoV、SARS-CoV-1、SARS-CoV-2、JTMC15)Spike及两种河豚铁调素(Tr_Hepcidin-1、Tr_Hepcidin-2)序列所共有。
论文称,前四个刺突蛋白(对应四种普通感冒冠状病毒)的基序(motif,特定序列片断)与其余序列的相似性似乎要少(there appears to be less similarity in the motif between the first four spike proteins than the rest of the sequences)。
笔者观察,就两个黑色箭头之间的区域,及比对区域26个残基的后8个残基而言,八种冠状病毒中,SARS-CoV-2、SARS-CoV-1 Spike尾部区域与人类/智人铁调素(Hs_Hepcidin)的相似性更显著一些,在比对区域后8个残基中,二者与Hs_Hepcidin有5个残基相同(CG、CCK),其次是JTMC15和HCoV-OC43,二者与Hs_Hepcidin有4个残基相同(CG、CC)。不清楚Hs_Hepcidin比对区域内倒数第二个氨基酸残基--赖氨酸(K,Lysine,83)在其分子、生理功能(结合、降解铁转运蛋白,抑制铁释放,减少循环铁)中的作用。
不过,就比对区域26个残基总体而言,SARS-CoV-2、SARS-CoV-1、JTMC15、HCoV-OC43 、HCoV-HKU1五种冠状病毒Spike尾部区域与Hs_Hepcidin的同一性相同,它们与Hs_Hepcidin都有8个相同残基。
4、不难发现,SARS-CoV-1、SARS-CoV-2 两种病毒Spike尾部比对区域的氨基酸残基几乎完全相同,二者26个比对残基仅有2个不同,同一性高达92%,二者仅有的两个差异位点残基是L~M、A~C。
笔者注:这意味着,发生两个氨基酸的突变,SARS-CoV-1的比对区域就可演化为SARS-CoV-2的对应区域;同样,实施两个氨基酸的替换,就可将SARS-CoV-1的比对区域改造为SARS-CoV-2的对应区域。这表明,SARS-CoV-2与SARS-CoV-1渊源密切,二者要么有着密切的进化渊源,要么有着密切的设计渊源,后一种情况意味着,SARS-CoV-1的Spike是SARS-CoV-2 Spike的设计模板(之一),转基因改造底板(之一)。
SARS-CoV-2是SARS-CoV-1在动物宿主体内自然演化、自然重组产生的吗?
5、铁调素能够结合唯一的细胞铁输出蛋白—铁转运蛋白(ferroportin,FPN)并介导其降解。本论文报告的SARS-CoV-2 Spike尾部区域与人类铁调素的序列相似性能否在细胞水平上发挥重要作用?这一尾部区域是否可以部分模仿铁调素与铁转运蛋白的相互作用,是否可以协调并结合铁转运蛋白?与铁调素类似的SARS-CoV-2 Spike蛋白是否可能通过促进(肺泡)巨噬细胞的铁固存,从而阻碍宿主的初始免疫反应?这些问题都有待实验研究、确定。
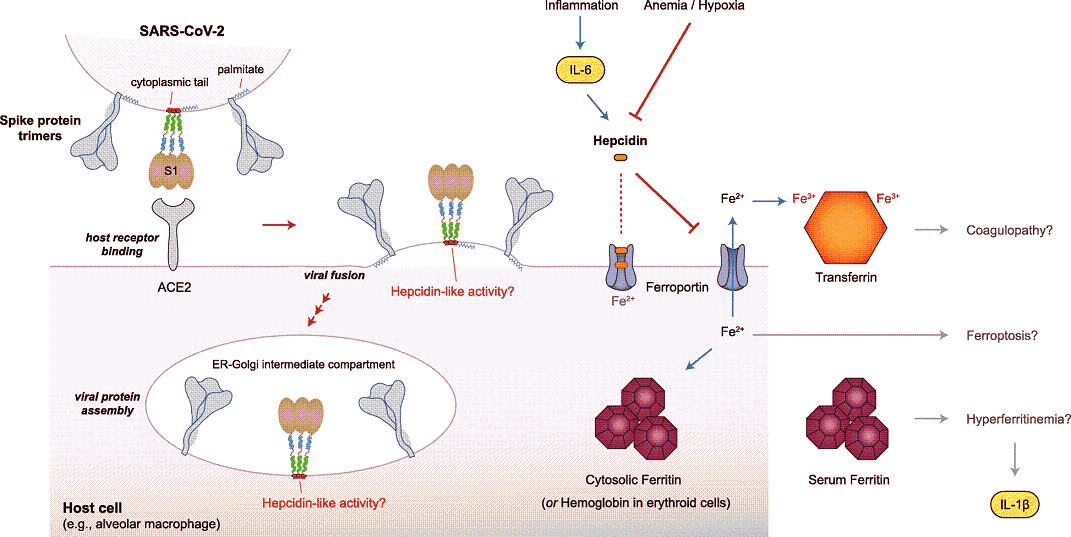
SARS-CoV-2 Spike可能的铁调素作用,人类铁调素的功能,几种铁调素(失调)相关的疾病的总结概要图。
论文没有提及,SARS-CoV-2外的其它冠状病毒(如SARS-CoV-1、MERS-CoV)是否可能模仿铁调素的分子作用和生理功能(结合、降解铁转运蛋白,抑制铁释放,减少循环铁),干预、干扰宿主铁代谢。笔者没有看到有关其它冠状病毒、其它病毒铁调素模仿的论文。
论文依据三
Iron dysregulation in COVID-19 and reciprocal evolution of SARS-CoV-2: Natura nihil frustra facit
COVID-19中的铁失调与SARS-CoV-2的互惠进化:大自然并没有受挫
https://onlinelibrary.wiley.com/doi/10.1002/jcb.30207
First published: 08 January 2022
论文研究了SARS-CoV-2模拟宿主激素--铁调素的机制,并通过蛋白质建模(protein modeling)、对接(docking)和MD模拟(Molecular Dynamics simulations,分子动力学模拟)证明了SARS-CoV-2的铁调素模仿能力。计算机模拟研究表明:
a) SARS-CoV-2 Spike的尾部片断—“Covidin”多肽能够模仿铁调素的铁转运蛋白结合能力,即,Covidin也能够结合铁转运蛋白(ferroportin,FPN);
该研究不能对Covidin的铁转运蛋白降解能力作出明确判断(有待病毒-细胞实验验证),但论文指出,Covidin可能通过泛素蛋白酶体途径(via the ubiquitin proteasomal pathway)引起铁转运蛋白降解,导致宿主铁代谢失调;
即,这一计算机模拟研究的结论是,SARS-CoV-2 Spike的尾部片断—Covidin多肽至少能够模仿铁调素的部分作用--结合铁转运蛋白。
b) Covidin对主要的人体蛋白酶具有抗性,很难被降解为更小的片断;
c) 编码Covidin的基因区域在各种SARS-CoV-2变体中高度保守,极少变异,Covidin片断几乎为所有已知的SARS-CoV-2变体所共有。
更具体地,论文指出:
1、SARS-CoV-2 Spike在人体内被蛋白酶降解(水解)后将稳定地释放出其尾部片断,论文称这一片断为Covidin肽。Covidin肽对众多人体蛋白酶具有抗性,很难再被降解为更小的片断。未完成的病毒组装(如在SARS-CoV-2复制过程中细胞死亡)也将产生并向人体中释放Covidin肽。Covidin肽大体就是“论文依据二”所说的与铁调素氨基酸序列相似的SARS-CoV-2 Spike尾部区域。
SARS-CoV-2 Spike蛋白的人体蛋白酶活性位点分布
由图可见,Covidin区域内人体蛋白酶活性位点(裂解位点)极少,这意味着它很难再被人体蛋白酶降解为更小的片断。
QHD43416是SARS-CoV-2 Wuhan-Hu-1毒株Spike蛋白的Genbank ACCESSION(序列编号)。
论文使用iProt-Sub Server 和MEROPS database预测、验证宿主蛋白酶特异性和Spike蛋白的蛋白酶裂解位点。上图汇总了对四个主要蛋白酶家族(aspartic,cysteine,metallo-,and serine)的38种不同蛋白酶的预测、验证结果。
Aspartic指天冬氨酸蛋白酶(Aspartic protease)家族;
Cysteine指半胱氨酸蛋白酶(Cysteine proteases)家族;
Metallo指金属蛋白酶(Metalloproteases)家族;
Serine指丝氨酸蛋白酶(Serine proteases)家族。
上述四个蛋白酶家族加上另外二个家族:苏氨酸蛋白酶(Threonine proteases)家族、谷氨酸蛋白酶(Glutamic acid proteases)家族,合称六大蛋白酶家族。
2、编码Covidin肽的RNA区域在已识别的众多SARS-CoV-2变体中高度保守(几乎100%保守),突变率极低。GSAID数据库中2019年12月至2021年8月间采样的4298个SARS-CoV-2基因组数据显示,Covidin编码区域的平均突变多样性(average mutational diversity)为0.0028,远低于与全基因组平均突变多样性0.2,及刺突蛋白平均突变多样性0.05。
SARS-CoV-2 基因组不同区域/位点的当前突变率(Current mutation rates)
图A:全基因组突变率;图B:Spike蛋白编码区域突变率;图C:Covidin编码区域突变率。
由图C可见,Covidin编码区域内几乎没有任何突变位点。
(图A显示的Spike区域的突变密度、突变频率似乎高于基因组大多数区域)
Covidin肽的高度保守性,在各种变体中的高度一致性、高度稳定性意味着,SARS-CoV-2 Spike-Covidin肽对铁调素的分子作用模拟和可能的生理功能模拟,所引发的铁代谢失调后果适用于几乎所有已知的SARS-CoV-2变体。
3、Covidin的肽模型与Hepcidin(结构)高度相似,二者与铁转运蛋白(ferroportin,FPN)的相互作用也显著相似。
The peptide models of Covidin were highly similar to Hepcidin (Figure 6). The docking with modeled ferroportin showed biochemical conservancies, and the interactions observed also have significant physiological mimicry of host Hepcidin.
Hepcidin和Covidin均与铁转运蛋白细胞外域的中心孔(central pore of Ferroportin's extracellular domains)强烈结合,Covidin-Ferroportin复合物与Hepcidin-Ferroportin复合物有着相似的交互作用特征和结合空间;
Both Hepcidin and Covidin bind strongly to the central pore from the extracellular space of a host iron transporter “ferroportin” and the resulting complex has similar interaction features and binding space as the natural hormone Hepcidin.
Ferroportin结合Hepcidin的位点与其结合Covidin的位点有85%的空间重叠(spacial overlap);MD模拟(Molecular Dynamics simulation)表明,比之Hepcidin,Covidin与Ferroportin有更多的相互作用,Covidin-Ferroportin复合物比Hepcidin-Ferroportin复合物更稳定。
The interaction MAP revealed 85% spacial overlap in the binding site, and Covidin has more interactions with the target ferroportin (Figure 7).
But as seen with the interaction map, the Covidin-ferroportin complex was more stable than the Hepcidin-ferroportin complex.
长MD模拟(100ns)无法揭示Hepcidin或Covidin如何促进铁转运蛋白泛素化和降解。
Long MD simulations (100 ns) could not reveal how Hepcidin or Covidin promote ferroportin ubiquitination and degradation,
Figure 6 天然铁调素(A)、Covidin(B)分别与铁转运蛋白中心孔对接的3D结构示意图
笔者注:从此图似乎看不出Covidin与Hepcidin结构的高度相似性。
Figure 7 Hepcidin(A)、Covidin(B)分别与Ferroportin胞外结构域中心孔结合的氨基酸作用细节对比图
论文大图地址:
https://onlinelibrary.wiley.com/cms/asset/6971cb5a-f49b-4046-95a1-825e105dfb21/jcb30207-fig-0007-m.jpg
4、感染组织中的大量Covidin可能是SARS-CoV-2感染引发ARDS(acute respiratory distress syndrome,急性呼吸窘迫综合征)的促成因素之一。感染组织中的Covidin可能来自成熟SARS-CoV-2病毒Spike的降解,也可能来自垂死的被感染细胞(如肺成纤维细胞)中未完成的SARS-CoV-2复制、组装;
我们的蛋白水解、蛋白质建模、肽对接和MD模拟实验有力地支持了Covidin模拟宿主Hepcidin生物功能的假设;
Our proteolysis, protein modeling, peptide docking, and MD simulation experiments strongly support functional biological mimicry of Covidin with the natural host Hepcidin hormone.
SARS-CoV-2对Hepcidin的模拟,对人体铁代谢的干预,可能与其相对较大且资源密集型的高病毒周转率导致的高铁需求有关(SARS-CoV-2的复制过程很可能也需要铁);
由于Covidin模仿Hepcidin,因此它应该通过泛素蛋白酶体途径(via the ubiquitin proteasomal pathway)引起铁转运蛋白(ferroportin)降解,因而单独的拮抗剂不能逆转细胞内铁超载。
As Covidin mimics Hepcidin, it should, therefore, cause ferroportin degradation via the ubiquitin proteasomal pathway, whereby antagonists alone cannot reverse the intracellular iron overload.
(铁转运蛋白降解使血清铁降低,)低血清铁导致红细胞生成减少,这可能加速缺氧,使患者病情迅速恶化。根据最近关于SARS-CoV-2入侵红细胞生成细胞的报道,这种(铁转运蛋白降解引发的)缺氧可能会因此而进一步加剧。
The hypoxia might also be accelerated by reduced erythropoiesis due to low serum iron, rapidly deteriorating a patient's condition, and aggravating COVID-19 morbidity. This hypoxia may be further aggravated based on recent reports of SARS-CoV-2 invading erythropoietic cells.98
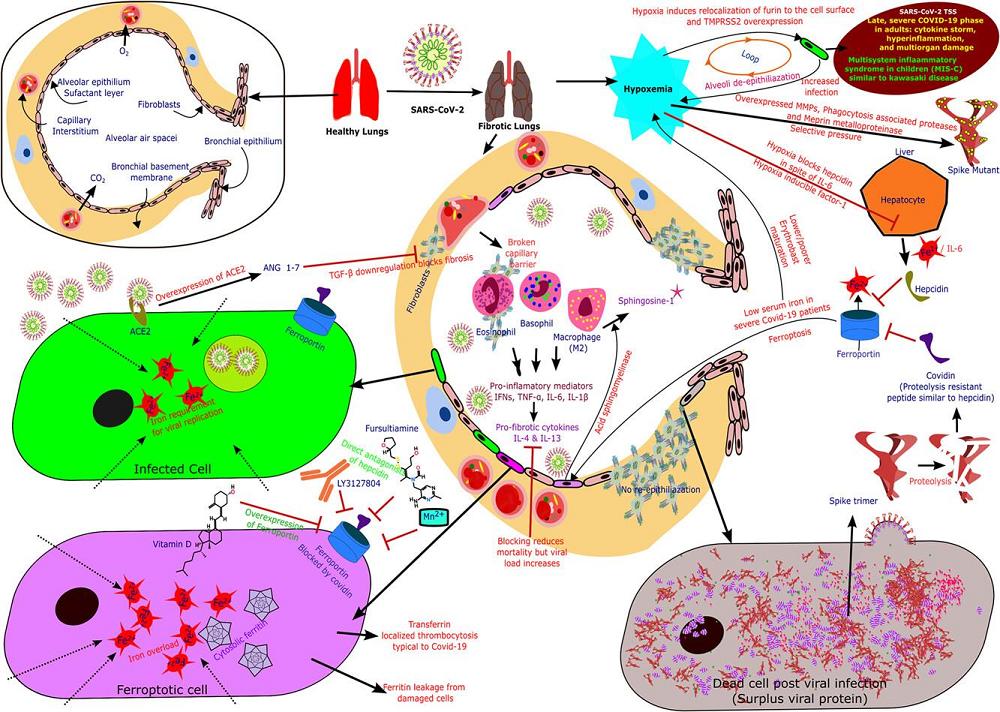
铁调素样肽Covidin引发的假设的铁失调,与COVID-19 患者实际临床情况的关联卡通图。
5、铁调素(Hepcidin)将结合、内化、降解铁转运蛋白(ferroportin),减少血清中的铁,增加(小肠上皮细胞、巨噬细胞、胎盘细胞等)细胞内的铁,如果宿主Hepcidin和可模拟Hepcidin的Covidin都处于高水平(SARS-CoV-2感染的过度炎症-hyperinflammation反应将提升Hepcidin水平),那么,将可能使细胞内的铁达到有毒水平,如果细胞内的铁负载及铁介导的自由基超出了铁蛋白(ferritin,细胞内的铁储存蛋白)的容纳和细胞的承受能力,将导致细胞铁死亡。过量铁介导、催化的自由基(free radicals)随着细胞铁死亡而释放到组织液中,对周围细胞也有毒性。
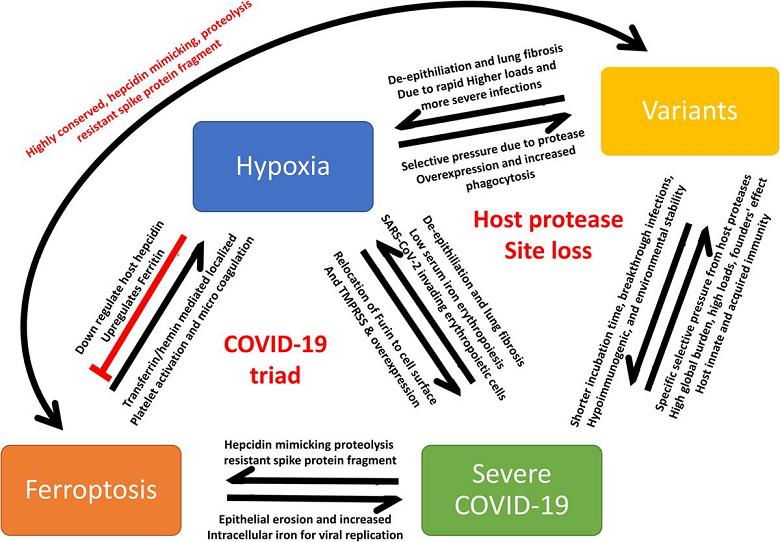
COVID-19病理学和进化的不同子集的破译关系概览
论文依据四
Iron and iron-related proteins in COVID-19
COVID-19中的铁和铁相关蛋白
https://link.springer.com/article/10.1007/s10238-022-00851-y
Published: 18 July 2022
论文回顾了铁和铁(代谢)相关的各种蛋白、多肽在COVID-19中的状态(升高、降低,不同严重程度患者间的差异),全面总结、介绍了已报告的SARS-CoV-2感染引起的铁和铁相关蛋白、多肽可能的状态改变,相应的临床检测数据、结果和研究结论,探讨、解析了铁代谢相关蛋白、多肽在COVID-19中的相互作用、相互关联、相互影响,它们的临床数据之间间关系和互动。
论文考察的参与COVID-19病理机制的铁代谢相关蛋白、多肽包括:铁蛋白(Ferritin)、铁调素(Hepcidin)、转铁蛋白(Transferrin)、转铁蛋白受体(transferrin receptor)、乳铁蛋白(Lactoferrin)、血红蛋白(Hemoglobin)、脂质运载蛋白-2(Lipocalin-2)。
下面是论文的总结综述图:
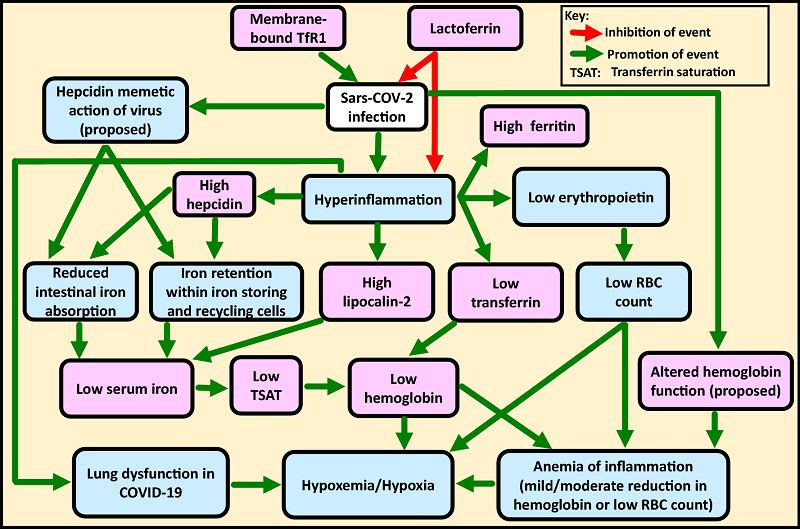
总结综述图:铁代谢相关因子在COVID-19中的状态,它们之间的相互关联、相互影响,在COVID-19病理机制中的角色。
论文两次提到SARS-CoV-2 Spike的铁调素模仿,有关内容摘录如下:
高水平的循环铁调素可抑制肠道铁吸收,并通过降解细胞铁转运蛋白(ferroportin)将铁锁定在铁储存和铁回收细胞内。这可以防止(血液)循环中铁水平的升高。因此,炎症诱导的铁调素增加(inflammation-induced hepcidin increment)导致全身性低铁血症(低铁血指低血清铁水平,low serum iron levels)。此外,发现了SARS-CoV-2 Spike蛋白与铁调素之间的结构相似性,据推测,病毒(SARS-CoV-2)Spike蛋白可能具有铁调素模拟作用(hepcidin-mimetic action)并诱导铁转运蛋白阻断(ferroportin blockage)。如果这一推测正确,那么这将进一步促进细胞内铁潴留并加剧全身性低铁血症(systemic hypoferremia)。
High levels of circulatory hepcidin inhibit intestinal iron absorption and lock iron within the iron-storing and iron-recycling cells by degrading the cellular-iron transporter ferroportin. This prevents iron entry and subsequent iron elevation in the circulation [111]. Thus, inflammation-induced hepcidin increment leads to systemic hypoferremia (low serum iron levels) [112]. In addition, structural similarity has been identified between hepcidin and SARS〤oV�2 spike protein. It has been hypothesized that the viral spike protein may have a hepcidin-mimetic action and induce ferroportin blockage [81]. If correct, then this can further promote intracellular iron retention and contribute to systemic hypoferremia.
。。。
低铁血症(hypoferremia)也可能由铁调素升高以外的原因引起。例如,可能由SARS-CoV-2 Spike蛋白推定的铁调素模拟作用(the putative hepcidin-mimetic action)引起,它将阻断铁转运蛋白(ferroportin),减少铁进入(血液)循环,导致低铁血症。另一个可能的原因是血清铁蛋白(serum ferritin)升高。正如在COVID-19中观察到的那样,除了提升血清铁调素外,炎症还提升铁蛋白(ferritin)水平。铁蛋白可以螯合(sequester)大量铁离子(iron ions),并且,相比转铁蛋白(transferrin,Tf),铁与铁蛋白和乳铁蛋白(lactoferrin ,Lf)的结合亲和力更高(在COVID-19 中转铁蛋白水平降低),铁蛋白对铁的大量螯合也可能导致低铁血症(hypoferremia)。
In such cases, hypoferremia may be caused due to reasons other than hepcidin elevation. For example, this could be due to the putative hepcidin-mimetic action of the viral protein [81], which would block ferroportin and thereby reduce iron entry into the circulation leading to hypoferremia. Another reason could be elevated serum ferritin. In addition to elevating serum hepcidin, inflammation elevates ferritin levels, as observed in COVID-19 (Table 1). Ferritin can sequester a large number of iron ions, and the higher affinity of iron to ferritin and lactoferrin than transferrin (although transferrin levels are reduced in COVID-19) may assist in this sequestration process and contribute to hypoferremia.
论文依据五
The Relationship Between Hepcidin-Mediated Iron Dysmetabolism and COVID-19 Severity: A Meta-Analysis
铁调素介导的铁代谢异常与COVID-19严重程度的关系:一项荟萃分析
https://www.frontiersin.org/articles/10.3389/fpubh.2022.881412/full
Front. Public Health, 26 April 2022
论文旨在评估铁调素相关的铁代谢因子(蛋白、多肽)和相关参数,探讨铁调素参与的铁代谢异常(iron dysmetabolism)与COVID-19 严重程度之间的关系。论文考察了477名不同严重程度的COVID-19患者,这些患者的临床检测数据表明:重症COVID-19病例血清铁调素(serum hepcidin)铁蛋白(serum ferritin)水平较高,血清铁(serum iron)水平较低,但转铁蛋白饱和度(transferrin saturation)无显着差异。论文认为,需要进一步的研究来验证铁调素介导的铁代谢轴(iron metabolism axis)在COVID-19病理和治疗中的(确切)作用。
关于SARS-CoV-2 Spike蛋白的铁调素模仿,论文指出:
Ehsani(“论文依据二”的作者)强调了SARS-CoV-2 Spike糖蛋白和铁调素多肽之间氨基酸序列的惊人相似性,这一观察结果为SARS-CoV-2的疫苗设计和生物工程抗体开发提供了思路。SARS-CoV-2的铁调素模拟作用(Hepcidin-mimetic action of SARS-CoV-2)可能会显着增加循环铁蛋白和组织铁蛋白(circulating and tissue ferritin),同时诱导SI(serum iron)缺乏。然而,SARS-CoV-2是否利用细胞膜上的铁转运蛋(ferroportin)作为侵入宿主细胞的另一种Spike结合受体,还需要进一步分析。此外,SARS-CoV-2是否通过模仿铁调素直接降解铁转运蛋白(whether SARS-CoV-2 directly degrades ferroportin through mimicking hepcidin),或通过炎症间接上调铁调素以介导铁代谢障碍,也需要仔细研究。
Ehsani highlighted the striking similarity between the amino acid sequence of the SARS-CoV-2 spike glycoprotein and the hepcidin protein (37). This observation provides ideas for vaccine design and bioengineered antibody development for SARS-CoV-2. Hepcidin-mimetic action of SARS-CoV-2 may markedly increase circulating and tissue ferritin, while inducing SI deficiency (32, 33). However, whether SARS-CoV-2 utilizes ferroportin on the cell membrane as another binding receptor for the spike protein to invade host cells requires further analysis. Moreover, whether SARS-CoV-2 directly degrades ferroportin through mimicking hepcidin or indirectly upregulates hepcidin through inflammation to mediate iron dysmetabolism also needs to be carefully investigated.
论文依据六
SciELO - Brazil - SARS-CoV-2 association with hemoglobin and iron metabolism
SARS-CoV-2与血红蛋白和铁代谢的关联
https://www.scielo.br/j/ramb/a/Mb65VBcXPsgS5z6Y86zwjjm/
Med. Bras. • Sept 2021
论文全面回顾了人体铁代谢机制、铁调素在铁代谢中的调节作用,考察、探讨了SARS-CoV-2感染引发的多种并发症,包括功能障碍性血红蛋白病、铁调素水平升高、氧化应激和(细胞)铁死亡、全身性低氧血症和高铁蛋白血症的内在机制,分析、指出了SARS-CoV-2感染对铁调素的影响,SARS-CoV-2的铁调素模仿这两方面的因素与这些并发症的可能的内在关联。
关于SARS-CoV-2 Spike蛋白的铁调素模仿,论文指出:
Esaki(就是“论文依据二”的作者Ehsani)指出,冠状病毒Spike蛋白的氨基酸序列与铁调素相同(应为相似),铁调素是铁代谢的主要系统调节剂。冠状病毒Spike蛋白与铁调素之间的这种相似性能够导致模仿效应(mimetic effect),这(或许)意味着SARS-CoV-2可以增加血清铁调素(或其模拟物),然后增加铁蛋白(ferritin),并引起高铁蛋白血症综合症(hyperferritinemic syndrome)。
Esaki demonstrated that the amino acid sequence of the coronavirus spike protein is identical to hepcidin, a protein that acts as the main systemic regulator of iron metabolism. Therefore, this similarity between hepcidin and coronavirus spike protein can lead to a mimetic effect, suggesting that SARS-CoV-2 can increase serum hepcidin and then ferritin, and cause hyperferritinemic syndrome5.
因此,功能障碍性血红蛋白病(dysfunctional hemoglobinopathy)与SARS-CoV-2相关的高铁蛋白血症(SARS-CoV-2-related hyperferritinemia)之间的关联可能影响红细胞的氧运输能力,导致缺氧;同时,非转铁蛋白结合铁(non-transferrin bound iron,NTBI,未与转铁蛋白结合的铁)导致组织损伤,并在炎症部位释放自由基(free radicals)。
Therefore, the association between dysfunctional hemoglobinopathy and SARS-CoV-2-related hyperferritinemia may affect the oxygen transport capacity of erythrocytes, thereby leading to hypoxia, while causing tissue damage due to non-transferrin bound iron (NTBI), and subsequently releasing free radicals at the inflammation sites6.
。。。
铁毒性(iron toxicity)在COVID-19病理生理学中的角色与SARS-CoV-2的铁调素模拟效应(the hepcidin mimetic effect of SARS-CoV-2)有关,铁转运蛋白(ferroportin)在胃肠道和网状内皮系统中的内化(internalization),导致SF(Serum ferritin,血清铁蛋白)的可用性受阻,这进而导致贫血(anemia)和高铁蛋白血症(hyperferritinemia),并最终造成细胞铁死亡(ferroptosis)。
The role of iron toxicity in the pathophysiology of COVID-19 is related to the hepcidin mimetic effect of SARS-CoV-2, with consequent internalization of ferroportin, both in the gastrointestinal tract and reticuloendothelial system, thereby causing a blockage in the availability of SF, which leads to anemia and hyperferritinemia, and ultimately ferroptosis5,17.
通过模仿铁调素的作用(Through mimicking the action of hepcidin),SARS-CoV-2过度增加组织内(例如肝脏、脾脏、骨髓和肌肉)铁蛋白(ferritin)的浓度,同时减少SF(Serum ferritin)的可用性,从而减少红细胞的产生。循环红细胞(circulating erythrocytes)的减少导致持续性的全身低氧血症(systemic hypoxemia),并阻碍组织氧合(tissue oxygenation),进而引发损伤性的急性呼吸综合症(acute respiratory syndrome)。
Through mimicking the action of hepcidin, SARS-CoV-2 exaggeratedly increases the concentration of intratissue (e.g., liver, spleen, bone marrow, and muscles)ferritin, while there is a reduction in the availability of SF, and consequently, a reduction in erythrocyte production. This decrease in circulating erythrocytes perpetuates systemic hypoxemia and hinders tissue oxygenation, which is already impaired in patients with acute respiratory syndrome.
论文依据七
COVID-19 compromises iron homeostasis:Transferrin as a target of investigation
COVID-19损害铁稳态:转铁蛋白作为研究目标
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9694355/
https://linkinghub.elsevier.com/retrieve/pii/S0946-672X(22)00189-4
https://pubmed.ncbi.nlm.nih.gov/36509021/
Published online 2022 Nov 25
论文旨在评估、分析COVID-19患者的铁(iron)、铁蛋白(ferritin)和铁调素(hepcidin)水平以及转铁蛋白受体(transferrin receptor)基因表达。论文考察、研究了427名参与者的铁代谢标志物,其中218人在2020年6月至2020年9月间被诊断为COVID-19患者,另外209人未患有该疾病。
关于SARS-CoV-2的铁调素模仿,论文指出(以下内容顺序摘录自论文不同章节、段落):
自COVID-19大流行开始以来,在患有这种疾病的个体中观察到了许多代谢改变(numerous metabolic alterations)。众所周知,SARS-CoV-2能够模仿铁调素的作用(SARS-CoV-2 can mimic the action of hepcidin),改变细胞内铁代谢(altering intracellular iron metabolism),但关于(SARS-CoV-2)对铁循环(iron cycle)其他途径可能造成的后果,仍然存在认识分歧。
Since the beginning of the COVID-19 pandemic, numerous metabolic alterations have been observed in individuals with this disease. It is known that SARS-CoV-2 can mimic the action of hepcidin, altering intracellular iron metabolism, but gaps remain in the understanding of possible outcomes in other pathways involved in the iron cycle.
。。。
COVID-19导致多种铁循环途径(iron cycle pathways)发生改变,铁和铁蛋白(ferritin)水平是反映感染状态、演变(进展)以及疾病预后的标志物。转铁蛋白受体(transferrin receptor)基因表达增加表明铁内化增加(increased iron internalization),并且,SARS-CoV-2对铁调素作用的模仿(the mimicry of hepcidin action by SARS-CoV-2)减少了经由铁转运蛋白的铁输出(iron export via ferroportin),这可以解释由细胞内铁捕获(intracellular trapping)引起的低铁循环水平(low circulating levels of iron)。
COVID-19 causes changes in several iron cycle pathways, with iron and ferritin levels being markers that reflect the state and evolution of infection, as well as the prognosis of the disease. The increased expression of the transferrin receptor gene suggests increased iron internalization and the mimicry of hepcidin action by SARS-CoV-2, reduces iron export via ferroportin, which would explain the low circulating levels of iron by intracellular trapping.
。。。
此外,由于(SARS-CoV-2)病毒的多重交互攻击,COVID-19会发生一系列生化途径失衡(biochemical pathway imbalances),例如铁代谢障碍(iron dysmetabolism)。据推测,这是因为SARS-CoV-2模仿了铁调素的作用(SARS-CoV-2 mimics the action of hepcidin),铁调素与铁转运蛋白(ferroportin)相互作用,导致该复合物(指ferroportin-hepcidin complex)内化和降解(causing the internalization and degradation of this complex),减少了细胞内铁的输出,进而引发高铁蛋白血症(hyperferritinemia)和铁死亡(ferroptosis)。
Furthermore, due to the multiple interactive levels of viral attack, a set of several biochemical pathway imbalances such as iron dysmetabolism occurs in COVID-19. This is supposedly because SARS-CoV-2 mimics the action of hepcidin [5], which interacts with ferroportin, causing the internalization and degradation of this complex, favoring iron entry into the cell and decreasing its export from the interior of cells [6], hyperferritinemia and ferroptosis develop [5].
。。。
除了增加铁蛋白外,有研究(还)指出了SARS-CoV-2模仿铁调素作用,增加循环和组织铁蛋白的能力(the ability of SARS-CoV-2 to mimic the action of hepcidin, increasing circulating and tissue ferritin)。这导致血清铁缺乏(serum iron deficiency)并降低血红蛋白(lowered hemoglobin)。过量的铁与氧分子相互作用产生活性氧(reactive oxygen),导致不同器官诸如肺、肝、肾和心脏的氧化损伤(oxidative damage),这会导致(细胞)铁死亡(ferroptosis)。在细胞外环境方面(Regarding the extracellular environment),血红蛋白病(hemoglobinopathy)和铁代谢异常(iron dysmetabolism)共同损害红细胞运输O2的能力,导致缺氧。从生理上讲,贫血性缺氧(anemic hypoxia)诱导肺血管收缩(pulmonary vasoconstriction)并增加微血管内纤维蛋白的形成(fibrin formation within this microvasculature)。因此,铁调素和铁转运蛋白的失调化相互作用(the dysregulated interaction of hepcidin and ferroportin)能够通过平滑肌增殖(through smooth muscle proliferation) 导致肺动脉高压(pulmonary artery hypertension),这可能有助于阐明COVID-19患者因呼吸衰竭而死亡的病理机制(which perhaps helps elucidate death from respiratory failure in these COVID-19 patients)。
In addition to increased ferritin, studies point to the ability of SARS-CoV-2 to mimic the action of hepcidin, increasing circulating and tissue ferritin. This induces serum iron deficiency and lowered hemoglobin [5]. Excess iron interacts with molecular oxygen generating reactive oxygen species, which contributes to oxidative damage in different organs, such as the lungs, liver, kidneys and heart, which can lead to ferroptosis [7]. Regarding the extracellular environment, the combination of hemoglobinopathy and iron dysmetabolism impairs the ability of erythrocytes to transport O2, resulting in hypoxia. Physiologically, anemic hypoxia induces pulmonary vasoconstriction and increased fibrin formation within this microvasculature. Thus, the dysregulated interaction of hepcidin and ferroportin can lead to pulmonary artery hypertension through smooth muscle proliferation [5], which perhaps helps elucidate death from respiratory failure in these COVID-19 patients.
。。。
关于铁和铁蛋白,本研究可以说支持了这样的假设:SARS-CoV-2,通过模仿铁调素的作用(by mimicking the action of hepcidin),增加铁蛋白的流通(increases circulation of ferritin),同时诱导血清铁和血红蛋白水平缺乏(inducing serum iron and hemoglobin level deficiency)。在这一动态中,患者会出现贫血状态(state of anemia),即使他们有高铁蛋白血症(hyperferritinemic)。(SARS-CoV-2)病毒(Spike)蛋白对铁调素的模拟作用(The mimetic action of the viral protein on hepcidin)能够导致铁转运蛋白阻断(ferroportin blockade)、细胞内铁捕获(intracellular iron trapping)和低铁血症(hypoferremia)。有证据表明,炎症期间,细胞内铁的积累(the accumulation of intracellular iron)也会增加铁蛋白,进一步增加细胞内铁的浓度,(与之有关的铁)代谢失调可导致早期多细胞铁死亡(early multicellular ferropoptosis)。
Considering the results of the present study, in relation to iron and ferritin, it can be said they support the hypothesis that SARS-CoV-2, by mimicking the action of hepcidin, increases the circulation of ferritin while inducing serum iron and hemoglobin level deficiency. In this dynamic, the patient develops a state of anemia, even though they are hyperferritinemic [5]. The mimetic action of the viral protein on hepcidin can lead to ferroportin blockade causing intracellular iron trapping and hypoferremia. There is evidence that during inflammation, the accumulation of intracellular iron also increases ferritin, further increasing the concentration of intracellular iron, evidencing metabolic dysregulation that can lead to early multicellular ferropoptosis [9].
其它相关论文
Increased serum levels of Hepcidin and ferritin are associated with severity of COVID-19
血清铁调素和铁蛋白水平升高与COVID-19的严重程度相关联
https://medscimonit.com/abstract/full/idArt/926178
Hepcidin and ferritin levels as markers of immune cell activation during septic shock, severe COVID-19 and sterile inflammation
铁调素和铁蛋白水平在败血性休克、严重COVID-19和无菌炎症中作为免疫细胞激活的标志物
https://www.frontiersin.org/articles/10.3389/fimmu.2023.1110540/full
COVID-19: hemoglobin, iron, and hypoxia beyond inflammation. A narrative review
COVID-19:炎症之外的血红蛋白、铁和缺氧。叙述性回顾
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7267810/
https://www.mdpi.com/2039-7283/10/2/1271
COVID-19, Cation Dysmetabolism, Sialic Acid, CD147, ACE2, Viroporins, Hepcidin and Ferroptosis: A Possible Unifying Hypothesis
COVID-19、阳离子代谢异常、唾液酸、CD147、ACE2、病毒孔蛋白、铁调素和铁死亡:一个可能的统一假设
https://f1000research.com/articles/11-102
Covidin, a possible new player between hepcidin and ferroportin in hypoxia and inflammation caused by COVID-19
Covidin,在COVID-19引起的缺氧和炎症中,铁调素和铁转运蛋白之间可能的新参与者
https://onlinelibrary.wiley.com/doi/10.1002/jcb.30246
Hyperferritinemia, Low Circulating Iron and Elevated Hepcidin May Negatively Impact Outcome in COVID-19 Patients: A Pilot Study
高铁蛋白血症、低循环铁和铁调素升高不利于COVID-19患者的预后(治疗结果):一项探索研究
https://www.mdpi.com/2076-3921/11/7/1364
The
relationship between serum erythropoietin, hepcidin, and haptoglobin
levels with disease severity and other biochemical values in patients
with COVID-19
COVID-19患者血清促红细胞生成素、铁调素和触珠蛋白水平与疾病严重程度和其他生化值之间的关系
https://onlinelibrary.wiley.com/doi/10.1111/ijlh.13479
Ferroptosis and multi-organ complications in COVID-19 mechanisms and potential therapies
COVID-19机制和潜在疗法中的铁死亡和多器官并发症
https://www.frontiersin.org/articles/10.3389/fgene.2023.1187985/full
9、ferroportin(铁转运蛋白)
铁转运蛋白(ferroportin,缩写为FPN或FP),又称膜铁转运蛋白,是已知的唯一一种细胞铁输出蛋白,它结合细胞内的二价铁离子(Fe2+),并将其释放到细胞外。铁转运蛋白是小肠细胞、(肝、脾中的)巨噬细胞、肝细胞、胎盘细胞等细胞输出、释放铁的唯一“水龙头”,铁转运蛋白对小肠(十二指肠)的膳食铁吸收也非常重要。
铁转运蛋白(FPN)还有其它多种名称,如铁调节转运体(Iron-regulated transporter,IREG)、金属转运蛋白(metal transport protein,MTP)等等。
人类和哺乳动物的铁转运蛋白可能只有ferroportin-1(FPN-1,FPN1)一种形式;植物有两种铁转运蛋白FPN-1、FPN-2,某些植物如拟南芥(Arabidopsis thaliana)有三种铁转运蛋白(基因、同源物)FPN-1、FPN-2、Mar1。
人类和哺乳动物的铁转运蛋白-1(ferroportin-1,FPN-1)在(成熟的)十二指肠绒毛上皮细胞、肝细胞(肝脏腺上皮细胞)、肝和脾的巨噬细胞、胎盘的合体滋养层细胞、脂肪细胞等细胞中表达,分别分布在相应细胞的基底胞质、基底膜、细胞膜或顶端胞质等部位。
铁转运蛋白(ferroportin,FPN)服务于细胞的铁输出、铁释放,上一篇文章介绍的转铁蛋白(Transferrin,Tf)、转铁蛋白受体(Transferrin receptor,TfR)则服务于细胞的铁输送、铁摄入。转铁蛋白(Tf)向各器官、组织中的细胞运送循环铁,细胞膜上的转铁蛋白受体(TfR)结合、接收转铁蛋白,将转铁蛋白及其携带的铁摄入细胞内。转铁蛋白(Tf)结合、运送的是三价铁离子(Fe3+),而铁转运蛋白(FPN)结合、输出的是二价铁离子(Fe2+)。铁转运蛋白(FPN)释放到细胞外的Fe2+在被转铁蛋白(Tf)结合、输送前将先被氧化为三价铁离子(Fe3+);小肠(主要是十二指肠)从食物中吸收的也是Fe3+,在被铁转运蛋白(FPN)结合并释放到细胞外前,它将被还原为Fe2+。
铁调素(Hepcidin)可与细胞膜上的铁转运蛋白(FPN)结合,介导其内摄并在细胞内降解,铁转运蛋白的降解、水平下调将抑制细胞的铁释放、铁输出,使更多的铁被隔离、保留在铁吸收细胞(小肠上皮细胞)、铁回收细胞(巨噬细胞)、铁储存细胞内(肝细胞)、铁中转细胞(胎盘细胞)等细胞的内部,使释放到血液循环中通过转铁蛋白(Tf)向各组织输送的循环铁减少。即铁调素通过结合、降解、下调铁转运蛋白抑制细胞铁输出,减少循环铁。铁调素和铁转运蛋白/循环铁的关系,有点类似胰岛素和葡萄糖。
由“铁调素”章节的“论文依据二”可知,SARS-CoV-2 Spike蛋白尾部区域与铁调素氨基酸序列相似;由“论文依据三”可知,SARS-CoV-2 Spike蛋白的尾部片断Covidin有铁调素模仿能力,计算机模拟研究表明,Covidin能以高于铁调素的结合亲和力紧密结合铁转运蛋白(FPN)。目前,没有细胞-病毒感染实验验证或否定上述模拟研究结论,也没有相关实验确定Covidin是否可进而导致铁转运蛋白(FPN)降解,是否能够以铁调素的方式干预宿主铁代谢,但“铁调素”章节的多个论文依据(“论文依据四”~“论文依据七”)表明,SARS-CoV-2 Spike-Covidin很可能具备这样的能力。
SARS-CoV-2可能是已论文报告的,唯一一种可结合铁转运蛋白(FPN)的病毒,唯一一种可同时结合铁转运蛋白(FPN)和铁调素的病毒;SARS-CoV-2的Spike蛋白可能是唯一一种可结合铁转运蛋白(FPN)的病毒蛋白,唯一一种可同时结合铁转运蛋白(FPN)和铁调素的病毒蛋白。由上一篇文章可知,SARS-CoV-2的Spike还能结合另一种关键铁代谢因子--转铁蛋白受体(TfR)。我们还将看到SARS-CoV-2更多的铁代谢干预能力。
铁调素与铁转运蛋白(FPN)的结合具有特异性,铁调素可能是已知的唯一一类能够结合铁转运蛋白的天然蛋白或多肽。分子生物学界、医学界对铁调素结合、降解铁转运蛋白的分子机制作过深入研究,设计、合成、优化了多种可结合、降解铁转运蛋白的人工铁调素模拟物。
相关论文一
Minihepcidins are rationally designed small peptides that mimic hepcidin activity in mice and may be useful for the treatment of iron overload
小铁调素是合理设计的小肽,可模拟小鼠铁调素的活性,可能有助于治疗铁过载
https://www.jci.org/articles/view/57693
Published November 1, 2011
论文研究、鉴定了对结合、降解铁转运蛋白(ferroportin,FPN)起关键作用的铁调素中的疏水/芳香残基(hydrophobic/aromatic residues)、半胱氨酸(cysteines)残基和二硫键(disulfide bond),设计、优化、合成了多种长度为7-9个氨基酸的能模拟铁调素,结合、降解铁转运蛋白,降低血清铁的“迷你铁调素”(Minihepcidins)多肽,部分Minihepcidins优于天然hepcidin。
论文指出,铁调素的7-9个N端氨基酸,包括一个硫醇半胱氨酸(thiol cysteine)构成了保持铁调素活性的最小结构。
Guided by this model, we showed that 7–9 N-terminal amino acids of hepcidin, including a single thiol cysteine, comprised the minimal structure that retained hepcidin activity, as shown by the induction of ferroportin degradation in reporter cells.
通过进一步的(基因)修改以提高对蛋白水解的抵抗力、口服生物利用度等等问题后,产生了(多种人为设计、优化的,长度为7-9个氨基酸的)小铁调素(minihepcidins),在对小鼠进行胃肠外或口服给药后,小铁调素的血清铁水平降低效果优于天然铁调素。此外,长期用小铁调素治疗的小鼠的肝铁浓度低于仅用溶剂治疗的小鼠。小铁调素可能有助于治疗铁超载疾病。
Further modifications to increase resistance to proteolysis and oral bioavailability yielded minihepcidins that, after parenteral or oral administration to mice, lowered serum iron levels comparably to those after parenteral native hepcidin. Moreover, liver iron concentrations were lower in mice chronically treated with minihepcidins than those in mice treated with solvent alone. Minihepcidins may be useful for the treatment of iron overload disorders.
笔者没有考察SARS-CoV-2 Spike尾部区域/Covidin片断与某个minihepcidins 氨基酸序列的相似性或关联。
相关论文二
Does Hepcidin Tuning Have a Role among Emerging Treatments for Thalassemia
铁调素调节在地中海贫血的新兴疗法中是否发挥作用?
https://www.mdpi.com/2077-0383/11/17/5119
Published: 30 August 2022
这篇论文的“Hepcidin Mimetics”(铁调素模拟物)小节提到了四类铁调素人工模拟物或人工合成物:LJPC-401、PTG-300,Mini-hepcidins、Cyclic N-Methylated Mini-Hepcidins,前三类人工铁调素设计、开发于疫情前,包括上一论文中的“迷你铁调素”(Mini-hepcidins)。
相关论文三
Hepcidin agonists as therapeutic tools
铁调素激动剂作为治疗工具
https://ashpublications.org/blood/article/131/16/1790/36820/Hepcidin-agonists-as-therapeutic-tools
BLOOD SPOTLIGHT| April 19, 2018
这篇论文设计的小铁调素与前面的minihepcidins 很相似。
论文“Utilizing hepcidin pathway to treat iron overload disorders”(利用铁调素途径治疗铁过载疾病)小节中说:
。。。这些遗传研究促使人们探索其他方法来增加铁调素缺乏的铁超载患者的循环铁调素。 全长铁调素的合成效率相对较低,而且由于肾脏清除速度快,铁调素在循环中的半衰期很短。为了克服这些限制,(其它研究已经)设计了几种分子来模拟铁调素活性或刺激内源性铁调素产生。我们开发了小铁调素,这是一种基于铁调素7-9 N端氨基酸片段的短肽。我们首先表明,hepcidin的这个N末端片段足以在体外诱导FPN-1(ferroportin-1,铁转运蛋白-1)内化和降解。然后,我们对这些肽进行了改造以延长其半衰期和效力,实验证明,给小鼠施用的这些(改造后的)小铁调素肽模拟了内源性铁调素对铁(释放)的限制作用。
These genetic studies prompted the exploration of other approaches to increasing circulating hepcidin in iron-overloaded patients with hepcidin deficiency. Synthesis of full-length hepcidin is relatively inefficient, and the half-life of hepcidin in circulation is short because of rapid renal clearance.36 To overcome these limitations, several molecules have been designed to mimic hepcidin activity or stimulate endogenous hepcidin production.2,37 We developed minihepcidins (MHs), short peptides based on the 7-9 N-terminal amino acid segment of hepcidin. We first showed that this N-terminal segment of hepcidin is sufficient to induce FPN-1 internalization and degradation in vitro.38 We then engineered these peptides to increase their half-life and potency, and demonstrated that administration of MHs to mice mimics the iron-restrictive effect of endogenous hepcidin.
论文“Utilizing hepcidin agonists to treat siderophilic infections”(利用铁调素激动剂治疗嗜铁菌感染)小节还提到:
已经开发了多种其他策略来模拟铁调素活性或增加内源性铁调素的产量。其中包括合成全长人铁调素、另一种基于肽的铁调素模拟物、小分子FPN-1抑制剂、或通过体内靶向和降解Tmprss6信使RNA来对Tmprss6进行药理学抑制,在铁调素缺乏症的临床前模型中(上述方法)均显示出相似的有益效果。。。
Multiple other strategies have been developed to mimic hepcidin activity or increase production of endogenous hepcidin. These include synthetic full-length human hepcidin,45 another peptide-based hepcidin mimetic,46 small molecule FPN-1 inhibitors,47 or pharmacologic inhibition of Tmprss6 by in vivo targeting and degradation of Tmprss6 messenger RNA,48,49 all displaying similar beneficial effects in preclinical models of hepcidin deficiency.
笔者也未考察SARS-CoV-2 Spike尾部区域/Covidin片断与该论文开发的小铁调素肽氨基酸序列的相似、关联性。
(未完待续)





















