本文完整标题:新冠刺突蛋白RBD(受体结合域)决定感染人类能力的五个关键氨基酸(残基),是参照、基于rs3367的关键氨基酸(残基),复用、替代得到的。
本文是对“新冠RBD5个关键氨基酸的实验室选择”一文的结论明确化、叙述简明化。本文基于前文,与之并不冲突,但更简明、清晰、准确,也更具结论价值。
写作本文的目的是指出下述发现、事实,并作出基本的判断:
1。新冠刺突蛋白RBD(受体结合域)决定感染人类能力的5个关键氨基酸(残基),与特殊类SARS冠状病毒rs3367的对应氨基酸之间存在着明显的参照关系,被作为参照对象的病毒rs3367是已知的跨物种传播能力最强的罕见的类SARS冠状病毒。
2。对比新冠与rs3367的RBD五个关键氨基酸:
它们的第五个关键氨基酸相同,均为酪氨酸Y;
它们的第四个关键氨基酸也相同,均为天门冬酰胺N;
它们的第二个关键氨基酸亦相同,均为苯丙胺酸F;
它们的第三、第一个关键氨基酸不同。
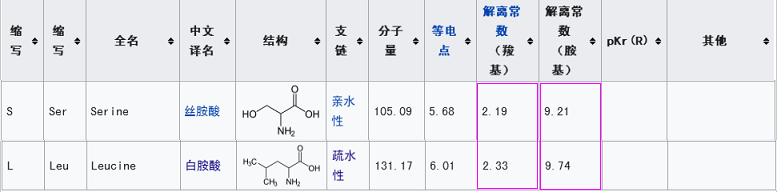
新冠的第三个关键氨基酸是麸酰胺酸Q,rs3367的第三个关键氨基酸是天门冬酰胺N,二者虽不相同,但它们的几个理化属性都非常相似或接近。
新冠第一个关键氨基酸是亮氨酸L(也称白氨酸),rs3367的第一个关键氨基酸是丝氨基酸S,二者不同,但有一定的共性,它们都是不带电荷或电荷中性的氨基酸,同时,它们的解离常数也比较接近。
3。新冠RBD的五个关键氨基酸中,有三个与rs3367相同,即第五、第四、第二关键氨基酸。这样高的重复度,无法用自然、偶然、巧合等说辞来解释。(这或许也意味着,就“自然演化伪装性”而言,新冠其实还只是一个半成品)
4。新冠直接抄袭、复用了rs3367五个关键氨基酸中的三个,替代了另外二个:
参照rs3367第三个关键氨基酸-天门冬酰胺N,以与天门冬酰胺N理化属性非常接近的麸酰胺酸Q为新冠的第三个关键氨基酸;
参照rs3367的第一个关键氨基酸-丝氨基酸S,在一定范围内挑选并实验确定了新冠的第一个关键氨基酸-亮氨酸L。
5。在新冠RBD5个关键氨基酸的设计过程中,可能也参照了Sars-Cov、rsSHC014的关键氨基酸组合及RBD结构。Sars-Cov、rsSHC014、rs3367都是罕见的能够跨物种传播,可感染人特殊冠状病毒。
6。目的明确的关键氨基酸参照设计使新冠继承了rs3367的强大跨物种传播能力,特别是,它的刺突蛋白也能与人类细胞受体ACE2发生强相互作用并良好结合,新冠具有不亚于,甚至明显强于SARS的人体细胞感染能力。
7。新冠刺突蛋白RBD决定人类感染能力的5个关键氨基酸不是随机突变、无目的自然演化产生的,它们是基于明确的设计目标,参照、复用、替代特定病毒rs3367的关键氨基酸,人为确定的。
我要衷心感谢所有关注本文,参与讨论,指出文中错误、不当,予我批评、建议的读者朋友们。
同时,我也非常非常希望,科学、学术界的同仁、朋友们,能够注意到本文,对上述发现、事实、判断进行核查、确认、肯定或予以批驳、指错、纠正,以利于澄清真相,或在此基础上展开更深入的研究。
接下来,我们要从一对姐妹病毒说起。
姐妹病毒:CoVZC45、CoVZXC21是已知的与新冠病毒(SARS-CoV-2)“血缘”关系最接近的两个冠状病毒。类SARS冠状病毒CoVZC45,2017年2月分离自舟山蝙蝠,基因序列2018年1月上传至国际基因库,全名为bat-SL-CoVZC45,GenBank ID为:MG772933.1。它的姐姐类SARS冠状病毒CoVZXC21,2015年7月分离自舟山蝙蝠,与妹妹CoVZC45同一天上传至国际基因库,全名是bat-SL-CoVZXC21。
CoVZC45与新冠(SARS-CoV-2)基因组(基因序列)的相似度是87.5%(我用Blast比照的结果是89.12%),CoVZXC21与SARS-CoV-2的相似度是87.3%。这对姐妹彼此的相似度是97.48%。在绝大多数情况下,有关CoVZC45的内容同样适用于CoVZXC21。
相比之下,SARS-CoV(非典、萨斯)与SARS-CoV-2的相似度只有78.7%,比姐妹病毒低近10个百分点。
Sars-Cov(红)、CoVZC45(蓝)、CoVZXC21(紫)与Sars-Cov-2(2019-nCov)基因序列一致性对照图
RaTG13、Sars-Cov、CoVZC45、WIV1等冠状病毒与Sars-Cov-2(2019-nCov)基因序列一致性对照图。2019-nCov是新冠的早期命名。
注意上图中的WIV1,它就是本文的主人公rs3367(或者说它等价于rs3367)。
最近媒体频频提起的RaTG13不是新冠的近亲。RaTG13与SARS-CoV-2相似度虽然高达96.2%,但它只有基因序列,没有病毒毒株实证,它的基因序列是所谓“分析得出”的,其实很可能就是“创作”出来的,它没有严肃的证据价值和学术讨论价值;而且,就算它真实存在,它与新冠也没有时间进化关系,新冠不可能由它进化而来。关于RaTG13与新冠的进化无关性,南方医科大学2020年2月20日的论文“新型冠状病毒SARS-CoV-2的变异和进化分析”已经给出了明确说明。该论文的一个地址:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7086142/
(顺带提一下,我认为,最近媒体高调宣扬RaTG13的作法有有意误导的嫌疑,这等于转移视线,客观上起到了掩护真正秘密的作用。)
如果新冠是自然进化产生的,它最可能是由CoVZC45或它的姐姐进化而来的,这也是新冠进化最近、最快捷的途径。但是这对姐妹病毒与新冠之间,仍然横着一道进化的天堑。观察前面两个插图,可以注意到,除RaTG13外,图中其它病毒与新冠在S蛋白位置都存在着鸿沟般的巨大(一致性)落差。姐妹病毒要进化为新冠,必须完成诸多特定突变,消除它们与新冠在S蛋白上的巨大差异。CoVZC45与新冠其它蛋白的相似度都不低于94%,但二者S1蛋白(S蛋白的前半部分)的相似度却猛降为69%。这决定了从CoVZC45到新冠的“演变”,是一个极不均衡、极为罕见、非常非常不自然的“自然进化”过程。更不可思议且又旷绝古今的是,这一本应漫长修远、艰辛无比的“自然进化”过程,居然只用了几年的时间就完成了(如果从姐妹病毒被发现的前后算起)。
自然界的冠状病毒约有一百种,绝大多数天然冠状病毒不能进入人体细胞,无法感染人类。大自然设置了冠状病毒的传播屏障:将S1蛋白决定宿主感染能力的重要部位设置为高度保守区域,这些部位的氨基酸通常不会发生突变。S1蛋白重要部位的稳定性使绝大多数冠状病毒在漫长的岁月里始终无法跨越S1蛋白的进化天堑,它们只能感染固定的动物宿主,难以跨物种传播,感染人类。
冠状病毒能否进入宿主细胞,感染宿主,取决于它有没有打开宿主细胞(锁)的“钥匙”。如果有匹配的细胞“钥匙”,它就能与宿主细胞表面的相关受体(相当于细胞锁)结合,继而进入宿主细胞。冠状病毒的细胞钥匙就是它的S蛋白,即Spike蛋白,或叫刺突蛋白。刺突蛋白包括相连的两个部分(两个亚基),最外部的是S1蛋白,S1蛋白与病毒包膜之间的是S2蛋白。S2蛋白也叫膜融合亚基(参与新冠病毒与细胞的膜融合),它相当于钥匙的手柄部分,S1蛋白是受体结合亚基,它负责与细胞表面的受体结合,相当于钥匙的齿面部分。S1蛋白中有一个区域叫做受体结合域(Receptor Binding Domain),简称RBD,RBD是S1蛋白与细胞受体发生接触的部分,它相当于齿面外侧的钥齿部位。RBD中有14个氨基酸与宿主细胞受体ACE2直接发生接触,这14个氨基酸中,至关重要的是五个,它们决定刺突蛋白能否与ACE2结合,这五个关键氨基酸就是冠状病毒打开宿主细胞的关键钥齿。
注:ACE2,即Angiotensin Converting Enzyme2,血管紧张素转换酶2,是细胞表面的一个膜蛋白,广泛存在于脊椎动物的呼吸、消化、血液、泌尿、生殖、视觉等系统的器官、组织内。ACE2可介导与之发生结合的病毒进入它所附着的细胞内部。ACE2也是肾素-血管紧张素系统(RAS)中的一个关键酶;hACE2,即human ACE2,人体细胞ACE2受体。
S1蛋白与宿主细胞受体(如ACE2)结合成功后,病毒可进而通过“胞吞”(Sars-Cov的方式)或“膜融合”(Sars-Cov-2的更高效的方式)两种方式之一进入宿主细胞。
可感染人类,并产生疾病症状的冠状病毒已知有7种,其中包括SARS(Sars-Cov)和新冠(Sars-Cov-2)。除这7种病毒外,还有两个很特别的冠状病毒:rsSHC014和rs3367,它们也能与hACE2(human ACE2)结合,进入人体细胞,但它们不会使人发病,且对人体无害。
RsSHC014,也称作SHC014-Cov或SHC014病毒,GenBank ID为: KC881005.1。
rs3367,也叫WIV1病毒(SL-CoV-WIV1),GenBank ID为: KC881006.1。它在本文第二个贴图中出现过。
RsSHC014、rs3367都搜集自云南昆明中华菊头蝠(亦称中华马蹄蝠)的肠道与粪便样本,其病毒株分离获得时间同为2011年4月,它们的基因序列上传至国际基因库的时间同为2013年4月。
RsSHC014、rs3367与SARS-CoV的基因组相似度均为95%,被认为极可能是SARS-CoV的自然进化来源。rs3367的RBD(Receptor Binding Domain,受体结合域)与SARS-CoV接近程度相当高,在RBD与宿主受体ACE2直接接触的14个位点中,rs3367与SARS-CoV在11个位点上氨基酸相同,虽然另有三个位点氨基酸不同,但rs3367仍能与hACE2良好结合并进入人体细胞。相比之下,在RBD14个直接接触位点中,RsSHC014与SARS-CoV在7个位点上氨基酸不同,但2015年秋拉尔夫·S·巴里克、Vineet D Menachery、石正丽、葛行义等人的著名实验证明,虽然与Sars-Cov有一半RBD接触位点不同,但RsSHC014的刺突蛋白仍然能与hACE2良好结合。这也说明,可与hACE2良好结合的关键氨基酸组合是不唯一的。
相比RsSHC014,rs3367更非同寻常,它具备强大的跨物种传播能力,它能感染的动物包括(但不限于):人类、果子狸、貉、恒河猴、雪貂、水鼬、猫、蝙蝠、老鼠。
对普通民众来说,rs3367和RsSHC014是两个陌生的名字,但在冠状病毒研究领域,它们确非无名之辈,在病毒跨物种传播研究领域,它们更是极为重要的研究对象。它们的重要性主要在于其S(Spike)蛋白,即刺突蛋白。对它们的研究在2016年春之前就已经相当深入,并已取得了多个重大成果。我要列举几个与rs3367或RsSHC014紧密相关的研究工作。
2013年10月, 石正丽、Peter Daszak、葛行义等人发表了一篇重要论文:”Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor”,论文地址:https://www.nature.com/articles/nature12711
该论文对rs3367(实验使用的SL-CoV-WIV1与rs3367毒株有99.9%的序列一致性,本文将它们视作同一种病毒)进行了深入研究,证实了rs3367或WIV1的跨物种传播能力:它可与细胞的ACE2受体结合,并以此进入人类、果子狸、中华马蹄蝠的细胞。该论文证实了,自然界中存在与Sars-Cov一样可跨物种传播的类Sars冠状病毒,它被认为是Sars-Cov起源于自然界的有力证明。
2015年11月,Ralph S Baric、Vineet D Menachery、石正丽、葛行义等人发表了著名的病毒合成实验论文,参与论文的包括美国、中国、瑞士三国的大学、研究机构、政府部门。论文地址:
https://www.nature.com/articles/nm.3985
这次研究最重要的实验成果是,用RsSHC014的刺突蛋白和Sars-Cov-MA15(一种实验室多次传代培育的可感染小鼠并使其致病的Sars-Cov病毒变异体)的病毒主干合成了一种人工改造病毒SHC014-MA15,这一实验室改造的嵌合病毒能使人、鼠发病,并可使实验小鼠致死。这次实验为改造致病性病毒开创了道路。SHC014-MA15相当于Sars-Cov-2的一个早期原型,它们的基本原理是相同的,区别在于,Sars-Cov-2比SHC014-MA15技术上更复杂,功能更丰富、强大,它还有一定的“自然进化”伪装性。
2016年3月,Ralph S. Baric、Vineet D. Menachery等人又发表了一篇研究rs3367(WIV1)的论文。论文地址:https://www.pnas.org/content/113/11/3048
这一次,研究者们用rs3367(WIV1)的刺突蛋白与Sars-Cov-MA15合成了另外一种嵌合病毒WIV1-MA15。实验证明,WIV1-MA15能够感染人体细胞,它在呼吸道、体内大量复制并使人发病,但症状不及Sars严重。实验者还再一次研究了嵌合病毒对人类的致病能力,以及对该病毒应用抗体治疗的效果。2015年它们对SHC014-MA15也做过相关研究。这是Ralph S. Baric、Vineet D. Menachery等人再一次使用嵌合方式改造出人类致病病毒并进行研究。
上述两篇论文的第一作者都是Vineet D. Menachery,通讯作者都是Ralph S. Baric。二人都是北卡罗来纳大学教堂山分校的病毒学家、生物医药学家,同时,他们也都是瑞德西韦(Remdesivir)的研发人员。
我们可以从相关研究中得到一些启示。实验室改造病毒,使之跨物种传播的首要环节是换钥匙或配钥匙,也就是把不能打开人体细胞(即不能与人类细胞受体结合)的刺突蛋白(如CoVZC45或CoVZXC21等绝大多数冠状病毒的刺突蛋白),替换或改造成可打开人体细胞的刺突蛋白(如Sars-Cov、rs3367、rsSHC014的刺突蛋白)。要得到一把好用的“钥匙”,可以把钥匙整个换掉,也可以只换齿面或只修磨钥齿。可以只处理关键的几个钥齿,也就是改造刺突蛋白RBD(Receptor Binding Domain)中的五个关键氨基酸。
作了很长的铺垫,现在可以说新冠、rs3367二者5个关键氨基酸之间的关系了,这其中需要涉及姐妹病毒CoVZC45。
新冠刺突蛋白RBD的五个关键氨基酸依次为:
亮胺酸L(451),苯丙胺酸F(482),麸酰胺酸Q(489),天门冬酰胺N(497)和酪胺酸Y(501)。
氨基酸名称、缩写字母后的数字是该氨基酸在刺突蛋白的氨基酸序列中的序号。
上述关键氨基酸序号是基于长度为1269的新冠刺突蛋白(简记为Spike_1269)而言的,如果选用长度为1273的新冠刺突蛋白(简记为Spike_1273),那么五个关键氨基酸依次为:
亮胺酸L(455),苯丙胺酸F(486),麸酰胺酸Q(493),天门冬酰胺N(501),酪胺酸Y(505)。
Spike_1269与Spike_1273的关键氨基酸相同,但位置序号相差4,这是它们的氨基酸序列长度相差4造成的。在Spike_1269氨基酸序列的141、142两个位点之间插入四个氨基酸LGVY,就得到了Spike_1273,二者其它对应位点的氨基酸完全相同。使用Spike_1269或Spike_1273,对本文来说是等价的。
CoVZC45对应位置上的五个关键氨基酸为:
丝氨酸S(446),空缺,丝氨酸S(470),缬胺酸V(478),酪氨酸Y(482)。
CoVZC45、Sars-Cov-2关键氨基酸的对照情况如下图:

注:CoVZC45的Spike蛋白NCBI地址
https://www.ncbi.nlm.nih.gov/protein/AVP78031.1
不难发现,CoVZC45、新冠二者只有第五个关键氨基酸相同,同为酪氨酸Y,而且,CoVZC45第二个关键钥齿氨基酸缺失!如果CoVZC45要演化为新冠,它必须:
在第二个关键位点处突变增生出一个苯丙胺酸F;
将第一个关键氨基酸-丝氨酸S(446)突变、演化为亮胺酸L;
将第三个关键氨基酸-丝氨酸S(470)突变、演化为麸酰胺酸Q;
将第四个关键氨基酸-缬胺酸V(478)突变、演化为天门冬酰胺N;
保持第五个关键氨基酸-酪胺酸Y不变。
另外,还可以注意到,两病毒的关键氨基酸有一定的序号错位,这是CoVZC45的刺突蛋白氨基酸序列比Sars-Cov-2短造成的,这需要CoVZC45变异增生出一定数量的氨基酸,消除氨基酸序列长度差异及氨基酸序号错位,这无疑将加大CoVZC45自然演化为新冠的难度。
下面是rs3367的五个关键氨基酸:
丝氨酸S(443),苯丙胺酸F(473),天门冬酰胺N(480),天门冬酰胺N(488),酪胺酸Y(492)。
注:
rs3367的Spike蛋白NCBI地址
https://www.ncbi.nlm.nih.gov/protein/AGZ48818.1
将三个病毒的关键氨基酸汇总于下表。
从上表容易观察到:
1。新冠与rs3367的第五个关键氨基酸相同,都是酪胺酸Y;
2。新冠与rs3367的第四个关键氨基酸也相同,都是天门冬酰胺N;
3。新冠与rs3367的第二个关键氨基酸亦相同,都是苯丙胺酸F;
即,新冠与rs3367的第五、第四、第二个关键氨基酸都相同。这两个病毒在RBD五个关键位点中的三个位点上氨基酸相同,这是极不正常的。
它们之间的关联还不仅如此。
新冠的第三个关键氨基酸是麸酰胺酸Q,rs3367的第三个关键氨基酸是天门冬酰胺N,二者虽不相同,但它们的几个理化属性都“很巧合地”非常相似或接近。

新冠第一个关键氨基酸是亮氨酸L(白氨酸),rs3367的第一个关键氨基酸是丝氨酸S,二者亦不同。这两个氨基酸的相似度虽不及第三个关键位点的情况,但它们仍有一些共性:二者都是不带电荷或电荷中性的氨基酸;二者的解离常数也比较接近。

在替代rs3367的第一个关键氨基酸-丝氨酸S时,替代候选不仅需要与丝氨酸S有一定的相似性,而且,它还要适应、协调第三个位点上从天门冬酰胺N=>麸酰胺酸Q的替代,使这二个位置上的替代整体上维持RBD原有的空间结构,以及静电、范德华力等属性。因此,新冠的第一个关键氨基酸-亮氨酸L不便机械参照,它需要在一定范围内挑选、适配,并通过实验予以确定。第一关键氨基酸的选拔标准可能包括:
1。与丝氨酸S的电荷、酸碱属性相似,解离常数相对接近;
2。与新的第三关键氨基酸-麸酰胺酸Q,及其它三个复用的关键氨基酸的组合能维持RBD与hACE2的良好结合能力。
另外,新冠的设计者应该掌握着不为我所知的论文成果,并拥有相关经验积累,他们将籍此从一个精简的候选范围内快捷地确定出亮氨酸L。
如果新冠是由CoVZC45自然演化产生的,那么,CoVZC45在五个关键氨基酸位点的演化情况为:
在第二个关键位点突变增生出与rs3367第一位点相同的苯丙胺酸F;
第四个关键位点的缬胺酸V(478)突变、演化为与rs3367第四位点相同的天门冬酰胺N;
第三个关键位点的丝氨酸S(470)突变、演化为与rs3367第三位点的天门冬酰胺N理化属性非常相似的麸酰胺酸Q;
第一个关键位点的丝氨酸S(446)突变、演化为亮胺酸L;
保持第五个关键位点的酪胺酸Y(482)不变(但它的位置序号将变为501或505,它的前面将有若干新增生的氨基酸)。
上述四项突变、进化都发生在刺突蛋白的高度保守区域,通常,高度保守区域内的氨基酸是很少发生突变的。不论其它位置的突变,仅四个关键氨基酸的定向精准突变,及其位置序号的准确迁移,就是几十年、几百年,甚至几千年。。。都无法完成的。
此外,舟山群岛冠状病毒CoVZC45,怎么偏巧就进化出了和云南冠状病毒rs3367相同或高度相似的关键氨基酸?CoVZC45的进化模仿目标,为什么恰好是已知跨物种传播能力最强大的病毒rs3367?为什么也恰巧是部分病毒学家反复研究、实验过,对其了如指掌的一个特殊病毒?该如何解释这种种巧合?这样偶然又偶然的事,自然发生的几率有多大呢?
新冠决定人类感染能力的五个关键氨基酸不是随机突变、无目的自然演化产生的,它们是参照极为特殊的病毒rs3367,通过氨基酸复用、定向挑选替代,hACE2结合实验等过程选定的。

再简单概括一下新冠五个关键氨基酸可能的确定过程:
1。以rs3367的五个关键氨基酸为新冠关键氨基酸的初始原型,并复用、保留第五、第四、第二个关键氨基酸;
2。将第三个位点的天门冬酰胺N替代为理化属性非常相似的麸酰胺酸Q;
3。在四个位点关键氨基酸已确定的前提下,尝试替代第一关键位点的丝氨酸S。先通过相关条件(如电荷、酸碱属性、解离常数的接近度)确定候选范围,再试验代入候选者的RBD与hACE2的结合能力。实验发现,以亮胺酸L替代丝氨酸S后,RBD仍保持了与hACE2的良好结合能力,以亮胺酸L为新冠的第一关键氨基酸。
至此,新冠的五个关键氨基酸都已确定。
以上过程与实际确定过程之间肯定存在或多或少的不同,但这些细节上的出入并不重要。
关于五个关键氨基酸、RBD结构、RBD与hACE2的结合效果,新冠与Sars-Cov的对照情况如下:
1。新冠与Sars-Cov的五个关键钥齿氨基酸只有第五个相同,其它四个都不相同,但这四对相异氨基酸每一对的疏水性和静电极性都非常相似;
2。虽然有四个关键氨基酸不同,但两者RBD(受体结合域)的3-D结构几乎没有明显差异,或者说,两者RBD的空间形态高度同构;在与人类受体的接触界面上,两个RBD结构体的范德华力(一种分子间的电性引力)和静电作用效果非常相似;
3。与SARS一样,新冠的RBD也能与人类细胞受体ACE2发生强相互作用并良好结合,新冠具有不亚于SARS的人体细胞感染能力。
SARS-Cov与Sars-Cov-2刺突蛋白关键氨基酸异同,及空间结构示意图
新冠与Sars-Cov的上述对照结果,很可能也适用于新冠与rs3367,这一猜测有待后续的研究验证。
介绍一下支撑新冠、Sars-Cov上述对比结果的两篇相关论文。
论文一。2020年1月21日,来自中国科学院上海巴斯德研究所等单位的徐心恬、陈萍、王靖方等学者在SCIENCE CHINA Life Sciences(《中国科学:生命科学》)上发表了一篇论文,题为“源于武汉爆发的新型冠状病毒的进化及其棘突蛋白对人类传播风险的建模”(Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission)。论文地址为:
https://link.springer.com/content/pdf/10.1007/s11427-020-1637-5.pdf
论文指出:
a)尽管新冠与SARS-CoV二者S蛋白的总体同源性较低,但二者的RBD区域却有较高的同源性;
b)令我们惊讶的是,尽管替换了五个重要的界面氨基酸残基中的四个,但新冠仍与人体ACE2有着显著的结合亲和力;
c)进一步观察发现,新冠的S蛋白和SARS-CoV的S蛋白在RBD域具有几乎相同的三维结构,在相互作用界面上保持了相似的范德华力和静电性质。
论文二。2020年2月19日,美国德克萨斯大学奥斯汀分校Jason S McLellan团队,及国家过敏和传染病研究所的研究人员在Science杂志上联合发表了题为“Cryo-EM Structure of the 2019-nCoV Spike in the Prefusion Conformation”的论文。论文地址为:
https://science.sciencemag.org/content/367/6483/1260
论文指出:
a) 2019-nCoV与SARS-CoV的RBD存在一定的构象差异,但当按某一角度对齐时,二者就呈现出较高程度的结构同源性。
b) 两种病毒的S1蛋白与ACE2的复合体非常相似;
c) 2019-nCoV的S1蛋白与ACE2的结合亲和力是Sars-Cov的10-20倍。
最后,我们将刺突蛋白RBD关键氨基酸的确定过程延展,设想一下新冠实验室改造的可能流程:
将CoVZC45的主干与Sar-Cov(或rs3367、rsSHC014)的(扩展)RBD嵌合,得到新冠的原型病毒。原型病毒已具备感染人的能力;
参照rs3367、rsSHC014的关键钥齿氨基酸,修改原型病毒的关键钥齿氨基酸,确定新冠最终的五个关键钥齿氨基酸;
参照rs3367、rsSHC014、Sars-Cov等病毒的RBD及S1蛋白,编辑新冠RBD及S1蛋白的其它位置,模糊嵌合操作痕迹;
参照Sar-Cov、HIV-1、埃博拉、HEV71等病毒,进行其它功能增益(Gain-of-Function)改造,包括复制能力、扩散能力增强,设计、实现免疫破坏力、抗免疫能力、免疫干扰能力等等;
进行其它基因编辑及实验室痕迹模糊化处理。
关于新冠的功能增益,及为实现各项功能增益而引入的相应实验室特征“指纹”,我去年的一篇文章“新冠君,你额头的Lab金印洗得掉么?”中的第3~第6部分中有一些总结,有兴趣的读者可参考。
(正文完)
相关文章:
新冠君,你额头的Lab金印洗得掉么?
深入分析Lyons-Weiler“新冠来自实验室”一说
实验室合成、编辑SARS-CoV-2简明教程
SARS-CoV-2(新冠)是实验室生成的

















