接續:誰設計、製造了新冠病毒(三 上)
上篇文章指出:新冠病毒來自實驗室,它集多種冠狀病毒、非冠狀病毒結構、特性於一身,是廣為借鑑、精心設計的跨科屬病毒集大成者;新冠病毒出自長期從事功能增益研究的病毒學家、實驗室之手。
上篇文章還指出:
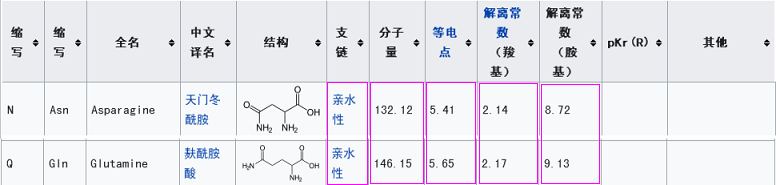
1、新冠病毒決定ACE2結合能力的RBD(Receptor Binding Domain,受體結合域)關鍵氨基酸,與蝙蝠冠狀病毒rs3367(WIV1)的RBD關鍵氨基酸高度關聯:新冠病毒5個RBD關鍵氨基酸中的三個與rs3367(WIV1)的對應RBD關鍵氨基酸相同(第二、第四、第五RBD關鍵氨基酸),此外,二者還有一對RBD關鍵氨基酸理化屬性高度接近(第三RBD關鍵氨基酸)。
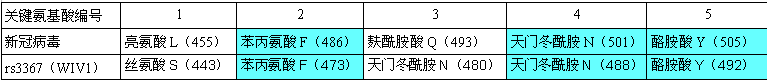
2、新冠RBD與rs3367(WIV1)RBD空間結構非常相似(可能高度同構),二者RBD-ACE2結合模型的空間構象也非常相似(可能高度同構)。
3、新冠、rs3367(WIV1)都有非常強大的人體細胞進入、感染能力,它們的刺突蛋白都非常適合結合hACE2(human ACE2)。
4、新冠、rs3367(WIV1)都有非常強大的跨物種感染能力和廣泛的宿主範圍。
5、新冠、rs3367(WIV1)都有泛器官、泛組織感染能力。
6、新冠與rs3367(WIV1)的上述關聯、“巧合”不是自然演化產生的,它們是人為設計的結果,有人借鑑rs3367(WIV1)的RBD關鍵氨基酸,通過氨基酸復用、替代,設計出了結構、功能高度相似、高度等價的新冠病毒RBD關鍵氨基酸。
借鑑rs3367(WIV1),設計出新冠病毒RBD關鍵氨基酸的,是哪個病毒學家,哪個實驗室?
本系列首篇文章
誰設計、製造了新冠病毒(一) (即“新冠病毒與拉爾夫·巴里克的不解之緣(一)”)
及另一篇文章
誰設計、製造了新冠病毒(二 下)
分別指出,新冠病毒逆轉錄自身RNA為cDNA(RNA的互補DNA),並將其整合到人體被感染細胞DNA中的特性,及新冠病毒S1/S2處的“RRAR”弗林(furin)酶切位點結構,這兩項人為設計的重大嫌疑人,都是北卡羅來納大學教堂山分校微生物學和免疫學院流行病學系教授、冠狀病毒頂級研究權威、冠狀病毒“合成之父”,冠狀病毒功能增益改造狂人,現美國國家科學院院士拉爾夫·S·巴里克(Ralph S. Baric)。
新冠病毒逆轉錄RNA-DNA整合特性,新冠病毒furin酶切位點結構,與拉爾夫·S·巴里克論文內容、發明內容、項目內容的關聯,沒準都是偶然的巧合,新冠病毒的RBD關鍵氨基酸與Ralph S. Baric應該不會再有密切關聯了。
有個著名病毒學家,他及他領導的科學團隊:
1、對冠狀病毒刺突蛋白、RBD、RBD關鍵氨基酸,對它們與不同物種ACE2,特別是與hACE2的作用機制研究得極為精深、透徹;
2、有着豐富的冠狀病毒功能增益改造經驗(10多年),豐富的冠狀病毒合成、改造經驗(約20年,2000年就發明了基於基因序列無痕跡合成、改造冠狀病毒的反向遺傳平台);
3、曾以不能感染人類的宿主單一的動物冠狀病毒(果子狸冠狀病毒)刺突蛋白為原材料,通過RBD關鍵氨基酸的替代改造、培育變異,改造、培育出了有人類感染、致病能力,可跨物種感染、傳播的冠狀病毒(2007年);
4、多次研究WIV1(rs3367),對其結構、特性,包括RBD關鍵氨基酸,hACE2結合能力,人體細胞感染能力瞭如指掌;
5、曾以WIV1的刺突蛋白為功能增益改造的原材料,製造出了極易結合hACE2,人體細胞感染能力極強的高危病毒(WIV1-MA15,2016年)。
這個對rs3367(WIV1),對RBD關鍵氨基酸都做過深入研究的人是誰呢?拉爾夫·S·巴里克,拉爾夫·S·巴里克是唯一一個同時符合五項描述的(不計括號內的補充描述)病毒學家。
與拉爾夫·巴里克存在重大關聯的新冠病毒人為設計特徵不只上述三組:
逆轉錄RNA-DNA整合特性(逆轉錄是拉爾夫·S·巴里克發明的反向遺傳平台的最基本技術,也是使用反向遺傳平台合成冠狀病毒的必要步驟)、
S1/S2處的furin酶切位點(在2018年初美國國防部高級研究計劃局啟動,彼得·達薩克-生態健康聯盟代為組織的defuse項目中,拉爾夫·S·巴里克負責刺突蛋白的反向遺傳工程改造,其中一項改造內容是在蝙蝠冠狀病毒刺突蛋白中插入furin酶切位點)、
RBD關鍵氨基酸,稍後的“論文A-2”部分還將指出第四組極為“巧合”的關聯:2016年3月拉爾夫·巴里克團隊PNAS(美國國家科學院院刊)論文中展望、預測的刺突蛋白RBD外區域的三項改造成效,在三年後出現的新冠病毒中全都神奇地實現了!
新冠病毒與拉爾夫·巴里克的論文內容、發明內容、項目內容間還存在其它結構、特性的可疑關聯、“巧合”,本文不繼續展開了。
我認為,拉爾夫·巴里克就是新冠病毒的核心設計者,拉爾夫·巴里克(團隊)不是新冠病毒核心設計者的可能性微乎其微。
(補充說明一下,新冠病毒的結構、特性可能並非全部出自拉爾夫·巴里克一人(一支團隊)之手,新冠病毒可能是跨實驗室設計、改造的產物。拉爾夫·巴里克曾將新冠病毒原型共享給其它實驗室,該實驗室可能對新冠病毒原型做過二次改造。)
拉爾夫·巴里克對功能增益改造(gain-of-function)研究狂熱而執着。奧巴馬禁令(即“流感、SARS、MERS相關的危險病原體功能增益研究暫停令”,奧巴馬政府2014年10月17日頒布)頒布後,拉爾夫·巴里克大為不滿,他給NIH(National Institute of Health,美國國立衛生研究院,當時院長為弗朗西斯·柯林斯(Francis S. Collins))寫了一封長信,稱暫停令將嚴重影響冠狀病毒研究,如果未來再爆發疫情,科學家將不能及時應變,迅速控制疫情。他要求NIH批准他繼續開展兩項SARS相關的功能增益研究並得到了NIH的特批(奧巴馬禁令中有特批的條款)。完成了這兩項研究後,拉爾夫·巴里克團隊先後發表了2015年11月9日的Nature Medicine論文和2016年3月14日的PNAS論文,這兩篇論文就是稍後將介紹的論文A-1和論文A-2。
功能增益研究打着模擬、預測冠狀病毒自然突變,防患於未然的旗號,聽上去冠冕堂皇;拉爾夫·巴里克(團隊)的眾多論文其實是在探索:
如何改變冠狀病毒的感染嗜性和宿主對象,如何將不能感染人類的動物來源的冠狀病毒改造為可感染人類的冠狀病毒;
如何將不會使人發病的動物來源的冠狀病毒(少數蝙蝠冠狀病毒有人體細胞進入、感染能力,但已知的所有蝙蝠冠狀病毒都不會使人體產生臨床疾病症狀)改造為有人類致病能力的冠狀病毒;
如何改變、擴大冠狀病毒的宿主範圍,如何將宿主單一的動物來源的冠狀病毒改造為可跨物種感染、傳播的冠狀病毒;
一句話,拉爾夫·巴里克在長期研究、探索改變、增強冠狀病毒感染、致病、傳播能力的技術。
功能增益改造研究不能防患於未然,它帶來的不是人類的安全,而是人為災難。功能增益研究可以隨心所欲地改造病毒基因,輕易突破、跨越大自然設置的病毒感染物種隔離壁壘,輕鬆揭掉潘朵拉災難魔盒上的封印。與病毒感染、致病、傳播能力有關的保守基因的關鍵突變,在自然條件下極難發生,但是,自然條件下數十萬年、數百萬年、數千萬年。。。都不會發生的基因改變,在拉爾夫·巴里克這樣的功能增益改造高手的實驗室中,幾天、甚至若干小時就可以製造出來了。
即使面對着懸崖,即使聲音無比微弱,即使難得迴響,我也要盡力喊出來。我們只有被欺瞞、被愚弄的命嗎?
下面介紹拉爾夫·巴里克研究rs3367(WIV1)、RBD 關鍵氨基酸的一些論文實例。
Ralph S. Baric對WIV1(rs3367)的研究
Ralph S. Baric對rs3367(WIV1)非常關注,2015年到2018年四年間,其團隊先後發表了四篇與WIV1有關的論文,在其中兩篇論文中,WIV1是病毒主角,論文的專門研究對象。
論文A-1
2015年11月9日,Ralph S. Baric領導的團隊在《自然醫學》(Nature Medicine)雜誌發表了一篇現在廣為人知的冠狀病毒嵌合改造論文:A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence(一個類似SARS的蝙蝠冠狀病毒群顯示了產生人類流行疫情的潛力)
https://www.nature.com/articles/nm.3985
論文將蝙蝠冠狀病毒SHC014(也叫rsSHC014)的刺突蛋白與SARS-CoV MA15的骨架嵌合,製造出了一種高度危險的實驗室病毒SHC014-MA15。嵌合病毒SHC014-MA15具有跨物種感染能力,能強烈感染Vero E6細胞(非洲綠猴腎細胞系細胞)和HAE細胞(human airway epithelium cells,人類氣道上皮細胞),它在這兩種細胞中的複製滴度(大致相當於複製濃度)與SARS流行病毒株相當;SHC014-MA15毒性很強,能使實驗小鼠體重大幅下降並死亡;SARS單克隆抗體和SARS疫苗都不能有效治療SHC014-MA15的感染。
SARS-CoV MA15是Ralph S. Baric等人在實驗室小鼠體內反覆傳代培育出的SARS病毒小鼠適應性變異體,對小鼠有極強的毒性和100%的致死力。原生的人類流行SARS病毒對人類致病能力很強,但對小鼠致病能力很弱。
WIV1在論文中是病毒主角SHC014的對照病毒(SHC014、rs3367、WIV1都發現於雲南同一山洞)。論文指出:
在決定ACE2結合能力、細胞進入能力、宿主範圍的5個RBD關鍵氨基酸(殘基)中,WIV1雖然有三個關鍵氨基酸與SARS不同(二者第3、5關鍵氨基酸相同,第1、2、4關鍵氨基酸不同,見下圖),但它的刺突蛋白仍能結合hACE2,WIV1和SARS一樣,也具有人體細胞進入(感染)能力。
註:WIV1具有人體細胞進入、感染能力,是武漢所2013年10月Nature論文(https://www.nature.com/articles/nature12711)的研究結論,論文A-1引用了這一結論。2013年武漢所論文的核心實驗就是證明WIV1具有人體細胞進入、感染能力。
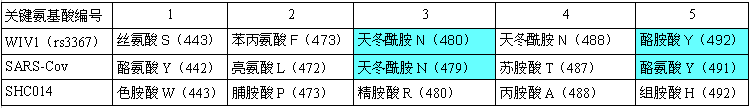
SARS、WIV1、SHC014 RBD關鍵氨基酸對照表
論文隨後把目光轉向SHC014,論文指出,相比WIV1,SHC014與SARS的RBD關鍵氨基酸差異更大,SHC014的RBD關鍵氨基酸無一與SARS 相同,但是,仍不能斷言其刺突蛋白沒有hACE2結合能力。論文用SHC014的刺突蛋白構建嵌合病毒SHC014-MA15的首要目的,就是用SHC014-MA15來實驗確定SHC014刺突蛋白的hACE2結合能力。
論文A-1經常被人張冠李戴,說成是石正麗團隊發表的論文。關於論文主創、作者,及石正麗團隊成員有否參加相關研究,下文“錯誤一”章節中有細緻的說明:
改造病毒問題兼批駁王文清新冠溯源文章
論文A-2
2016年3月14日,Ralph
S. Baric領導的團隊在PNAS(美國國家科學院院刊)上發表了另一篇重要論文:SARS-like WIV1-CoV poised for
human emergence(類SARS冠狀病毒WIV1-CoV對人類有潛在威脅)
https://www.pnas.org/content/113/11/3048
這是一篇專門研究WIV1的論文,上篇文章也提到了該論文。
論文用反向遺傳平台合成了WIV1的克隆,稱之為WIV1-CoV;同時用WIV1的刺突蛋白與SARS-CoV MA15的骨架合成了嵌合病毒WIV1-MA15。
體外細胞實驗證明,和論文A-1中的SHC014-MA15一樣,WIV1-MA15也能強烈感染靈長類動物的Vero E6細胞(非洲綠猴腎細胞)和人氣道上皮細胞(HAE細胞),它在這兩種細胞中的複製滴度也與SARS-CoV流行病毒株相當。
小鼠體內實驗證明,WIV1-MA15、WIV-CoV能感染實驗小鼠,在小鼠氣道和肺中有效複製,但它們在小鼠肺中的複製滴度比之小鼠適應性變異體SARS-CoV MA15低10~100倍;它們對小鼠的致病力都比較弱,只能使年輕小鼠(10周齡)產生較輕症狀,不會使其體重顯著下降(超過10%),更不會使其致死。
但是,當感染對象由普通實驗小鼠換成表達hACE2(human ACE2)的轉基因實驗小鼠(其肺、腦、肝、腎和胃腸道等部位的mACE2被轉基因為hACE2)後,WIV1-MA15和WIV-CoV的感染、複製、致病能力大大增強。相比普通小鼠,WIV1-MA15、WIV1-CoV在轉基因小鼠肺中的複製滴度提高了100倍;部分10-20周齡的被感染轉基因小鼠體重減輕超過10%;兩種病毒可使轉基因小鼠致死,它們在轉基因小鼠大腦中的複製更強勁(與肺中相比),使部分轉基因小鼠患上了致命的腦炎。
轉基因小鼠體內感染實驗表明,hACE2是WIV1刺突蛋白的極佳結合對象;如果要構造具有強大人體細胞感染能力的冠狀病毒,那麼WIV1的刺突蛋白、RBD、RBD關鍵氨基酸是極佳的原材料、極佳的參照物。
論文Discussion部分指出:冠狀病毒刺突蛋白RBD外區域的變化,如S2亞基的某些變化,S1亞基RBD外區域的某些變化(RBD是S1亞基的一部分),有可能增強刺突蛋白與宿主蛋白酶(ACE2受體就是一種宿主蛋白酶)作用的靶向性(可理解為針對性、目的性),增進刺突蛋白的切割(即酶切)特性,增進刺突蛋白的擴展性。這實際上指出了對刺突蛋白RBD外區域進行改造可能取得的三項收效,令人難以置信的是,論文展望、預測的這三項RBD外區域改造成效,在3年又8個月後出現的新冠病毒中,全都神奇地實現了!詳情請參閱:
科學瘋子設計的病毒集大成者(二)
Ralph S. Baric團隊是唯一一支將WIV1(rs3367)用於功能增益改造的科學團隊,是唯一一支以WIV1(rs3367)為原材料改造出人類致病病毒的科學團隊。
論文A-1、A-2,即Ralph S. Baric團隊2015年11月以SHC014為病毒主角的nature medicine論文,2016年3月以WIV1為病毒主角的PNAS論文都發表於奧巴馬禁令生效期間,兩篇論文對應的兩項SARS相關的功能增益研究(都以SARS小鼠適應性變異體SARS-CoV MA15為嵌合病毒的骨架)都在NIH的特批下得以繼續實施、完成並發表論文。2017年12月19日,川普政府撤銷了奧巴馬暫停令,全面重啟了美國危險病原體功能增益研究,重新為從事該類研究的科學家、實驗室提供聯邦資金資助。美國舉國性質的危險病原體功能增益研究重啟兩年後,2019年11月、12月,新冠病毒在武漢出現,新冠全球疫情爆發。
論文A-3
2017年6月28日,Ralph
S. Baric團隊(北卡羅來納大學教堂山分校流行病學系)、范德堡大學醫學中心、波蘭Jagiellonian
University、吉利德科技等在《ScienceTranslational
Medicine》雜誌聯合發表了如下論文:Broad-spectrum antiviral GS-5734 inhibits both
epidemic and zoonotic coronaviruses(廣譜抗病毒藥物 GS-5734可抑制流行性人畜共患冠狀病毒)
https://stm.sciencemag.org/content/9/396/eaal3653
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5567817/
GS-5734是瑞德西韋(Remdesivir)的研發編號。
論文指出:目前正在臨床開發的用於治療埃博拉病毒的GS-5734對多種冠狀病毒,包括SARS-CoV和MERS-CoV都有明顯的抑制療效,GS-5734的預防性早期治療顯著降低了肺病毒載量,改善了臨床症狀和呼吸功能。
為驗證GS-5734即瑞德西韋的廣譜抗(冠狀)病毒能力,Ralph S. Baric等人使用反向遺傳平台,基於病毒的基因序列合成了7種冠狀病毒,WIV1是其中之一,其它六種病毒是:
SARS-CoV(SARS病毒)、
MERS-CoV(中東呼吸綜合症病毒)、
HCoV-NL63(人類冠狀病毒NL63)、
HKU3(蝙蝠冠狀病毒HKU3)、
HKU5(伏翼蝠冠狀病毒HKU5)、
SHC014(蝙蝠冠狀病毒rsSHC014,論文A-1的病毒主角)。
(伏翼蝙蝠是一種拇指大小、重約4克的蝙蝠,發現於2006年,可能是香港獨有的物種。)
實驗證明,隨着GS-5734使用劑量(濃度)的增加,HAE細胞培養物中MERS、SARS、WIV1等7種病毒的RNA滴度均顯著下降;
(HAE細胞,即human airway epithelium cells,人氣道上皮細胞)
另一組實驗證明,隨着GS-5734使用劑量(濃度)的增加,7種病毒的兩種輔助蛋白 ORF1、ORFN的RT-PCR檢測值都顯著下降。
論文還分兩組比較了WIV1等5種病毒與SARS,以及5種病毒與MERS在nsp12蛋白(一種輔助蛋白)部分、及spike蛋白(刺突蛋白)部分的A.A. identity(Amino Acid identity,氨基酸序列一致度或相似度),比較結果表明:不同冠狀病毒的spike蛋白部分差異較大,但它們的nsp12蛋白部分則高度保守(一致程度很高,差異度很低)。因而,(高度一致的)nsp12蛋白是廣譜抗冠狀病毒藥物的適宜靶點(治療作用點)(nsp12蛋白應該就是GS-5734的治療靶點)。
論文A-4
2018年12月19日,Ralph S. Baric團隊與國家過敏和傳染病研究所(所長即安東尼·福奇Anthony Fauci)的兩個下屬機構(病毒學實驗室、落基山獸醫分會)在著名國際開源出版期刊MDPI(Multidisciplinary Digital Publishing Institute)上聯合發表了如下論文:SARS-Like Coronavirus WIV1-CoV Does Not Replicate in Egyptian Fruit Bats(類SARS冠狀病毒WIV1不會在埃及果蝠中複製)
https://www.mdpi.com/1999-4915/10/12/727/htm
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6316779/
這是Ralph S. Baric另一篇專門研究WIV1的論文。
論文通過果蝠體內實驗指出:WIV1病毒能有效利用埃及果福的ACE2受體進入果蝠細胞,它能感染果蝠的鼻甲、氣管、肺、腎、胃、腸等眾多器官、組織,使這些器官、組織產生明顯的不同程度、不同細節的免疫反應。
註:埃及果蝠(Egyptian fruit bat,Rousettus aegyptiacus)是馬爾堡病毒的天然宿主,也是所有絲狀病毒的唯一已知宿主。
上篇文章曾指出,WIV1病毒具有泛器官、泛組織感染能力,依據就是這篇論文。
WIV1雖然可感染果蝠多處器官、組織,並引發免疫反應,但它的毒性很低。實驗證明,WIV1不會對果蝠造成強烈感染,不會引發可觀察的(外部)臨床症狀,12隻實驗果蝠都沒有表現出明顯的臨床疾病跡象(如呼吸窘迫、厭食或嗜睡),未檢測到果蝠的體重減輕或體溫變化。論文判斷:WIV1可能在果蝠體內只發生了一些低水平的病毒複製。
這表明,WIV1雖然具有泛器官、泛組織感染能力,但它(對果蝠)的致病能力非常弱。(對果蝠)它沒有表現出新冠病毒那樣的泛器官、泛組織損傷、破壞能力(它更不具備新冠病毒所擁有的完備、周全的宿主免疫對抗能力,如免疫屏蔽、免疫逃避,免疫干擾、免疫抑制,免疫破壞等)。
研究者在多個感染後時段對實驗果福分批實施安樂死,並對果福的超過20個器官、組織部位進行了病毒學和組織病理學分析:鼻甲、喉、咽、氣管、肺、腦、眼、結膜、心、肝、脾、腎、膀胱、生殖器官、胃、近端和遠端腸道、頸部淋巴結、腎上腺、皮膚和骨骼肌。
這表明,Ralph S. Baric團隊清楚地認識到了WIV1病毒的泛器官、泛組織感染能力。
感染後第三天的檢測、分析結果是:除在果蝠咽部和鼻甲骨檢測到WIV1病毒RNA外,在其它器官、組織中均未再檢測到WIV1病毒RNA。
也就是說,WIV1病毒進入、感染了眾多果蝠器官、組織,引發了這些器官、組織的(內部)免疫反應,但幾天之後,它又從絕大多數器官、組織中消失了。論文認為,WIV1消失的原因是它在果福器官、組織中缺乏持續、有效的複製、繁衍。
論文還做了兩組轉基因BHK細胞(Baby Hamster Syrian Kidney cells,敘利亞幼倉鼠腎細胞)體外感染實驗,實驗結果表明,WIV1能有效感染表達hACE2的轉基因BHK細胞,和表達果蝠ACE2 的轉基因BHK細胞;與果福體內感染實驗不同的是,WIV1在這兩種轉基因BHK細胞中都能健壯地持續複製。
Ralph S. Baric不只對WIV1(rs3367)做過反覆研究,他的幾乎每一篇論文(我讀過的)都要研究冠狀病毒的刺突蛋白,刺突蛋白的RBD;對RBD關鍵氨基酸,Ralph S. Baric早在2007年就做過極為精深的研究。下文是4個RBD關鍵氨基酸論文實例:
拉爾夫·巴里克對RBD關鍵氨基酸的研究
(未完待續)








