新冠病毒的來源真相是捂不住的,它不會成為長期懸案。信息控制、輿論操縱終將因破綻百出而決堤、崩潰,謊言、假相終將敗露,不作為、假作為,裝聾、扮瞎、作啞、演戲,身披皇帝新裝掩耳盜鈴、欲蓋彌彰,欺瞞、愚弄世人者終將在眾目睽睽下現出原形,真相和眾多鐵證人盡皆知之日不會被推遲太久。
接續:“萬能”受體適配器--新冠S蛋白 4
筆者堅信,自己的系列溯源文章有難得的展示、研究、借鑑、反思、討論、爭鳴價值,不應被忽略、擱置、迴避。這些文章所披露、介紹、剖析的未獲宣傳、不為公眾所知的大量論文和研究成果,不僅關乎新冠病毒的來源真相,關乎類似的天災/人禍會否重演,關乎某些人會不會一再錯上加錯,而且,一些科學發現,如SARS-CoV-2 S蛋白(Spike蛋白,刺突蛋白)致血栓性、其它血液毒性、致癌性、鐵代謝毒性、神經毒性等致病能力,與我們每個人的現實健康、個人選擇、自我保護和長期生活也息息相關。
如果您認為筆者的文章不可信,不值得稱道,不值得推廣,如果您認為筆者在撒謊、造謠、編造、譁眾取寵,那麼,尊敬的讀者、媒體人、科技界人士,我可否肯請你們,在筆者所有溯源文章,包括當前這篇文章中指出任意三處錯誤,或者,指出任意一處存在杜撰、捏造嫌疑的內容?這不會是一件有難度的事情吧?
新冠病毒的來源真相、新冠疫情的發生真相對我們是否重要?對真相的渴望是否還留存在我們心中?對新冠病毒、新冠疫情的真相都無所謂的人,是否還在乎其它事實、真相?
對筆者的溯源文章,可否多給予一些展示、討論,以及接受批駁的機會?如果您認同筆者的溯源文章專業、高質量,依據充分、邏輯嚴謹、內容可靠,富有價值、不可多得、意義深遠,那麼,可否請您給這些文章,給文章作者逆境中前行的堅持、勇氣和付出多一些支持、鼓勵,多一些讚譽和掌聲?
筆者相信,有良知、責任感、有道義、公平公正的媒體人不會視若不見,不會冷漠對待,迴避、冷處理對真知、真相的探索、發現,他們會堅決支持講真話的文章,會積極展示、大力宣傳新冠溯源的重大證據、重要線索,會熱情鼓勵對真知、對重大事件真相的挖掘、揭示、討論、辯論和觀點對撞。
10、Hemoglobin(血紅蛋白)、Heme(血紅素)、Porphyrin(卟啉)
先談談SARS-CoV-2中的跨物種基因。
SARS-CoV-2中的跨物種基因
一種來自動物的病毒為什麼剛剛出現在人群中,就以人類為最佳感染、致病對象?一種來自動物的病毒,為什麼不經適應性變異,就已具備史無前例的,令所有病毒、病原體望塵莫及的,幾十種人體蛋白、多肽、酶、激素的結合、攝取、降解、改變、利用、模仿能力?一種來自動物的病毒,為什麼在接觸人類之初,就對人體的組織結構、生理機能瞭如指掌,在人體中輕車熟路、遊刃有餘,能夠無所不至地感染、損害幾乎所有的人體組織、器官(泛組織、器官感染能力),並造成涉及各個組織、器官的,五花八門、不勝枚舉的後遺症?
SARS-CoV-2是在動物宿主中自然演化產生的,還是專門針對人類設計的?
SARS-CoV-2是廣泛借鑑、參考,廣泛模仿、引入的宏大轉基因“傑作”、“巨製”,是披着冠狀病毒外殼的跨物種基因集大成者。SARS-CoV-2具有大量其近親病毒無一具有,甚至大量其它冠狀病毒無一具有的基因、蛋白結構,這是一些跨物種基因(基因、蛋白結構),它們使SARS-CoV-2將各種來源的感染、致病、免疫對抗能力匯集於一身。SARS-CoV-2中的跨物種基因,不僅來自各科屬病毒,而且來自非病毒微生物、動物和植物;SARS-CoV-2中的跨物種基因,不僅來自非近親冠狀病毒、各科屬非冠狀病毒,不僅來自致病細菌、寄生蟲、動物、人類和植物,而且來自細菌毒素、動物毒素、醫療藥劑。或者說,SARS-CoV-2具有大量非近親病毒、非冠狀病毒來源的跨物種基因、蛋白結構,這些跨物種基因、蛋白結構,分別在各科屬病毒、致病細菌、寄生蟲、動物、人類、植物、細菌毒素、動物毒素、醫療藥劑中存在相同或高度相似的結構來源。
產生一種近親和同科病毒皆不具備的基因、蛋白結構,對自然變異、自然重組來說是極低概率事件。在同一種病毒中居然匯集了如此之多的極其反常的基因、蛋白結構,一種病毒不僅含有大量極其反常的基因、蛋白結構,而且這些基因、蛋白結構居然與眾多非冠狀病毒,與眾多細菌,與寄生蟲、動物、人類、植物,與細菌毒素、動物毒素、醫療藥劑都存在結構巧合,它們會是自然突變、自然重組的結果嗎?不會,它們一定出自人為的設計、引入、集成。
筆者之前多次指出過SARS-CoV-2中的跨物種基因、蛋白結構(包括抗原結構),一部分此類結構的論文依據也已在以下文章
誰設計、製造了新冠病毒(四)匪夷所思
及其它文章中給出,現在,我們作一個更全面的小結。
SARS-CoV-2含有大量非冠狀病毒的各科屬病毒來源的基因、蛋白、抗原結構。
SARS-CoV-2中不僅匯集了許多非近親冠狀病毒的基因、蛋白結構,而且,它還含有大量在其它冠狀病毒中未發現過,但與別的科屬病毒(包括RNA病毒、DNA病毒,包括動物病毒和植物病毒)相同或相似的基因、蛋白結構,例如:
SARS-CoV-2與HIV(艾滋病病毒,逆轉錄科慢病毒屬)有着驚人的關聯和相似性:
SARS-CoV-2 S蛋白含有四個與HIV gp120蛋白(包膜蛋白)、Gag蛋白(衣殼結構蛋白)相同或相似,與免疫破壞能力有關的短基因片斷,二種病毒都能夠以相應蛋白結合CD4受體,感染、破壞CD4+T淋巴細胞;
SARS-CoV-2 S蛋白還含有其它HIV基因片斷。S蛋白S1亞基含有一段Gag_p17 基序,S2亞基含有兩段Gag_p17基序、三段Gag_p24基序,Gag_p17、Gag_p24是HIV Gag基因/GAG蛋白中的結構域;
SARS-CoV-2 S蛋白、HIV gp120蛋白都含有蛇神經毒素樣區域(snake-toxin like region),都具備神經元受體結合能力,都具有多重神經系統損害機制;
兩種病毒都具有furin酶切位點和高效的直接膜融合感染能力;
兩種病毒都具有O-Link聚糖結構和相應的免疫屏蔽、免疫逃避能力;
兩種病毒都能夠通過結合CD4和CD147/Basigin(BSG,基礎免疫球蛋白)等受體感染、破壞T(淋巴)細胞、巨噬細胞、單核細胞等免疫細胞,二者還共有多種其它感染受體或細胞附着因子,如CD169(Siglec-1)、CD209(DC-SIGN)等等;
兩種病毒都能夠結合血紅素的核心構件卟啉並引起卟啉症(卟啉代謝紊亂);SARS-CoV-2 能夠感染紅細胞和紅細胞祖細胞,HIV能夠感染骨髓造血細胞,二者都具有血細胞和血液系統損害能力和鐵代謝干預能力;
SARS-CoV-2 S蛋白含有一個能夠與紅細胞膜上的補體受體1(complement receptor 1)結合的C1q結構域,而HIV的感染機制也與細胞補體組件C1q(Complement Component C1q) 有關;
二種病毒可能都具有不通過受體結合,直接穿透細胞膜的能力;
SARS-CoV-2具有類似艾滋病病毒(但尚不健全)的逆轉錄自身RNA(片斷)為cDNA(RNA的互補DNA),並將cDNA整合入人體被感染細胞DNA的能力/特性;
等等;
多種艾滋病傳統藥物已被用於治療COVID-19;SARS-CoV-2的“小艾滋”之稱名副其實;
SARS-CoV-2 S蛋白含有來自登革熱病毒(Dengue Viruse,黃病毒科黃病毒屬)的抗原結構,計算機分析表明,SARS-CoV-2 S蛋白S2亞基HR2(Heptad Repeat 2,七肽重複序列2)結構域與登革熱病毒包膜蛋白可能存在相似的抗原位點;二者都具有VSR (viral suppressor of RNA interference,RNAi的病毒抑制)免疫抑制機制;二者有多種相同的感染受體,如波形蛋白(Vimentin,VIM)、腎損傷分子-1(Kidney injury molecule-1,KIM-1)、FcR類蛋白等,其中FcR(fragment crystallizable region,可結晶片斷區域)類蛋白是登革熱病毒等黃病毒科病毒的典型感染受體,黃病毒科病毒使用FcR類蛋白感染細胞的機制被稱為抗體依賴性增強感染。FcR類蛋白子類FcγR中的CD16、CD64是SARS-CoV-2感染單核細胞和巨噬細胞等免疫細胞的受體。
SARS-CoV-2 S蛋白含有來自甲型流感病毒(Influenza A virus ,IAV,正黏液病毒科)的一些抗原結構,二者也都具有VSR免疫抑制機制,二者有多種相同的感染受體,如β-連環蛋白(β-Catenin,β-CAT)、KIM-1等;
SARS-CoV-2 S蛋白和狂犬病病毒(Rabies Virus,RABV,彈狀病毒科)糖蛋白G都含有結合nAChR(nicotinic acetylcholine receptor,煙鹼型乙酰膽鹼受體,一種神經元受體)的蛇神經毒素樣區域。在狂犬病病毒約五種感染受體中,和SARS-CoV-2共同的感染受體/內化因子就有三種:TfR1(transferrin receptor 1,轉鐵蛋白受體1)、nAChR、mGluR2(metabotropic glutamate receptor subtype 2,代謝型穀氨酸受體亞型2),nAChR、mGluR2都是神經元受體,SARS-CoV-2和RABV都有神經毒性;
SARS-CoV-2 S蛋白含有來自丙型肝炎病毒(hepatitis C virus ,HCV,黃病毒科肝炎病毒屬)capsid protein(衣殼蛋白)的兩段結構域基序HCV_capsid A、HCV_capsid B;二者都具有furin酶切位點;二者都具有O-Linked聚糖結構及免疫屏蔽機制;二者有多種相同的感染受體,如HS/HSPG(heparan sulfate/heparan sulfate proteoglycans,硫酸乙酰肝素/硫酸乙酰肝素蛋白聚糖)、TfR1 、ASGR1/CLEC4H1(asialoglycoprotein receptor 1,去唾液酸糖蛋白受體1,肝臟特有的糖蛋白,乙肝、丙肝病毒的共同感染受體)、Basigin/CD147 (BSG,基礎免疫球蛋白)等;二者都能感染肝細胞、造成肝損傷;二者都能感染巨噬細胞、單核細胞等免疫細胞;二者都能干預鐵代謝並造成鐵代謝失調、紊亂;二者都能作用於血紅素的核心構件卟啉(porphyrin)並引發卟啉症(卟啉代謝紊亂);
SARS-CoV-2 S蛋白含有乙型肝炎病毒(hepatitis B virus,SARS-CoV-2,嗜肝DNA病毒科)core protein(核心蛋白,即HBcAg)的鋅結合結構域(zinc-binding domain)--Hep core N,鋅結合功能可能用於對抗、反制宿主對病毒轉錄的抑制,各種哺乳動物嗜肝DNA病毒(如土撥鼠肝炎病毒)都具有鋅結合基序/鋅結合結構域;SARS-CoV-2與HBV有共同的感染受體Basigin/CD147、ASGR1/CLEC4H1(asialoglycoprotein receptor 1,去唾液酸糖蛋白受體1);二者都能感染肝細胞、造成肝損傷;二者都可能二者都能干預鐵代謝並造成鐵代謝失調、紊亂;二者都能引發卟啉症;二者都能將自身的基因組或基因組片斷整合到人類細胞DNA中;
SARS-CoV-2 S蛋白含有來自昆蟲多角體病毒(杆狀病毒科)中的幾丁質結構域(Chitin-binding type-2),SARS-CoV-2可通過這一結構域吸附紅細胞,搭乘紅細胞“便車”在人體內擴散,迷惑並逃避免疫攻擊;
SARS-CoV-2中跨物種基因的非冠狀病毒各科屬病毒來源或借鑑對象還包括或可能包括:埃博拉病毒(Ebola virus,絲狀病毒科)、寨卡病毒(Zika virus)、尼帕病毒(Nipah virus,副黏液病毒科亨尼巴病毒屬)、Nepovirus(神經病毒,豇豆花葉病毒科的一個病毒屬)、picornaviruse(微小核糖核酸病毒,包括脊髓灰質炎病毒、甲型肝炎病毒、口蹄疫病毒、腦心肌炎病毒等等)、parvovirus(細小病毒,細小病毒中的parvovirus B19 入侵兒童骨髓中的紅細胞前體細胞,導致純紅細胞再生障礙性貧血 (PRCA) 和皮疹)、Rhabdovirus(彈狀病毒)、rotavirus(輪狀病毒)等等。maltose-binding protein
部分跨物種基因的論文依據在本系列之前的文章以及上面剛剛提到的文章中已經給出,本文稍後的“論文依據一”也將指證多種SARS-CoV-2跨物種基因,其它論文依據還將在後續文章中陸續提供。
SARS-CoV-2中含有大量來自(致病)細菌的基因、蛋白、抗原結構。
SARS-CoV-2 S蛋白含有來自12種致病細菌的幾十個抗原位點(抗原短序列),這些細菌中的部分知名細菌是:結核分枝桿菌、麻風分枝桿菌、炭疽桿菌、破傷風梭菌、幽門螺桿菌、金黃色葡萄球菌、化膿性鏈球菌、霍亂弧菌、鼠疫耶爾森氏菌;
SARS-CoV-2的非結構蛋白ORF3a等蛋白含有發現於淋病奈特氏菌、流感嗜血桿菌和致病性大腸桿菌中的肽酶S6結構域(Peptidase S6 domain),該結構域能夠催化血紅蛋白降解,釋放其中的血紅素;
SARS-CoV-2的S、ORF3a等蛋白含有金黃色葡萄球菌的NEAT結構域,NEAT結構域的作用是定位、結合血紅蛋白,結合、攝取其中的血紅素。ORF3a的NEAT結構域由緊密堆積的IsdA、IsdC 和IsdH 子域組成,這些子域的氨基酸序列來自金黃色葡萄球菌的IsdA、IsdC和IsdH蛋白,金黃色葡萄球菌的IsdA、IsdC 和IsdH/IsdB等Isd蛋白能夠完成血紅蛋白定位和血紅素結合/捕獲等活動;
SARS-CoV-2 的結構蛋白S(Spike,刺突)、N(Nucleocapsid,核衣殼)、E(Envelope,包膜)及非結構蛋白ORF3a、ORF7b、ORF10、nsp2、nsp3 和RdRP 均具有細菌和真核生物線粒體來源的Haem_bd 結構域,其中E、ORF3a的Haem_bd結構域中含有可結合血紅素(Heme)和卟啉(porphyrin)的基序。Haem_bd 結構域存在於大多數細胞色素C 氧化酶(cytochrome C oxidases)中,而細胞色素C 氧化酶存在於細菌和真核生物細胞線粒體中。
ORF3a蛋白還含有存在於金黃色葡萄球菌血紅素降解酶中,以及結核分枝桿菌血紅素降解單加氧酶中的ABM 結構域,ORF3a蛋白同時含有存在於漢賽巴爾通體(Bartonella henselae,一種可導致貓抓病的革蘭氏陰性桿菌)、小腸結腸炎耶爾森氏菌等革蘭氏陰性桿菌或球桿菌中的HemS結構域。ABM 結構域和HemS結構域都具有血紅素裂解/降解能力,可將血紅素裂解/降解為鐵和卟啉;
SARS-CoV-2 ORF3a蛋白能以不只一種方式裂解/降解血紅素,其中之一與金黃色葡萄球菌非常相似,二者都能在NADPH-細胞色素P450還原酶存在的情況下,裂解血紅素的四吡咯環結構,將血紅素降解為卟啉和鐵,並攝取所釋放的亞鐵離子;
稍後還將說明,SARS-CoV-2 S蛋白含有與腸毒素B高度相似的,可強烈結合T細胞受體的基序(腸毒素B是金黃色葡萄球菌的代謝、分泌物)以及與肉毒桿菌神經毒素高度相似,同樣可結合T細胞受體的基序;
SARS-CoV-2 S蛋白中含有存在於哺乳動物和細菌(如一些腸道細菌)中的硫酸酯酶(sulfatase)結構域。硫酸酯酶在硫循環、溶酶體中硫酸化糖胺聚糖和糖脂的降解以及細胞外空間硫酸化糖胺聚糖的重塑中發揮重要作用(S蛋白兩種結合受體硫酸乙酰肝素/HS和肝素/HP都是硫酸化的糖胺聚糖),硫酸酯酶和磺基轉移酶是硫酸酯合成、分解的主要催化物。硫酸酯酶與激素依賴性癌症、溶酶體貯積症、發育異常等多種疾病的發生及細菌發病機制有關;
SARS-CoV-2 S蛋白中還含有一種多見於放線菌(包括鏈黴菌和分枝桿菌)鐵硫蛋白(Actinomyces iron-sulfur protein)中的鐵硫結合結構4Fe-4S Wbl-type,該結構因對一氧化氮 (NO) 極其敏感而具有亞硝化監測作用,可幫助病原體逃避免疫細胞或紅細胞的RNS(reactive nitrogen species,活性氮類/活性氮)自由基攻擊。
SARS-CoV-2含有借鑑、抄襲自寄生蟲的基因、蛋白、抗原結構。
SARS-CoV-2與瘧原蟲的驚人關聯和相似性不亞於它與HIV的關聯和相似性。
SARS-CoV-2 多種蛋白含有來自惡性瘧原蟲(Plasmodium falciparum)、諾氏瘧原蟲(Plasmodium knowlesi)、三日瘧原蟲(Plasmodium malariae)等瘧疾寄生蟲的基因、蛋白、抗原結構。其中,
S蛋白中的7 氨基酸基序 (439NNLDSKV445) 與三日瘧原蟲保守的膜結合表面蛋白 (membrane bound-surface protein)100%相似,該基序替換了蝙蝠冠狀病毒中的相應基序(該基序兩側的序列與蝙蝠冠狀病毒相同);
S蛋白、ORF3a蛋白中含有富含色氨酸和蘇氨酸的瘧原蟲抗原;
耶魯大學Bei 教授(Amy K. Bei)領導的一個國際小組證明,急性瘧疾感染產生的抗體可與SARS-CoV-2 Spike蛋白發生交叉反應,急性瘧疾抗體特異性識別SARS-CoV-2 Spike蛋白S1亞基N 連接聚糖上的唾液酸部分(the sialic acid moiety on N-linked glycans)並與之相互作用;
SARS-CoV-2能利用與惡性瘧原蟲(Plasmodium falciparum)類似的結構感染紅細胞(erythrocyte)。ORF3a 蛋白含有惡性瘧原蟲抗原EBA-175 結構域,能夠結合紅細胞膜上的Glycophorin A(血型糖蛋白A/唾液酸糖蛋白A),SARS-CoV-2 S蛋白則含有一個能結合紅細胞膜上的complement receptor 1(補體受體1)的C1q結構域。S和ORF3a組成紅細胞攻擊複合體,二者分別與受體蛋白結合併錨定在紅細胞膜骨架上,而後ORF3a 使用硫醇激活的溶細胞素結構域(thiol-activated cytolysin domain)在紅細胞膜上產生溶血孔(hemolytic pores),將病毒RNA注入成熟的紅細胞中;由於含有瘧原蟲抗原,A型和Knops血型者的血細胞可能更容易受到SARS-COV-2多種蛋白的攻擊;
SARS-CoV-2的S蛋白等蛋白能結合多種紅細胞(及紅細胞祖細胞)表面受體,其中,CD147/Basigin、Band3/AE1(帶3蛋白)、sialic acid(唾液酸)也是瘧原蟲感染紅細胞的結合受體;SARS-CoV-2 S蛋白能夠結合Acyclophilin A(親環蛋白A),而惡性瘧原蟲的裂殖子表面蛋白(merozoite surface protein)能夠結合Acyclophilin B(親環蛋白B);
一組非洲科學家總結了已有的論文發現並指出,COVID-19在臨床、病理(包括先天免疫和適應性免疫反應)、感染途徑/受體使用、基因蛋白抗原結構上都與瘧疾驚人相似;他們還指出,撒哈拉以南非洲國家由於之前流行瘧疾(感染瘧疾能夠獲得對SARS-CoV-2的有效免疫力),並廣泛使用抗瘧藥物,因此,儘管健康、衛生狀況不佳,醫療系統脆弱,但這些國家的COVID-19病例數量仍然很低;
眾所周知,抗瘧藥物--氯喹(chloroquine,CQ) 、羥氯喹(hydroxychloroquine,HCQ)都已被用於COVID-19治療。
SARS-CoV-2含有多處與人類相同或相似的基因、蛋白結構。
SARS-CoV-2 S蛋白S1/S2處的長furin切割序列原樣抄襲、復用了人類ENaC-α(上皮鈉離子通道α亞基)的長furin切割序列,二者皆為RRAR'SVAS,S蛋白以此模擬、偽裝人體ENaC的水解激活;
SARS-CoV-2 S蛋白含有一段與ICAM-1子序列高度相似的基序。ICAM-1 (Intercellular Adhesion Molecule 1,細胞間粘附分子1 )也叫做CD54 (Cluster of Differentiation 54,分化簇54),是一種細胞表面跨膜糖蛋白,通常在內皮細胞和免疫系統細胞的細胞膜上表達,對於免疫和炎症反應的介導至關重要。SARS-CoV-2 S蛋白中的ICAM-1樣基序與TCRVα相互作用,以進一步穩定S-TCR複合物。這一結構及其作用與後面“SARS-CoV-2含有與細菌毒素高度相似的基因結構”小節及SARS-CoV-2 S蛋白的TCR(T細胞受體)結合能力緊密相關,可能也與T細胞的過度激活、免疫風暴-過度炎症反應有關。值得注意的是,ICAM-1也在中樞神經系統(central nervous system,CNS)中表達,如在人類前腦的白質和灰質中的小膠質細胞和星形細胞以及內皮細胞中表達,它具有血腦屏障的關鍵功能,在精神疾病的發病機制中也具有重要作用。SARS-CoV-2 S蛋白中的ICAM-1樣基序繼承自SARS-CoV-1,後者S蛋白含有兩段與ICAM-1子序列高度相似的基序。
SARS-CoV-2 S蛋白中結合人體NRP1(Neuropilin-1,神經纖毛蛋白-1)受體的Cendr多肽,與NRP1在人體內的天然結合配體—VEGF-A(Vascular Endothelial Growth Factor-A,血管內皮生長因子-A/血管通透因子/血管調理素,一種人體內的二聚體糖蛋白),二者在空間結構、形態,與NRP1的結合細節上都非常相似;
SARS-CoV-2 S蛋白不僅能夠結合人類鐵代謝的關鍵因子之一--鐵調素(Hepcidin),而且,S蛋白尾部區域與人類鐵調素存在氨基酸序列相似性,這一尾部區域可能能夠模仿鐵調素的分子作用和生理功能。計算機模擬研究表明,SARS-CoV-2 S蛋白的尾部片斷—Covidin多肽能夠模仿鐵調素,結合人體唯一的細胞鐵輸出蛋白--鐵轉運蛋白(ferroportin,FPN),抑制細胞鐵輸出、鐵釋放,這是鐵調素的核心生理功能之一,Covidin多肽很可能也具備鐵調素的鐵轉運蛋白降解能力;
SARS-CoV-2 S蛋白能夠模仿人體血紅素加氧酶(heme oxygenase)對血紅素(Heme)的氧化活性,在抗壞血酸(即維生素C)存在時,催化血紅素緩慢轉化/降解為膽綠素(biliverdin),這意味着,S蛋白中存在與人體血紅素加氧酶相似或等效的結構;
SARS-CoV-2及其S蛋白有高度致癌性。
SARS-CoV-2的S蛋白等蛋白具有黑色素瘤結構域(melanoma domain),許多惡性腫瘤,包括肺癌,都具有包含黑色素瘤結構域的致病蛋白;
SARS-CoV-2的S蛋白等蛋白質含有來自人類p53蛋白的p53結構域,p53蛋白也被稱為p53腫瘤蛋白,是導致人類腫瘤的最常見的突變基因,其突變發生頻率高達50%;
SARS-CoV-2 S蛋白還含有存在於哺乳動物和細菌(如一些腸道細菌)中的硫酸酯酶(sulfatase)結構域,該結構域與激素依賴性癌症的發病機制有關;
大量已發表的研究表明,癌症患者感染COVID-19 後,癌症惡化的總體風險會增加;大量臨床研究已證實,COVID-19 患者表現出與氧化應激損傷(oxidative stress damage)一致的症狀。在嚴重氧化應激的情況下,患者的ROS(reactive oxygen species,活性氧/活性氧類)控制機制變得紊亂。活性氧(ROS)失調、紊亂是致癌的關鍵因素。
SARS-CoV-2含有來自動物,特別是低等動物的基因、蛋白結構。
SARS-CoV-2 S蛋白含有來自軟體動物、節肢動物血藍蛋白的多個血藍蛋白結構域,S蛋白因這些結構域而具有血藍蛋白的氧分子結合、運輸的能力,以及酚氧化酶和酪氨酸酶活性。酪氨酸酶和酚氧化酶的共同作用可將酪氨酸和多巴胺等酚類物質轉化為苯醌,SARS-CoV-2 S蛋白的酪氨酸酶、酚氧化酶活性(S蛋白對血藍蛋白和兩種酶的模仿)可使COVID-19患者醌中毒,全身劇烈疼痛,並出現色素過度沉着症狀(皮膚變暗,重症患者皮膚明顯變黑)。血藍蛋白是大部分軟體動物(如章魚、魷魚、貝類、蝸牛)和部分節肢動物(如蠍子、蜘蛛、甲殼蟲、鱟、蝦、蟹)體內的呼吸蛋白及多功能蛋白,人類的呼吸蛋白是血紅蛋白,人類和幾乎所有哺乳動物,包括蝙蝠和穿山甲,都只有血紅蛋白,沒有血藍蛋白(可能有例外,如犰狳);
SARS-CoV-2 的S蛋白、N蛋白等多種蛋白含有來自環節動物、節肢動物巨血紅蛋白(Erythrocruorin)接頭亞基的C 端域(Eryth_link_C)。巨血紅蛋白(Erythrocruorin)是由連接器鏈(linker chain)連接的若幹個細胞外血紅蛋白/球蛋白的複合物,也叫巨型細胞外血紅蛋白/球蛋白呼吸複合體(giant extracellular hemoglobin /globin respiratory complex),連接血紅蛋白/球蛋白的連接器鏈就是複合體的連接器亞基/接頭亞基(The linker subunit)。SARS-CoV-2 可能利用此結構連接/結合人類血紅蛋白(Hemoglobin)及其它球蛋白,如肌紅蛋白(myoglobin)。SARS-CoV-2 S蛋白、N蛋白等蛋白所含的Eryth_link_C結構域,S蛋白、ORF3a等蛋白所含的NEAT結構域都與血紅蛋白連接/結合有關。巨血紅蛋白存在於大多數環節動物(如水蛭、蚯蚓)、許多節肢動物(如昆蟲)和一些軟體動物(如肺蝸牛/陸地蝸牛)中,具有這種蛋白的動物(通常)沒有紅細胞。
如前所述,SARS-CoV-2 S蛋白中含有存在於哺乳動物和細菌(如一些腸道細菌)中的硫酸酯酶(sulfatase)結構域。
SARS-CoV-2含有來自植物的基因結構。
SARS-CoV-2 S蛋白含有存在於植物質體/色素體(一類植物細胞器,葉綠體就是一種質體或色素體)中的多酚氧化酶PPO1 KFDV結構域。多酚氧化酶可氧化多酚,使S蛋白釋放其吸附、構建,用以附着紅細胞的Fe-多酚複合物(Fe-polyphenol complexes),從紅細胞表面脫落。在“搭乘”紅細胞“便車”擴散至某處人體組織後,SARS-CoV-2通過這一機制“到站下車”,以感染抵達地的組織細胞。S蛋白所含多個血藍蛋白結構域中的血藍蛋白N端域Hemocyanin_N A也具有酚氧化酶活性。
SARS-CoV-2含有與細菌毒素高度相似的基因結構。
SARS-CoV-2 S蛋白能夠強烈結合T細胞受體(T Cell Receptor,TCR),決定這一結合能力的是緊鄰S1/S2位點(S1、S2亞基分界處)的氨基酸基序680SPRR683,這一3氨基酸基序同時緊鄰S1/S2處的基本furin切割序列682RRAR685。SARS-CoV-2 S蛋白包含680SPRR683基序在內的氨基酸序列片斷(Q677~Q690)是SARS-CoV-2 所特有的,除SARS-CoV-2外,這一序列片斷在所有β 譜系B支系冠狀病毒中都不存在(可能在所有β 譜系冠狀病毒,甚至所有冠狀病毒中都未報告過),但它在序列和空間結構上與葡萄球菌腸毒素B高度相似,並且二者兼有回文(palindromic)相似性,即這一S蛋白子序列與SEB同一子序列(T150~D161)的正向、反向序列都存在相似性。SARS-CoV-2 S蛋白強力結合TCR的TCRVβ(the variable β-domain of TCR,TCR的可變β 域)和CD28(一種TCR),SEB同樣能結合TCRVβ和CD28。腸毒素B(Staphylococcal enterotoxin B,SEB)是金黃色葡萄球菌的代謝、分泌產物,是一種超級抗原(Superantigens,SAgs)毒素,是公認的毒素類生物、化學戰劑,生物恐怖製劑;
SARS-CoV-2 S蛋白還含有2段分別與兩種肉毒桿菌神經毒素(Botulinum neurotoxin type D or G precursors)高度相似的基序,其中S蛋白中位於T299 至Y351之間,與G型肉毒桿菌神經毒素前體(Botulinum neurotoxin type G precursors)高度相似的基序同樣具有預測的TCR結合高親和力和強烈的T細胞反應觸發能力。這2段肉毒桿菌神經毒素樣基序繼承自SARS-CoV-1,後者S蛋白含有3段與肉毒桿菌神經毒素高度相似的基序。
SARS-CoV-2 S蛋白中具有SAg能力的SEB樣基序和肉毒桿菌神經毒素樣基序可能是重症患者T細胞大規模激活、增殖,引發細胞因子風暴,造成多器官損傷的關鍵因素。
SARS-CoV-2含有來自動物毒素的基因結構。
SARS-CoV-2 S蛋白S1/S2位點附近含有一個與眼鏡蛇屬和銀環蛇屬的神經毒素同源的蛇神經毒素樣區域(snake-toxin like region),蛇神經毒素通過該區域與一種神經元受體--煙鹼型乙酰膽鹼受體(nAChR)相互作用、結合。HIV的gp120蛋白、狂犬病病毒(Rabies Virus,RABV)的糖蛋白G(狂犬病病毒的Spike)也具有相似的蛇神經毒素樣區域。SARS-CoV-2的大腦、神經毒性可能同時與S蛋白的furin切割序列RRAR'SVAS、蛇神經毒素樣區域及其它結構有關。SARS-CoV-2 S蛋白的蛇神經毒素樣區域(Y674~R685)與上面剛剛談到的SEB樣區域高度重合。
SARS-CoV-2含有借鑑自醫療藥劑的基因、多肽結構。
SARS-CoV-2 S蛋白結合人類GRP78(Glucose Regulating Protein 78,葡萄糖調節蛋白78)受體的四個多肽區域(四段基序),與腫瘤化療的藥物載體Pep42在序列、空間環狀性質、物理、化學性質上都具有相似性。環狀小分子多肽(寡肽)pep42是2006年從人類黑色素瘤癌細胞中篩選、鑑定出來的,它是GRP78的特異性結合配體,具有獨特的GRP78結合能力。GRP78廣泛存在於各種細胞的細胞膜上和細胞質中,被稱為細胞伴侶蛋白,通過結合GRP78,pep42可被後者搭載、輸送到各種癌細胞中,是極佳的化療藥物載體。
匯集眾多跨物種基因,使SARS-CoV-2擁有以下兩組卓越非凡、史無前例的超級能力。
集大量人體因子作用能力於一身。
如本系列文章正在披露、介紹的,SARS-CoV-2集幾十種人類蛋白、多肽、酶、激素的結合、攝取、降解、改變、干預、利用、模仿能力於一身,其中,SARS-CoV-2的S蛋白具有超過30種人類細胞表面受體蛋白的結合能力。SARS-CoV-2如此眾多、廣泛的人體因子作用能力令其它所有病毒瞠目結舌、難望頸背、望塵莫及。憑藉極其廣泛的細胞膜受體和其它人體因子結合、附着能力,以及其它機制,SARS-CoV-2能夠感染幾乎所有的人體組織、器官。
周到、完備的免疫對抗能力。
SARS-CoV-2被賦予了極其周到、完備的人類免疫系統對抗機制,它兼具多方位、立體化的免疫破壞、免疫屏蔽和免疫逃避、免疫干擾和免疫抑制能力,它的每一項免疫對抗能力都包含兩種以上的實現機制或途徑。比如,SARS-CoV-2能夠感染、殺死或破壞T(淋巴)細胞、巨噬細胞、單核細胞等多種免疫細胞,再比如其中,通過S蛋白的O-Linked聚糖結構,N-糖基化裝飾,三關節式鉸鏈結構(可能是SARS-CoV-2獨有的結構),S蛋白的構象屏蔽(在閉合構象下將RBD隱藏在刺突蛋白三聚體頭部內),S蛋白與ORF3a蛋白的血紅素結合、捕獲和氧化活性,S蛋白對紅細胞的附着和SARS-CoV-2對紅細胞的搭乘,以及S蛋白中放線菌來源的鐵硫結合結構4Fe-4S Wbl-type的亞硝化監測功能,SARS-CoV-2至少具有七種免疫屏蔽和免疫逃避機制或途徑。
以上內容,都有論文依據。筆者沒有做什麼創造、發明,但筆者是第一個從眾多論文中把上述科學發現匯總在一起的人。這些重要的科學研究成果不被宣傳,一直“沉睡”,不為公眾所知。這些科學發現不只是匪夷所思,它們不只令人震撼和怵目驚心,更令人無比憤怒。
下面我們轉入正題。聚焦、總結一下SARS-CoV-2與紅細胞-血紅蛋白-血紅素-卟啉的關係。
SARS-CoV-2與紅細胞
SARS-CoV-2能利用與惡性瘧原蟲(Plasmodium falciparum)類似的結構感染紅細胞(erythrocyte)。SARS-CoV-2的S蛋白含有一個能結合紅細胞膜上的complement receptor 1(補體受體1)的C1q結構域,ORF3a 蛋白含有惡性瘧原蟲抗原EBA-175 結構域,能夠結合紅細胞膜上的Glycophorin A(血型糖蛋白A/唾液酸糖蛋白A)。S和ORF3a組成紅細胞攻擊複合體,二者分別與受體蛋白結合併錨定在紅細胞膜骨架上,之後ORF3a 使用硫醇激活的溶細胞素結構域(thiol-activated cytolysin domain)在紅細胞膜上產生溶血孔(hemolytic pores),然後將病毒RNA注入成熟的紅細胞中。SARS-CoV-2對紅細胞的感染、入侵(可能)不會有明顯的溶血或缺氧反應。
SARS-CoV-2的S蛋白等蛋白能夠結合CD147/Basigin、Band3/AE1(帶3蛋白)、sialic acid(唾液酸)、complement receptor 1、Acyclophilin A(親環蛋白A)、CD26 /DPP4、ACE2等眾多紅細胞表面受體,這些受體中,至少前三種也是(惡性)瘧原蟲感染紅細胞的結合、利用受體;SARS-CoV-2 S蛋白能夠結合Acyclophilin A(親環蛋白A),而惡性瘧原蟲的裂殖子表面蛋白(merozoite surface protein)能夠結合Acyclophilin B(親環蛋白B);
SARS-CoV-2還能感染紅細胞的祖細胞;
SARS-CoV-2也可以不進入、感染紅細胞而只是附着在紅細胞的細胞膜表面。SARS-CoV-2 S蛋白利用杆狀病毒/多角體病毒來源的幾丁質(chitin,也叫甲殼素)結合域在S蛋白表面構建鐵-多酚複合物(Fe-polyphenol complexes),並通過該複合物吸附到紅細胞的細胞膜上,從而使SARS-CoV-2 “搭乘”紅細胞的“便車”在人體中擴散,並迷惑、逃脫免疫細胞的偵測、攻擊(SARS-CoV-2 眾多免疫逃避途徑中的一種)。
SARS-CoV-2 S蛋白中的22個N-糖基化位點(N-glycosylation sites)能夠與紅細胞唾液酸糖蛋白塗層上的聚糖結合,誘發紅細胞聚集/團聚(Aggregate/Rouleaux,異常聚集形成輪狀/硬幣堆疊狀團塊),引發血栓/血凝(血栓的成因之一)、缺氧(低氧血症),嚴重時可能造成致命後果。
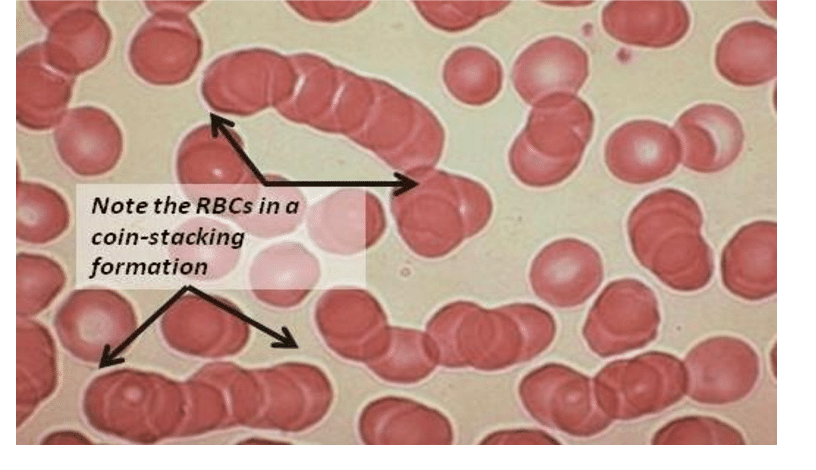
紅細胞Aggregate/Rouleaux 形成“硬幣”堆棧
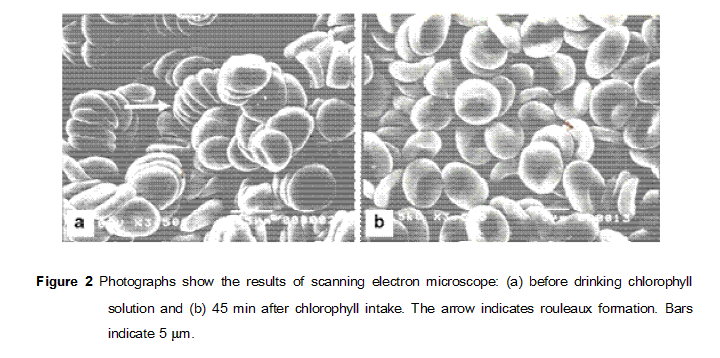
使用水溶性葉綠素(chlorophyll)可緩解紅細胞rouleaux formation

可能是一種嚴重的紅細胞rouleaux狀態
本圖摘自:https://wellcomecollection.org/works/yaf2m8yw
不同PH值下的正常紅細胞
實驗證明,無須使用全病毒,將SARS-CoV-2 S(Spike)蛋白與人全血混合即可引起紅細胞聚集。已知的,另外二種Spike可誘發血凝(hemagglutination,HA)的冠狀病毒是牛冠狀病毒(bovine coronavirus,BCoV)和血凝性腦脊髓炎病毒(haemagglutinating encephalomyelitis virus,HEV/PHEV )。
註: HEV即豬血凝性腦脊髓炎病毒(porcine haemagglutinating encephalomyelitis virus,PHEV ),BCoV和HEV都屬於冠狀病毒β譜系A支系,SARS-CoV-2屬於β譜系B支系。
論文原文:
Indeed, SARS-CoV-2 spike protein mixed with human whole blood caused RBC aggregation [40], while spike protein from two other coronavirus strains also induced HA [41,42].
SARS-CoV-2 Spike Protein Induces Hemagglutination: Implications for COVID-19 Morbidities and Therapeutics and for Vaccine Adverse Effects
SARS-CoV-2 刺突蛋白誘導血凝:對COVID-19 發病、治療以及疫苗不良反應的影響
https://www.mdpi.com/1422-0067/23/24/15480
這表明,單獨存在的SARS-CoV-2 Spike自身即具有致血凝、致血栓能力。
致血栓、致血凝性應該只是SARS-CoV-2 S蛋白血液毒性的冰山一角。SARS-CoV-2 S蛋白能夠結合多種紅細胞表面受體,能夠與ORF3a蛋白協同作用穿孔、感染、侵襲紅細胞,能夠利用杆狀病毒/多角體病毒來源的幾丁質結合域構建鐵-多酚複合物吸附紅細胞;SARS-CoV-2 S蛋白還能結合紅細胞中的血紅蛋白,能夠結合血紅蛋白中的血紅素,能夠結合血紅素的核心構件卟啉;SARS-CoV-2 能夠模仿人體血紅素加氧酶(heme oxygenase )對血紅素的氧化活性,在抗壞血酸(即維生素C)存在時,催化血紅素緩慢轉化/降解為膽綠素(biliverdin)。S蛋白的這些特性,將使其具有潛在的多方面的血液毒性,而不只限於致血栓/血凝性。當然,部分S蛋白的血液毒性需要其它病毒蛋白的配合。在S蛋白與其它SARS-CoV-2 蛋白(如ORF3a蛋白,ORF3a蛋白能夠利用兩種病菌來源的結構域—HemS、ABM將血紅素裂解/降解為鐵和卟啉)協同作用下,SARS-CoV-2的血液毒性可能參與、加劇重症患者的肺損傷和多器官功能障礙。
筆者在上上篇文章(“萬能”受體適配器--新冠S蛋白 3)中曾指出,SARS-CoV-2 Spike,包括疫苗中使用的SARS-CoV-2 Spike,及疫苗編碼產生的SARS-CoV-2 Spike具有多重毒性,並指出了S(即Spike)蛋白的致血栓性和鐵代謝毒性(導致鐵代謝紊亂,引發眾多關聯病症)。
除了致血栓性、血液毒性、鐵代謝毒性,SARS-CoV-2 S蛋白還具有或可能具有高度致癌性、腸毒素B超抗原(superantigens,SAg)毒性和神經毒性。
前面已經指出,SARS-CoV-2 S蛋白具有黑色素瘤結構域(melanoma domain)、p53腫瘤蛋白結構域,及與激素依賴性癌症發病機制有關的硫酸酯酶(sulfatase)結構域,具有高度致癌性。
SARS-CoV-2 S蛋白含有與腸毒素B(Staphylococcal enterotoxin B,SEB)高度相似,可強烈結合T細胞受體(T cell receptor,TCR)的基序,SEB是金黃色葡萄球菌的代謝、分泌物,是一種強大的超抗原毒素,是公認的化學戰劑、毒素類生物戰劑、生物恐怖製劑。
SARS-CoV-2具有多重神經毒性。
SARS-CoV-2 S蛋白具有能夠結合神經元受體—煙鹼型乙酰膽鹼受體(nAChR)的蛇神經毒素樣結構域。nAChR是對神經遞質乙酰膽鹼做出反應的受體多肽,存在於許多生物體的中樞和周圍神經系統、肌肉、許多其他組織和免疫系統中;
SARS-CoV-2 S蛋白含有2段與兩種肉毒桿菌神經毒素高度相似的基序;
SARS-CoV-2 S蛋白含有一段與ICAM-1/CD54(細胞間粘附分子1 ,一種跨膜糖蛋白)高度相似的基序,這一基序參與S蛋白對T細胞受體的強烈結合。ICAM-1除在普通內皮細胞、免疫系統細胞的細胞膜上表達外,也在中樞神經系統中人類前腦的白質和灰質中的小膠質細胞、星形細胞以及內皮細胞中表達,它具有血腦屏障的關鍵功能,在精神疾病的發病機制中也具有重要作用。
S蛋白是SARS-CoV-2多重神經毒性,對神經元細胞、神經系統多方位感染、侵襲、損害的關鍵參與者,S蛋白自身也很可能具有神經毒性。
由於SARS-CoV-2 S蛋白能夠作用、模仿眾多人體細胞、蛋白、酶、激素、代謝調節因子、免疫調節因子,僅S蛋白可結合的細胞膜表面受體蛋白就超過30種,因此,SARS-CoV-2 S蛋白可能具有更多其它毒性,包括症狀明顯的致病能力和潛在的長期的人體組織、人體機能損害能力。
SARS-CoV-2與血紅蛋白、血紅素、卟啉
人類血紅蛋白(hemoglobin,Hb)是由2對(4條)血紅蛋白單體—珠蛋白聚合成的異源四聚體,每個珠蛋白(globin)由一條肽鏈和一個血紅素(Heme)連接構成;血紅素由卟啉(porphyrin)和位於卟啉吡咯環中央的亞鐵離子(Fe2+)構成,Heme中央的亞鐵離子能夠可逆地結合1個氧分子;卟啉是一種廣泛存在於動植物、真菌、細菌中的四吡咯環(tetrapyrrole ring)結構,它同時是動物血紅素和植物葉綠素(Chlorophyll)的核心構件。人類血紅蛋白主要存在於紅細胞中。
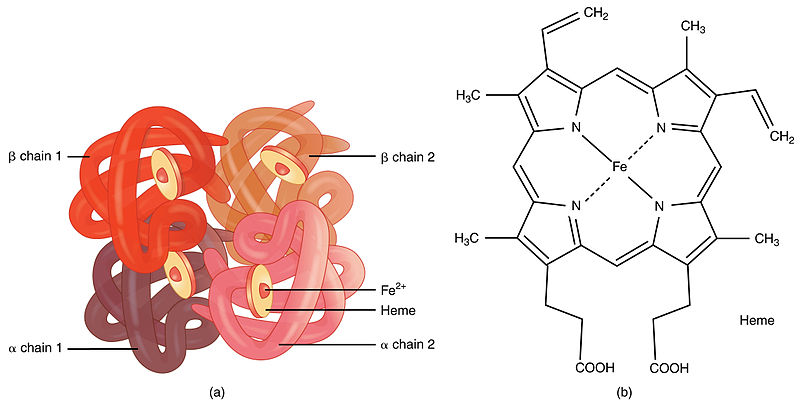
血紅蛋白的簡易結構(a);血紅蛋白中血紅素(Heme)的分子結構(b)。
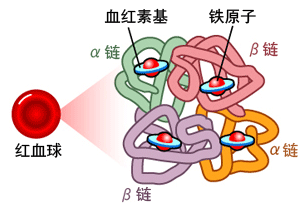
另一個血紅蛋白簡明結構示意圖
SARS-CoV-2能夠以包括S蛋白(spike protein)、N蛋白(nucleoprotein,核衣殼蛋白)、ORF3a蛋白在內的多種結構和非結構蛋白/多肽結合人類血紅蛋白(hemoglobin,Hb),包括紅細胞中的血紅蛋白和游離在血漿中的血紅蛋白;SARS-CoV-2對Hb的結合及其它作用導致重症COVID-19患者Hb水平降低,RBC(Red blood cell,紅血球,即紅細胞)計數降低,RDW升高。
註:RDW,red blood cell distribution width,紅細胞分布寬度,也叫red cell volume distribution width,紅細胞體積分布寬度,是紅細胞體積異質性參數,反應紅細胞大小不均、形態差異化的程度。
SARS-CoV-2能以N蛋白、S蛋白、M蛋白(membrane protein,膜蛋白)、ORF3a 、Nsp3、Nsp7等多種蛋白、多肽結合血紅素(Heme)、卟啉(porphyrin)及血紅素的前體--原卟啉IX(Protoporphyrin IX,PpIX)。
其中,S蛋白和ORF3a蛋白可通過小核糖核酸病毒/杯狀病毒來源的衣殼結構域結合血紅蛋白、血紅素和卟啉。
SARS-CoV-2的ORF3a蛋白含有金黃色葡萄球菌來源的,可結合、吸收血紅素的NEAT(near iron transporter)結構域,以及相同來源的,負責血紅蛋白定位(錨定,即綁定、結合),血紅素結合/捕獲、吸收的IsdA、IsdC 和IsdH等Isd蛋白(Iron-Regulated Surface Determinant protein鐵調節表面決定蛋白)序列。SARS-CoV-2 ORF3a蛋白的NEAT結構域由緊密堆積的IsdA、IsdC、IsdH 域組成。
SARS-CoV-2能以ORF3a 蛋白靶向攻擊/結合血紅蛋白的1-β 鏈促使血紅蛋白釋放血紅素,ORF3a還能夠將血紅素降解為卟啉和鐵,並攝取從血紅素中解離、釋放的亞鐵離子。ORF3a蛋白能夠通過細菌來源的HemS結構域將血紅素直接分離為鐵和卟啉;也能夠通過HemS結構域或另一種細菌來源的ABM結構域先裂解血紅素的四吡咯環結構(cleaving the heme tetrapyrrole ring structure),而後在NADPH-細胞色素P450還原酶存在的情況下降解血紅素並釋放鐵。
SARS-CoV-2的上述機制與金黃色葡萄球菌極為相似,金黃色葡萄球菌首先以幾種Isd 蛋白(IsdA、IsdC 和IsdH/IsdB)靶向結合1-β 鏈降解血紅蛋白、釋放血紅素,繼而,在NADPH 細胞色素P450 還原酶存在的情況下,以兩種血紅素加氧酶IsdG 和IsdI裂解血紅素-卟啉的四吡咯環結構,使金黃色葡萄球菌得以攝取所釋放的亞鐵離子。
SARS-CoV-2 ORF3a蛋白兼具金黃色葡萄球菌幾種Isd蛋白的血紅蛋白降解能力和兩種Isd血紅素加氧酶的血紅素、卟啉裂解/降解能力。
能降解血紅素的不只ORF3a蛋白。SARS-CoV-2 S蛋白能夠模仿人體血紅素加氧酶(heme oxygenase )對血紅素的氧化活性,在抗壞血酸(ascorbic acid/ascorbate,即維生素C/Vitamin C)存在時,催化血紅素緩慢轉化/降解為膽綠素(biliverdin)。
SARS-CoV-2 Spike的血紅素捕獲/結合和氧化活性可能會限制抗體效力,並有助於SARS-CoV-2的免疫逃避(SARS-CoV-2的另一種免疫逃避途徑)。
論文依據一
COVID-19 :Attacks the 1-Beta Chain of Hemoglobin to Disrupt Respiratory Function and Escape Immunity by Capsid-Like System
COVID-19:攻擊血紅蛋白的1-β鏈,通過衣殼樣系統破壞呼吸功能並逃避免疫
https://chemrxiv.org/engage/chemrxiv/article-details/63d134df6bc5ca30b61a9d64
https://www.researchgate.net/publication/367468145_COVID-19_Attacks_the_1-Beta_Chain_of_Hemoglobin_to_Disrupt_Respiratory_Function_and_Escape_Immunity_by_Capsid-Like_System
論文第一版發表於06 March 2020,當前最新版本是第12版,發布於27 January 2023。論文篇幅相當長,涉及廣泛,內容豐富、深刻。以下論文要點基於最新版本。
1、利用MEME Suite(一個序列分析套件)和UniProt數據庫進行序列/基序搜索、匹配、分析,結果表明,SARS-CoV-2 S蛋白含有多種用於多酚結合和硝化監測的結構域,這些結構域包括the metallophos(金屬磷)、PPO1 KFDV(一種存在於植物質體/色素體中的多酚氧化酶)、PPO1 DWL(an intermediate domain of polyphenol oxidase.,一種多酚氧化酶的中間結構域)、sulfatase(硫酸酯酶,一種催化多種硫酸酯水解的磺酶,存在於動物和細菌中)、sulfotransfer 1 domains(苯酚磺基轉移酶結構域1);
S 蛋白中還存在Chitin-binding type-2(幾丁質結合-2 型)、4Fe-4S Wbl-type(一種鐵硫結合結構,多見於放線菌的鐵硫蛋白,放線菌包括鏈黴菌和分枝桿菌)、Sulf translocation domains(硫易位結構域)等結構域。
Chitin-binding type-2(幾丁質結合-2 型)是結合幾丁質(chitin,又叫甲殼質或甲殼素)的結構域,該結構域主要存在於動物和杆狀病毒的蛋白質中。
註:杆狀病毒(baculovirus)是一類雙鏈環狀DNA病毒,屬於杆狀病毒科,杆狀病毒以昆蟲為感染對象,其基因改造產品被廣泛用作殺蟲劑或昆蟲防製劑。
SARS-CoV-2 S 蛋白中的Chitin-binding type-2 結構域來自杆狀病毒中的多角體病毒(polyhedrosis viruse)。Chitin-binding type-2結合幾丁質,幾丁質又能吸附單寧等多酚,而多酚是多角體病毒/杆狀病毒衣殼蛋白構建病毒載體以附着細胞的關鍵分子。後面將說明,S蛋白的幾丁質結合域(即Chitin-binding type-2)使SARS-CoV-2能夠附着到紅細胞表面,由紅細胞搭載在人體內擴散。
2、序列/基序搜索、匹配、分析還表明,SARS-CoV-2 S 蛋白的S1亞基、S2亞基都包含大量衣殼樣結構域(Capsid-like domains)基序(motif)。
這些衣殼樣結構域基序分別來自adenoviruses(腺病毒)、baculovirus (杆狀病毒)、RHDV(rabbit hemorrhagic disease virus,兔出血熱病毒,一種calicivirus/杯狀病毒)、flavivirus (黃病毒,丙型肝炎病毒、寨卡病毒、登革熱病毒都是黃病毒科病毒)、一些dsDNA病毒(雙鏈DNA病毒)、retroviruses(逆轉錄病毒)/HIV(human immunodeficiency virus,人類免疫缺陷病毒,即艾滋病病毒)、HCV(hepatitis C virus,丙型肝炎病毒)、hepatitis B virus(HBV,乙型肝炎病毒)、Nepovirus(神經病毒,豇豆花葉病毒科的一個病毒屬)、picornaviruses(微小核糖核酸病毒,包括脊髓灰質炎病毒、甲型肝炎病毒、口蹄疫病毒等等)、parvovirus(細小病毒)、Rhabdovirus(彈狀病毒)、rotavirus(輪狀病毒)及多種植物二十面體正鏈RNA 病毒(plant icosahedral positive-strand RNA virus)等眾多動物、植物病毒;
S 蛋白S1、S2亞基所包含的大量衣殼樣結構域基序,分別來自上述病毒的capsid protein(衣殼蛋白)、coat protein(外殼蛋白)、envelope PEP protein(囊膜PEP蛋白)、nucleocapsid protein(核衣殼蛋白)、nucleocapsid Gag protein(核衣殼GAG蛋白)、hemagglutinin outer capsid protein(血凝素外衣殼蛋白)、core protein(核心蛋白)、fiber protein(纖維蛋白)及其它蛋白或基因。
SARS-CoV-2 S蛋白通過S1亞基中的某些衣殼樣結構域構建病毒載體(應該是配合幾丁質結合域的載體構建功能);S2蛋白的衣殼樣結構域主要位於富含半胱氨酸的區域,該區域和附近位點主要參與膜融合。
3、SARS-CoV-2 的非結構蛋白ORF3a同樣含有很多上述病毒來源的衣殼樣活性結構域基序,它具有與小核糖核酸病毒類似的衣殼蛋白活性;ORF3a缺乏幾丁質結合結構/功能,它的衣殼蛋白活性不用於構建病毒載體,ORF3a 通過衣殼蛋白活性來偽裝自己,誤導、迷惑血液細胞或免疫細胞。
4、SARS-CoV-2 的結構蛋白S(Spike,刺突)、N(Nucleocapsid,核衣殼)、E(Envelope,包膜),非結構蛋白ORF3a、ORF7b、ORF10、nsp2、nsp3 和RdRP 均具有細菌和線粒體來源的Haem_bd 結構域,其中E和ORF3a的Haem_bd 結構域中含有Heme(血紅素)、卟啉(porphyrin)結合基序CXXC。Haem_bd 結構域存在於大多數細胞色素C 氧化酶(cytochrome C oxidases)中,而細胞色素C 氧化酶存在於細菌和真核生物線粒體中。
注,ORF:Open Reading Frame,開放閱讀框;
RDRP:RNA-dependent RNA polymerase, RNA依賴的RNA聚合酶。
S、ORF3a 的Haem_bd 結構域與衣殼結構域存在(部分)重疊,與Heme 的結合可能會抑制它們的衣殼活性;
E 和ORF3a 以相對穩定的方式與Heme結合,其他(含Haem_bd結構域的)SARS-CoV-2 蛋白與Heme的結合可能不穩定。
5、SARS-CoV-2的多種結構、非結構蛋白含有節肢動物(Arthropod)、環節動物(annelid)來源的Eryth_link_C結構域,以及金黃色葡萄球菌(Staphylococcus aureus)來源的NEAT結構域。其中, S、N、ORF6、ORF7b、ORF8、ORF10、nsp6、nsp10和RdRP含有Eryth_link_C 結構域,S、E、N、ORF3a、ORF6、ORF7a、ORF7b、ORF8、ORF10、2'-O-ribose methyltransferase(2'-O-核糖甲基轉移酶)含有NEAT結構域,S、N、ORF6、ORF7b、ORF8、ORF10同時含有Eryth_link_C結構域和NEAT結構域。這兩種結構域都與血紅蛋白連接/結合有關,它們使SARS-CoV-2具有攻擊血紅蛋白的能力。
註:Eryth_link_C即erythrocruorin linker subunit, C-terminal domain,巨血紅蛋白接頭亞基的C 端域。巨血紅蛋白(Erythrocruorin)是若幹個細胞外血紅蛋白/球蛋白由連接器鏈(linker chain)連接而成的複合物,也叫巨型細胞外血紅蛋白/球蛋白呼吸複合體(giant extracellular hemoglobin /globin respiratory complex),連接血紅蛋白/球蛋白的連接器鏈就是複合體的連接器亞基/接頭亞基(The linker subunit)。SARS-CoV-2 可能利用Eryth_link_C結構域連接/結合人類血紅蛋白(Hemoglobin)及其它球蛋白,如肌紅蛋白(myoglobin)。巨血紅蛋白(Erythrocruorin)存在於大多數環節動物(如水蛭、蚯蚓)、許多節肢動物(如昆蟲)和一些軟體動物(mollusc/mollusk,如肺蝸牛/陸地蝸牛)中,具有這種蛋白的動物(通常)沒有紅細胞。
NEAT(near transporter/near iron transporter,近鐵轉運蛋白)結構域存在於金黃色葡萄球菌的與血紅素吸收有關的多個isd蛋白(Iron-regulated surface determining protein,鐵調節表面決定蛋白)中,負責編碼人類血紅蛋白受體。金黃色葡萄球菌的IsdA、IsdC 和IsdH/IsdB等Isd 蛋白能夠結合人類紅細胞中的血紅蛋白(hemoglobin,Hb)、血漿中游離的血紅蛋白、人類血漿中的觸珠蛋白(haptoglobin,Hp,也叫結合珠蛋白)以及Hb和Hp的複合體,還能降解血紅蛋白,釋放、結合/捕獲血紅素。
SARS-CoV-2 E蛋白中的NEAT結構域較短,具有血紅素捕獲功能;S、N、ORF3a、ORF6、ORF7b、ORF8 和 ORF10 等蛋白具有較長的NEAT結構域,可以結合併捕獲血紅蛋白。
S和ORF3a 蛋白的NEAT結構域與其衣殼結構域存在(部分)重疊,類似與血紅素的結合,與血紅蛋白的結合也可能抑制S和ORF3a的衣殼活性。
註:由其它論文可知,SARS-CoV-2 S蛋白還含有金黃色葡萄球菌的致病抗原結構;SARS-CoV-2 特有的,其S蛋白強烈結合T細胞受體(T cell receptor,TCR)的序列基序(序列片斷),在序列和空間結構上與金黃色葡萄球菌的代謝、分泌物—腸毒素B(SEB)高度相似。腸毒素B是一種強大的超抗原毒素,是公認的化學戰劑、毒素類生物戰劑、生物恐怖製劑。
6、使用MEME Suite比較血紅蛋白降解相關序列與SARs-CoV-2病毒各蛋白序列,結果表明,SARS-CoV-2 的E、ORF3a、ORF7a、ORF7b、ORF8和ORF10 含有致病細菌來源的肽酶S6結構域(Peptidase S6 domain),不過,只有ORF3a中的肽酶S6結構域含有與Gly-Xaa-Ser-Gly-Xaa-Pro基序相似的C-R-S-K-N-P(CRSKNP)基序。
註:Gly-Xaa-Ser-Gly-Xaa-Pro基序在肽酶S6和其它幾個絲氨酸肽酶(serine peptidase)家族,如肽酶S1、S2、S7、S29、S30 中高度保守。
肽酶S6結構域發現於淋病奈特氏菌(Neisseria gonorrhoeae)的IgA(immunoglobulin A,免疫球蛋白A)特異性絲氨酸內肽酶自轉運蛋白(IgA-specific serine endopeptidase autotransporter)、流感嗜血桿菌(Haemophilus influenzae)的IgA1蛋白酶自轉運蛋白(immunoglobulin A1 protease autotransporter),和致病性大腸桿菌(pathogenic Escherichia coli)的血紅蛋白結合蛋白酶自轉運蛋白(hemoglobin binding protease autotransporter)中。
肽酶S6結構域能夠催化血紅蛋白降解,釋放其中的血紅素。
人類 IgA1 蛋白在鉸鏈區被細菌IgA1 蛋白酶切割,細菌IgA1 蛋白酶可能通過裂解人類IgA1蛋白破壞組織粘膜表面的特異性免疫;致病性大腸桿菌的血紅蛋白結合蛋白酶(hemoglobin binding protease ,Hbp)附着在血紅蛋白上,將其破壞,然後與釋放的血紅素結合。
如前所述,ORF3a還具備血紅素結合基序CXXC,同時充當致病細菌的IgA1肽酶和和血紅蛋白結合蛋白酶(Hbp),它通過Hbp 的肽酶S6結構域作用於血紅蛋白,然後通過催化基序C-R-S-K-N-P直接尋找並結合血紅素(這意味着ORF3a兼具血紅蛋白結合、催化血紅蛋白降解、血紅素結合能力)。
ORF3a 蛋白的血紅蛋白蛋白酶結構域(肽酶S6結構域)與其衣殼結構域重疊。
注。目前論文內容的小結:
S蛋白的Eryth_link_C結構域,S、ORF3a蛋白的NEAT結構域,ORF3a蛋白的肽酶S6結構皆可結合血紅蛋白;ORF3a蛋白的肽酶S6結構域可攻擊(催化降解)血紅蛋白;ORF3a蛋白的肽酶S6結構域、Haem_bd 結構域皆可結合血紅素。
7、SARS-CoV-2 ORF3a蛋白既能夠結合、降解血紅蛋白,也能結合、攝取血紅素,ORF3a在收集血紅素之前結合併降解血紅蛋白。ORF3a蛋白具有IsdA、IsdC和IsdH等金黃色葡萄球菌Isd蛋白的血紅素攝取活性。
金黃色葡萄球菌所有參與血紅素結合、吸收(攝取)的Isd蛋白(Iron-Regulated Surface Determinant protein,鐵調節表面決定蛋白)都包含NEAT 結構域,ORF3a也含有NEAT 結構域;金黃色葡萄球菌具有IsdA、IsdC 和IsdH/IsdB等Isd蛋白,它們能夠完成血紅蛋白定位和血紅素結合/捕獲等活動,ORF3a中含有3段分別來自金黃色葡萄球菌IsdA、IsdC和IsdH蛋白的基序。
ORF3a中的IsdH結構域負責定位、連接血紅蛋白,IsdA結構域負責攻擊/降解血紅蛋白並將血紅素從血紅蛋白轉移到IsdC結構域,IsdC結構域負責結合、攝取從血紅蛋白中釋放出的血紅素。
ORF3a 的(幾個)Isd 結構域與其衣殼結構域重疊。ORF3a將在結合血紅蛋白α鏈後以Isd 結構域攻擊血紅蛋白(1-β 鏈)。
8、SARS-CoV-2 ORF3a蛋白還能夠將血紅素降解為鐵和卟啉。ORF3a具有存在於金黃色葡萄球菌的兩種血紅素降解酶(heme-degrading enzyme)IsdG 和IsdI之中,以及結核分枝桿菌(Mycobacterium tuberculosis)的血紅素降解單加氧酶(heme-degrading monooxygenase)之中的ABM 結構域;ORF3a還同時具有來自HemS/ChuX蛋白的HemS結構域,HemS/ChuX是一種可降解血紅素的蛋白質。
註:HemS/ChuX蛋白存在於漢賽巴爾通體(Bartonella henselae ,一種可導致貓抓病的革蘭氏陰性桿菌)、小腸結腸炎耶爾森氏菌(Yersinia enterocolitica)等革蘭陰性桿菌或球桿菌中。同為耶爾森氏菌的鼠疫耶爾森氏菌(Yersinia pestis)的血紅素攝取蛋白為HmuX。
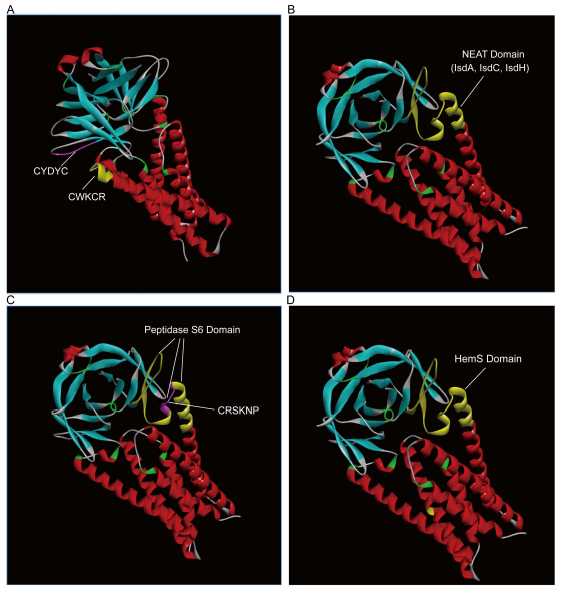
Figure 1. SARS-CoV-2 ORF3a三維晶體結構中Hb、Heme結合、降解相關結構域的分布
a:ORF3a 中兩個相鄰的血紅素結合基序“CWKCR”和“CYDYC”;
b:由緊密堆積的IsdA、IsdC、IsdH 域(基序)組成,定位、結合Hb,攝取Heme的ORF3a NEAT 結構域;
c:催化Hb降解,釋放血紅素的ORF3a 肽酶S6結構域及其中的CRSKNP基序;
d:催化Heme降解為鐵和卟啉的HemS結構域。
在ORF3a蛋白中,肽酶S6結構域與NEAT結構域存在重疊區域;HemS 結構域與NEAT、肽酶S6 和ABM 3個結構域都存在重疊;
金黃色葡萄球菌血紅素降解酶IsdG 和IsdI 中的ABM 結構域在NADPH 細胞色素P450 還原酶(NADPH cytochrome P450 reductase)存在時裂解血紅素四吡咯環結構,並從血紅素中釋放鐵;相關細菌中的HemS/ChuX蛋白催化血紅素中鐵的釋放,而不會破壞四吡咯結構骨幹。不過,在抗壞血酸(ascorbic acid/ascorbate,即維生素C/Vitamin C)或NADPH-細胞色素P450 還原酶等電子供體存在的條件下,HemS 與血紅素結合後,也能在釋放鐵的同時破壞血紅素的四吡咯環結構。
ORF3a蛋白能夠通過HemS結構域將Heme直接分離為鐵和卟啉(保持卟啉的四吡咯環結構);也能在NADPH-細胞色素P450還原酶存在的情況下,通過ABM結構域或HemS結構域以裂解Heme四吡咯環的方式降解Heme並釋放鐵。
ORF3a 的血紅素降解域(ABM、HemS)與其衣殼域存在(部分)重疊。ORF3a 將在結合血紅素後降解血紅素。
9、SARS-CoV-2 ORF3a蛋白的攻擊會降低Hb的氧氣運輸能力,損害人體呼吸功能。
ORF3a 通過類似於Plasmodium falciparum(惡性瘧原蟲)中發現的結構域感染紅細胞,並 與紅細胞膜中的血影蛋白(spectrin)等細胞骨架蛋白結合形成離子通道。ORF3a 的HemS、NEAT、肽酶S6和ABM 結構域在鄰近細胞質的紅細胞內膜中發揮作用。
筆者註:ORF3a 含有惡性瘧原蟲抗原EBA-175 結構域,惡性瘧原蟲通過該結構域結合紅細胞膜上的Glycophorin A(血型糖蛋白A/唾液酸糖蛋白A)。
ORF3a 可能通過NEAT 結構域的IsdH 域(基序)與1-α-Hb 連接,繼而通過肽酶S6結構域改變、降解β-Hb,從1-β-Hb 中釋放血紅素;ORF3a的IsdA 域(基序)負責捕獲脫落的血紅素並將其運輸至IsdC區域(IsdC基序負責結合、攝取從血紅蛋白中釋放出的血紅素);接下來,ORF3a 通過HemS 結構域將血紅素解離成鐵和卟啉(保持卟啉的四吡咯環結構),或者,在NADPH-細胞色素P450 還原酶存在的情況下,ORF3a 通過HemS 或ABM 結構域裂解血紅素的四吡咯環並釋放鐵。受到ORF3a 攻擊的血紅蛋白可能會保留其大部分天然結構域,但氧氣運輸能力降低。
10、SARS-CoV-2 S蛋白含有多個存在於某些低等動物血藍蛋白(Hemocyanin)中的結構域,具體包括:一個Hemocyanin C端域(Hemocyanin_C A)、一個Hemocyanin N端域(Hemocyanin_N A)、三個Hemocyanin 活性域(Hemocyanin_M A、E、F)。S蛋白三個Hemocyanin 活性域中的Hemocyanin_M E、F 中還含有三個銅結合酪氨酸酶區域(Tyrosinase_Cu-bd A-C)。
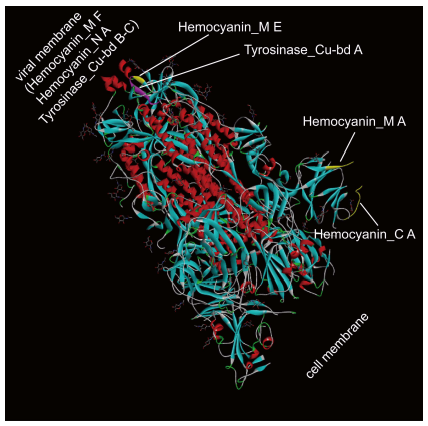
Figure 2. SARS-CoV-2 S蛋白晶體結構中的血藍蛋白結構域分布
血藍蛋白是大部分軟體動物(如章魚、魷魚、貝類、蝸牛)和某些節肢動物(如蠍子、蜘蛛、鱟、龍蝦)的氧氣運輸蛋白及呼吸蛋白。血紅蛋白主要存在於紅細胞中,而血藍蛋白則游離存在於類似血液的血淋巴中;血紅蛋白的氧結合金屬是鐵,血藍蛋白是銅。人類和絕大多數哺乳動物只有血紅蛋白,沒有血藍蛋白(SARS-CoV-2 來自蝙蝠、穿山甲,還是軟體動物、節肢動物?)。
位於跨膜區域的Hemocyanin_N A具有酚氧化酶活性,能夠氧化多酚;Hemocyanin_N A的酚氧化酶活性與3個Tyrosinase_Cu-bd的銅結合活性相互依賴。位於病毒包膜外部的Tyrosinase_Cu-bd A首先與Cu 結合,使S 構象發生改變,暴露出跨膜區域,這時Hemocyanin_N A才有機會發揮酚氧化酶活性;暴露出的Hemocyanin_N A隨後充當Tyrosinase_Cu-bd B、C的Cu結合位點,促成二者與Cu結合(進而利用Cu結合氧分子)。Hemocyanin_N A與Tyrosinase_Cu-bd 的協作使S蛋白兼具血藍蛋白的酚氧化酶活性和氧氣結合、運輸能力。
11、SARS-CoV-2原型病毒(早期病毒株)、Delta變體、Omicro變體S蛋白中的血藍蛋白結構域存在差異。
三種S蛋白都具有酪氨酸酶Cu結合位點,因此它們均可充當氧氣載體運輸氧分子。
Delta S 的銅結合位點(包括Tyrosinase_Cu-bd A)高度暴露,因此具有更強的酚氧化酶活性(這可能是Delta毒力更強的原因之一);Delta S的S1亞基易於接近銅結合位點,因此Delta S同時具有更強的氧運輸能力。這也許可以解釋,為什麼(Delta毒力更強,)Delta 患者比原型SARS2患者病毒載量更高,但呼吸窘迫程度卻反而較低;
Omicro S 發展成為一種血藍蛋白樣蛋白,它能夠攜帶氧分子,但由於只具有兩個酪氨酸酶_Cu-bd結構域(缺少Tyrosinase_Cu-bd C)而無法完全實現細胞凝集和酚氧化酶活性,這或許可以解釋為什麼Omicro 患者嚴重症狀較少且沒有明顯的呼吸窘迫。
12、依前所述,SARS-CoV-2 ORF3a蛋白中參與Hb、Heme結合、捕獲、攻擊、降解/分解的結構域包括haem_bd、NEAT、peptidase S6、IsdA、IsdC、IsdH、ABM、HemS等。
Omicro的ORF3a蛋白內沒有突變位點;Delta的ORF3a蛋白只有兩個單點突變,這兩個單點突變都在上述結構域之外,因此,Omicro、Delta與SARS-CoV-2 原型病毒在ORF3a蛋白的Hb、Heme結合、捕獲、攻擊、降解/分解能力方面應當沒有差異。
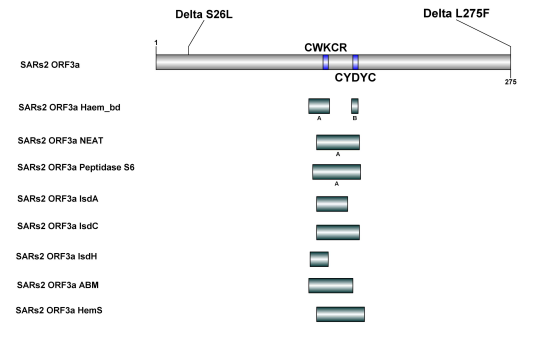
Figure 4. SARS-CoV-2原型病毒及Delta、Omicro變體中作用於Hb、Heme的結構域
13、SARS-CoV-2 S蛋白的S1亞基通過幾丁質結合域(Chitin-binding type-2)結合幾丁質(甲殼質/甲殼素),而後利用幾丁質吸附多酚和鐵,並通過多酚結合域構建鐵-多酚絡合物(Fe-polyphenol complexes),再以鐵-多酚絡合物為介質附着到紅細胞的細胞膜上。這一過程在Figure 5中對應標記“Get On”(上車)的“虛線框”。
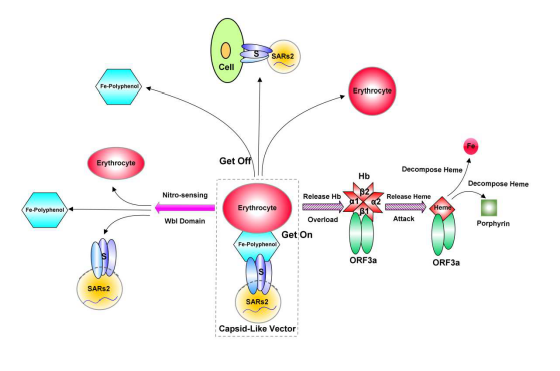
Figure 5. SARS-CoV-2 S、ORF3a 協同工作,延遲免疫反應並損害呼吸系統機制示意圖。
附着到紅細胞細胞膜上的SARS-CoV-2 搭乘紅細胞的“便車”到達機體各組織。在組織細胞附近,S蛋白通過所含的血藍蛋白N端域(Hemocyanin_N A)或植物質體/色素體來源的PPO1 KFDV結構域的多酚氧化活性氧化多酚,將鐵-多酚絡合物降解、釋放,SARS-CoV-2從紅細胞細胞膜上脫落。“到站下車”後,SARS-CoV-2將感染周邊組織細胞。這一過程在Figure 5 中以“Get Off”(下車)指示。
搭乘紅細胞“便車”使SARS-CoV-2 得以在人體內高效、廣泛擴散並欺騙、逃避免疫系統偵測(SARS-CoV-2多種免疫逃避機制/途徑之一)。
過多SARS-CoV-2顆粒的粘附(Overload)會導致紅細胞釋放血紅蛋白(Release Hb),釋放的Hb與NO(一氧化氮)結合,以RNS(reactive nitrogen species,活性氮類/活性氮)自由基攻擊S蛋白。
SARS-CoV-2 S蛋白中放線菌鐵硫蛋白(Actinomyces iron-sulfur protein)來源的4Fe-4S Wbl-type鐵硫結合結構域對一氧化氮 (NO) 極其敏感,其亞硝化監測、硝基傳感(Nitro-sensing)功能使SARS-CoV-2 能夠逃避免疫細胞及紅細胞的RNS自由基攻擊(SARS-CoV-2另一種免疫逃避機制/途徑)。
為保護S 蛋白,ORF3a蛋白主動與Hb結合(可能通過ORF3a中的NEAT、IsdH、肽酶S6等結構域),然後通過isd(IsdA)結構域和血紅蛋白酶(hemoglobinase)攻擊血紅蛋白1-β鏈,釋放其中的血紅素(Release Heme)。(以IsdC結構域結合、攝取釋放出的血紅素後,)ORF3a繼而通過hemS結構域將血紅素並將其分解為鐵和卟啉(保持四吡咯環結構),或在NADPH-細胞色素P450 還原酶存在的情況下,通過HemS 或ABM 結構域裂解血紅素的四吡咯環並釋放鐵。ORF3a對血紅蛋白、血紅素的攻擊、破壞會損害呼吸功能,不過,S蛋白血藍蛋白功能域的氧輸送能力可以緩解感染者的呼吸功能障礙。
14、SARS-CoV-2 S蛋白具有脊髓灰質炎病毒(poliovirus)等小核糖核酸病毒(picornavirus)的衣殼蛋白活性,SARS-CoV-2 可能和這些病毒一樣,也能直接穿透細胞膜(無須通過受體結合)。能夠直接穿透宿主細胞膜的病毒還有HIV。
SARS-CoV-2可能通過結合卟啉(porphyrin)或血紅素穿透細胞膜,直接進入人體細胞。卟啉能夠產生破壞細胞膜的活性氧(reactive oxygen species,ROS),卟啉化合物(porphyrin compounds)具有很強的細胞膜定位和穿透能力。卟啉化學物質,例如合成卟啉光敏劑,經常用於治療癌症,卟啉產生的活性氧(ROS)可以殺死腫瘤細胞。卟啉在人體內主要存在於血紅蛋白內的血紅素中(血紅素是結合亞鐵離子的卟啉)。
15、血紅蛋白水平越高,發病率越高。正常男性的血紅蛋白含量明顯高於正常女性,糖尿病患者的糖化血紅蛋白(即脫氧血紅蛋白,是血紅蛋白和血糖的結合體)較高,這可能是男性和糖尿病患者COVID-19患病(和重症)風險更高的原因之一。ORF3a協同(S蛋白)攻擊血紅蛋白β鏈上的血紅素,含氧血紅蛋白和脫氧血紅蛋白都會受到病毒攻擊,但後者(可能)更容易受到攻擊。
16、現有記錄表明,COVID-19危重患者體內存在過多的游離鐵,這可能是SARS-CoV-2與鐵競爭卟啉,抑制血紅素合成代謝所造成的。
體內卟啉代謝紊亂引起卟啉症,HIV、丙型肝炎病毒(hepatitis C virus,HCV)都能引起卟啉症。大量臨床觀察顯示,COVID-19患者也存在與卟啉症一致的皮膚和神經系統症狀。SARS-CoV-2 病毒蛋白可能具有尿卟啉原III 合酶(uroporphyrinogen III synthase)活性,並通過產生類血紅素(comparable heme)來促進感染。尿卟啉原III 合酶是一種血紅素生物合成酶,它的遺傳異常會導致先天性紅細胞生成性卟啉症(congenital erythropoietic porphyria)。
17、SARS-CoV-2具有高度致癌性。
我們發現,SARS-CoV-2的S蛋白等蛋白質具有黑色素瘤結構域(melanoma domain),許多惡性腫瘤,包括肺癌,都具有包含黑色素瘤結構域的致病蛋白;SARS-CoV-2的S蛋白等蛋白質還含有p53結構域,當P53 蛋白突變時,正常細胞可能會發展成癌細胞。
大量已發表的研究表明,癌症患者感染COVID-19 後,癌症惡化的總體風險會增加;大量臨床研究已證實,COVID-19 患者表現出與氧化應激損傷(oxidative stress damage)一致的症狀。在嚴重氧化應激的情況下,患者的ROS(reactive oxygen species,活性氧/活性氧類)控制機制變得紊亂。活性氧(ROS)失調是致癌的關鍵因素。
COVID-19死者的肺部充滿粘液,惡化的肺組織(形態)類似於腺癌樣改變。
基於這些綜合特徵,我們認為 SARs-CoV-2 病毒具有高度致癌性。
18、COVID-19患者可能表現出醌中毒和色素過度沉着症狀
如前所述,SARS-CoV-2 S蛋白含有植物質體/色素體來源的多酚氧化酶PPO1 KFDV結構域;S蛋白還含有軟體動物、節肢動物血藍蛋白(Hemocyanin)來源的,同樣具有酚氧化酶活性的Hemocyanin N端域(Hemocyanin_N A)和三個銅結合酪氨酸酶區域(Tyrosinase_Cu-bd A-C)。
酪氨酸酶(Tyrosinase)和酚氧化酶(Phenoloxidase)可將酪氨酸和多巴胺等酚類物質轉化為苯醌。苯醌是一種高刺激性的生化物質,吸入後會引起中毒,導致燒灼感、咳嗽、氣短、頭痛及全身疼痛症狀。COVID-19/Omicron 患者喉嚨、肌肉和關節的劇烈疼痛,很大程度上就是苯醌造成的,而苯醌則是S 蛋白酪氨酸酶活性和酚氧化酶活性的產物。
一些受病原體感染的低等物種也會出現色素沉着。血藍蛋白的胞外酚氧化酶(extracellular phenoloxidase)或酚氧化酶活性是導致貝類(shellfish)、褐藻(brown algal)?、挪威龍蝦(Nephrops norvegicus/Norway lobster)色素過度沉着/黑變病(hyperpigmentation/melanosis)的主要原因。
接受 ECMO 搶救的COVID-19 患者皮膚明顯變黑。COVID-19的眾多皮膚病症狀包括:蕁麻疹、融合性紅斑/斑丘疹/麻疹樣皮疹、丘疹性皮疹、凍瘡樣皮損、網狀青斑/葡萄狀樣斑和紫癜“血管炎”。與某些嚴重皮膚病相關的紅斑可能會轉化為色素沉着過度。COVID-19眼部感染患者會出現單側急性後多灶性板層色素上皮病。 COVID-19患者存在雙側角膜內皮色素沉着、前房色素分散、虹膜色素脫失伴虹膜透照異常。
黑色素通過影響宿主細胞因子/趨化因子的產生直接或間接影響炎症反應。
筆者註:COVID-19 患者的色素沉着也可能與其它因素,如急性腎損傷(Acute kidney injury ,AKI)有關。
19、現有血氧檢測方法存在缺陷,僅考慮和高估了血紅蛋白的供氧狀態,忽略了SARS-CoV-2 S蛋白類似血藍蛋白的氧氣結合、攜帶能力。
(未完待續)















