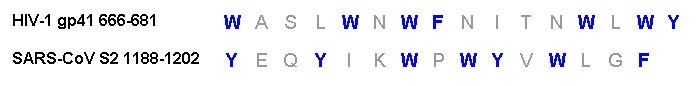他們扮瞎、裝聾、作啞,不調查、不討論、不聲張、不宣傳,不回應、不澄清,不等於它們不存在。
筆者相信,有良知,有正義感、責任感,有鐵肩道義的媒體人不會迴避、冷處理、冷漠對待理性客觀,邏輯嚴謹,證據堅實、充分,內容翔實、深刻,不可多得的溯源作品,不會對新冠病毒諸多隱性、長期的重大危害閉目塞聽、無動於衷。筆者相信,有良知、有責任感的媒體人會熱情鼓勵對新冠來源真相的探查、挖掘、揭示,會高度關注,積極展示、傳播溯源的重大發現、重大證據、重大線索、重大疑點,會大力支持溯源研究、討論、爭鳴和觀點對撞。
冠狀病毒擁有最大的RNA基因組,可提供充裕的基因改造空間,便於在同一病毒中引入、模仿、拼接、疊加、整合、集成種種來源的跨物種基因,在同一病毒中實現、匯集各種各樣的感染、致病、免疫對抗(免疫破壞、免疫逃避和免疫屏蔽、免疫干擾和免疫抑制)機制。冠狀病毒是理想的基因工程、基因改造對象,是製造超級病原體的最佳底版。
SARS-CoV-2繼承、借鑑、整合、匯集了多種冠狀病毒的基因、蛋白結構;
SARS-CoV-2引入、模仿、匯集了大量各科屬非冠狀病毒的基因、蛋白、抗原結構;
SARS-CoV-2引入、模仿了眾多非病毒微生物(致病細菌和微生物寄生蟲)的基因、蛋白、抗原結構;
SARS-CoV-2含有多個與人類完全相同或高度相似,並在感染、致病中發揮重要作用的基因、蛋白結構,SARS-CoV-2還具有其它一些模仿人類蛋白、多肽結構及特定功能的基因、蛋白結構;
SARS-CoV-2含有某些低等動物特有的基因、蛋白結構;
SARS-CoV-2含有植物特有的基因、蛋白/多肽結構;
SARS-CoV-2含有與細菌(分泌)毒素、動物(分泌)毒素高度相似或功能相同的基因序列/氨基酸序列;
SARS-CoV-2還含有與醫療藥劑高度相似的基因序列/氨基酸序列,以及與生物醫學專利完全匹配的基因序列。
SARS-CoV-2是廣為參照、借鑑(包括不加改動地抄襲、復用重要序列)、廣為移植、模仿,廣為優化、整合的基因工程恢弘巨製,是身披冠狀病毒軀殼的跨物種基因、跨生物界基因、超生物基因聚合體,是病原體轉基因改造集大成者。
I SARS-CoV-2對冠狀病毒基因的繼承、借鑑、模仿、優化、集成
CoVZC45/CoVZXC21
蝙蝠冠狀病毒CoVZC45或CoVZXC21為SARS-CoV-2提供了冠狀病毒軀殼、主要病毒骨架和改造底板。
CoVZC45、CoVZXC21從中國浙江舟山的小菊頭蝠樣本中分離獲得,樣本收集時間分別為2017年2月、2015年7月,它們的全基因組序列上傳並實現國際共享的時間都是2018年1月。這兩種蝙蝠冠狀病毒高度相似,二者全基因組序列一致性約為97.48%。
SARS-CoV-2與CoVZC45/CoVZXC21多種蛋白高度相似。
CoVZC45、CoVZXC21、SARS-CoV與SARS-CoV-2的基因、蛋白一致性
註:圖中的SARS-CoV GZ02是SARS疫情(2002年11月-2003年9月)早期於廣州收集、鑑定的SARS流行病毒株。
由圖可見,SARS-CoV-2與CoVZC45 E蛋白(Envelope protein,包膜蛋白)aa序列(amino acid sequence,氨基酸序列)一致性(identity,同一性/一致度/相似度)為100%,M蛋白(Membrane protein,膜蛋白)一致性為98.6%,二者N蛋白(Nucleocapsid protein,核衣殼蛋白)、ORF1ab(open reading frame 1ab,開放閱讀框1ab)多蛋白基因,以及ORF3、ORF7、ORF10、ORF14等輔助蛋白的一致度也都大於90%。二者S蛋白(Spike protein,刺突蛋白)、ORF9b(舊稱ORF13)蛋白的一致度較低,分別為80.2%、73.2%,與其它蛋白的一致度存在較大反差。
SARS-CoV-2與CoVZC45全基因組序列(核苷酸序列)一致度約為87.6%,與CoVZXC21全基因組序列一致度約為87.5%。
SARS-CoV-2、CoVZC45多種蛋白一致度大於90%,但S蛋白的一致度僅為80.2%,這意味着SARS-CoV-2的S蛋白經歷了較多改造,引入了更多非CoVZC45基因。兩種病毒S蛋白兩個亞基的一致度更不均衡,二者S蛋白S2亞基(膜融合亞基,spike的後半部分)的一致性高達95%,而S1亞基(受體結合亞基,spike的前半部分)的一致性卻低至69%。近親病毒間同一蛋白組件相似度如此不協調,反差如此巨大,這對自然演化來說極為反常的,這表明,SARS-CoV-2 S1亞基經歷的基因編輯、改造遠多於S2亞基。
SARS-CoV
SARS-CoV是SARS-CoV-2 的另一個重要參照模板,它與CoVZC45/CoVZXC21共同作為SARS-CoV-2的基本病毒骨架、基本改造底板。
由前一小節中的配圖可見,SARS-CoV與SARS-CoV-2全基因組序列、各蛋白基因序列(核苷酸序列)、各蛋白aa序列的一致性皆低於CoVZC45/CoVZXC21(ORF1b部分略高於CoVZXC21);然而,SARS-CoV-2 的感染、致病能力、特性卻與SARS-CoV,而非CoVZC45/CoVZXC21相似,CoVZC45、CoVZXC21雖然“宏觀上”與SARS-CoV-2更相像,但二者都沒有人類感染、致病能力。
蝙蝠因攜帶多種冠狀病毒而成為人禍的最佳背鍋對象。有必要指出,已知的蝙蝠冠狀病毒無一具有人類致病能力。少數蝙蝠冠狀病毒雖然具有ACE2結合能力和人體細胞進入能力,但它們在人體內不能有效複製,不能持續存在;截止2020年,已知的人類致病冠狀病毒只有7種,它們與蝙蝠冠狀病毒可能存在進化淵源,但它們自身都不是蝙蝠冠狀病毒;已知的蝙蝠冠狀病毒無一可使人體產生臨床疾病症狀。真正危險、邪惡的不是蝙蝠或蝙蝠冠狀病毒,而是人,對蝙蝠冠狀病毒實施G-o-F(Gain-of-Function)改造的人,介入、支持改造研究的人,對真相心知肚明但聲稱基因改造病毒是蝙蝠冠狀病毒自然進化產生的人。
SARS-CoV-2、SARS-CoV全基因組序列一致性約為79%,Spike蛋白aa序列一致性約為76.47%,Spike蛋白S1亞基aa序列一致性約為64.85%,S1亞基RBD(receptor-binding domain,受體結合域)aa序列一致性約為73%–76%,二者RBD決定ACE2結合能力的五個關鍵氨基酸僅有一個相同。可見,雖然互為“近親”,但SARS-CoV-2與SARS-CoV差異很大,通過自然演化來消除兩者間的差異,也許需要上百萬年、上千萬年,然而,從2002年SARS-CoV突然出現之後又突然消失,到2019年SARS-CoV-2出現,只用了17年。沒有可作為它們共同祖先的病毒,沒有過渡銜接的病毒。
儘管差異很大,儘管進化距離非常遙遠,但是,SARS-CoV-2許多關鍵/重要的感染、致病結構,感染、致病能力繼承或優化自SARS-CoV。
1、SARS-CoV-2繼承、提升了SARS-CoV的ACE2結合能力。
SARS-CoV-2、SARS-CoV的Spike蛋白都具有很強的ACE2結合能力,並且,二者Spike蛋白S1亞基與ACE2的結合複合體非常相似。相比之下,CoVZC45、CoVZXC21都不具備有效的ACE2結合能力和人體細胞進入能力。
SARS-CoV-2 的ACE2結合能力比SARS-CoV更強大,德克薩斯大學奧斯汀分校的一項研究指出,SARS-CoV-2 Spike的ACE2結合親和力比SARS-CoV Spike高10-20倍(也有研究認為,SARS-CoV-2 RBD的ACE2結合親和力高於SARS-CoV RBD,但Spike整體/full-length spike的ACE2結合親和力與SARS-CoV-2 Spike相當或略低)。下一篇文章將說明,SARS-CoV-2決定ACE2結合能力的五個RBD關鍵氨基酸借鑑自蝙蝠冠狀病毒WIV1(rs3367)。
2、SARS-CoV-2繼承、優化了SARS-CoV與HIV-1高度相似的膜融合蛋白和膜融合介導機制。
HIV-1(human immunodeficiency virus-1,人類免疫缺陷病毒-1/ 艾滋病病毒)是逆轉錄科慢病毒屬病毒,它是SARS-CoV-2最重要的非冠狀病毒參照、借鑑、模仿對象,SARS-CoV-2、HIV-1之間存在着驚人的眾多相似和關聯,其中一部分相似、關聯在SARS-CoV-1(SARS-CoV)、HIV-1之間其實已經存在(但幾乎不被提及)。
SARS-CoV-1 的膜融合蛋白-S2蛋白(即Spike蛋白的S2亞基)與HIV-1的膜融合蛋白-gp41蛋白之間不存在序列同源性(sequence homology,指顯著的序列相似性),然而,gp41蛋白的所有重要元件在S2蛋白中都存在,而且,兩種蛋白構造上高度相似。
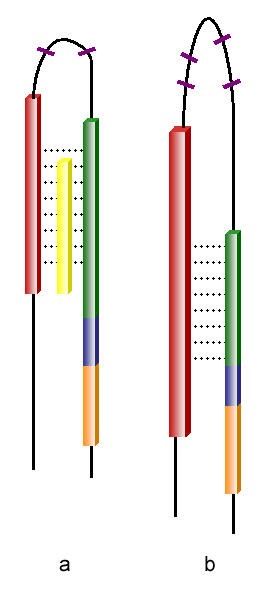
HIV-1 gp41蛋白(a)、SARS-CoV-1 S2蛋白(b)構造對比圖
由上圖可見:
1)HIV-1 gp41蛋白、SARS-CoV-1 S2蛋白都含有兩個七肽重複區域(heptad repeat,HR)N-HR、C-HR ,S2蛋白的N-HR比gp41蛋白的N-HR更長。兩種蛋白的N-HR(N-terminal heptad repeat,N 端七肽重複區域)在圖中顯示為紅棕色,C-HR(C-terminal heptad repeat,C 端七肽重複區域)顯示為綠色。
註:N 端,NH2端,氨基端;C端,COOH端,羧基端。
2)在兩個七肽重複區域(HR)之間的(半)環上,HIV-1 gp41蛋白、SARS-CoV-1 S2蛋白都具有限制環的髮夾構象(hairpin conformation)的半胱氨酸殘基(Cysteine residues,C)和脯氨酸殘基(Proline residues,P)。gp41蛋白環結構上有2個半胱氨酸殘基(C)、1個脯氨酸殘基(P);S2蛋白兩個HR間的環結構更長,含有4個半胱氨酸殘基(C)、9個脯氨酸殘基(P)。環結構上的半胱氨酸殘基(C)在圖中以紫色短線表示,脯氨酸殘基(P)在圖中未顯示。
3)在C-HR(綠色)和跨膜區域/片斷(transmembrane segment,橙色)之間,gp41蛋白、S2蛋白都含有一段富含芳香族殘基的區域(aromatic residue-rich regions),這一區域在圖中顯示為藍色。
在兩種蛋白的富含芳香族殘基區域,蛋白中通常相對稀有的芳香族殘基都約占區域內氨基酸殘基總數的一半,如下圖所示:
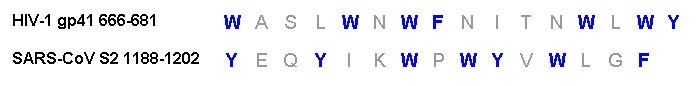
HIV-1 gp41蛋白、SARS-CoV-1 S2蛋白富含芳香族殘基區域的aa序列
圖中藍色氨基酸殘基W、F、Y為芳香族殘基。
W:Tryptophan,Trp,色氨酸;
F:Phenylalanine,Phe,苯丙氨酸;
Y:Tyrosine,Tyr,酪氨酸。
芳香族殘基即芳香族氨基酸殘基,芳香族氨基酸(Aromatic amino acids)指含有芳香環的氨基酸,包括苯丙氨酸、色氨酸、酪氨酸、組氨酸四種氨基酸。
在前面gp41蛋白、S2蛋白構造對比圖中,擺放在gp41蛋白N-HR、C-HR之間的黃色棒體不是gp41蛋白的一部分,它表示抗艾滋病藥物Enfuvirtide(恩夫韋肽)。Enfuvirtide,也叫T-20,商品名Fuzeon,1996年開始研發,1999年完成研發,是參照HIV-1 gp41蛋白C 端七肽重複區域(C-HR)aa序列設計的可結合N-端七肽重複區域(N-HR)並有效抑制HIV-1膜融合活性的合成肽(N-HR、C-HR需要相互作用結合形成六螺旋束來介導膜融合,Enfuvirtide通過結合N-HR來競爭、干擾C-HR與N-HR的結合,阻礙六螺旋束的形成)。Enfuvirtide同樣可結合SARS-CoV-1 S2蛋白,並被用作SARS-CoV-1 融合抑製劑;它還被證明可強力結合SARS-CoV-2 的S2蛋白,並被建議作為強效SARS-CoV-2融合抑製劑用於COVID-19臨床治療。Enfuvirtide在SARS-CoV-1、SARS-CoV-2 S2蛋白中的作用、結合區域應該也是N-HR(HR1)。
Enfuvirtide的問世可能標識着科學界已經深入認識了HIV-1的膜融合機制;Enfuvirtide研發成功的同一年,Ralph S. Baric等人發明了基於基因序列合成冠狀病毒的反向遺傳系統,次年(2000)發表了論文;又兩年之後的2002年,SARS-CoV出現。
SARS-CoV-1 S2蛋白、HIV-1 gp41蛋白還具有其它相似性。
雖然不存在顯著序列相似性(同源性),但兩種蛋白兩個七肽重複區域N-HR、C-HR的aa序列(amino acid sequence,氨基酸序列)具有相似的螺旋輪結構(helical wheel structure)。螺旋輪結構/螺旋輪圖是螺旋輪分析(helical wheel analysis)的結果圖,螺旋輪分析是以螺旋輪方式(也是一種密碼編碼方法)排列蛋白/多肽aa序列中的氨基酸(殘基),以表現、分析蛋白/多肽中的α-螺旋。
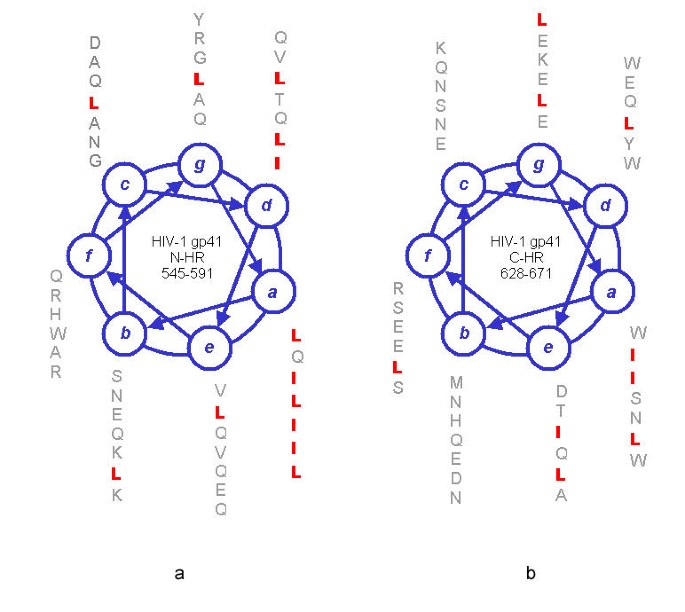
HIV-1 gp41蛋白N-HR、C-HR aa序列的螺旋輪圖
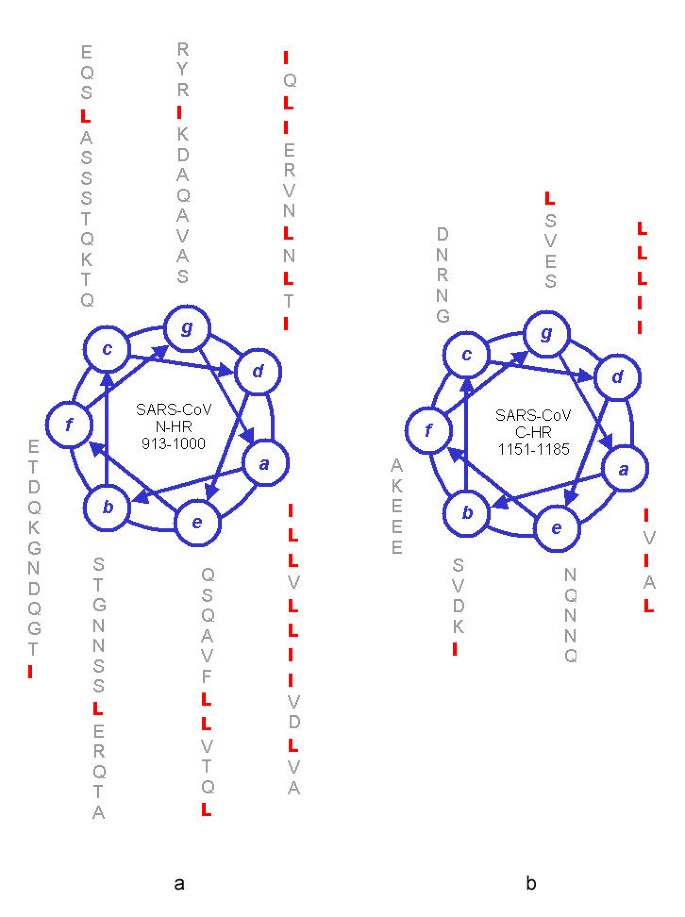
SARS-CoV-1 S2蛋白N-HR、C-HR aa序列的螺旋輪圖
此外,SARS-CoV-1 S2蛋白9個連續α螺旋(nine successive alpha-helices)中的2個(對應aa序列片斷P879-N942)還與HIV-1 gp41蛋白中的2個α螺旋高度吻合(S2 and gp41 share the same two α helices)。
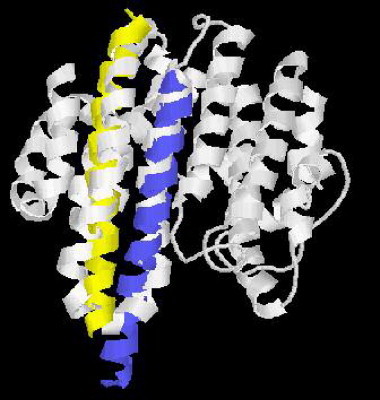
SARS-CoV S2蛋白(白色)3-D模型、HIV-1 gp41蛋白局部3-D模型疊加圖
由圖可見,gp41蛋白黃色和藍色的兩個α螺旋與S2蛋白中的兩個白色α螺旋高度吻合、重疊。
gp41蛋白是HIV-1 gp160蛋白的兩個亞基之一,gp160蛋白是HIV-1的Env蛋白(Envelop protein,包膜蛋白),它在功能上對應冠狀病毒的Spike蛋白。gp160蛋白的另一個亞基是gp120蛋白,gp120是受體結合亞基,gp41是膜融合亞基,它們在功能上分別對應冠狀病毒Spike蛋白的受體結合亞基-S1亞基、膜融合亞基-S2亞基。
SARS-CoV-1 S2蛋白與HIV-1 gp41蛋白的高度構造相似性可能緣於它們有共同的病毒遠祖,或者,可能是自然演化的巧合,SARS-CoV-1 S2蛋白也可能是HIV-1 gp41蛋白的仿製品。
逆轉錄病毒gp41蛋白、冠狀病毒S2蛋白都屬於I類融合蛋白(Class I Fusion Proteins),I型病毒融合蛋白具有一些共同特徵,如都包含兩個七肽重複區域等等;但是,S2蛋白與HIV-1 gp41蛋白的高度構造相似性(至少其中一部分)應該為SARS-CoV-1(、SARS-CoV-2)所專有,兩篇指出SARS-CoV-1 S2蛋白、HIV-1 gp41蛋白前述高度(構造)相似性的論文,絲毫未提及其它冠狀病毒S2蛋白與HIV-1 gp41蛋白的相似性。
上面指出的是SARS-CoV-1、HIV-1融合蛋白間的高度構造相似性。那麼,SARS-CoV-2是否繼承、保持了SARS-CoV-1 S2蛋白(S2亞基)與HIV-1 gp41蛋白之間的高度構造相似性呢?
1)SARS-CoV-2 、SARS-CoV-1 S2蛋白有很高的序列相似性。二者Spike蛋白S1亞基aa序列一致性僅為64.85%,但是,S2亞基一致性高達90.10%;
2)SARS-CoV-2、SARS-CoV-1 S2亞基共有高度序列相似的兩個七肽重複區域(N-HR1、C-HR,也叫HR1、HR2),以及C-HR和跨膜區域之間的富含芳香族殘基區域。二者N-HR(HR1)區域的aa序列一致性約為92.05%,二者這一區域的88個氨基酸殘基中的前13個部分相同,後75個完全相同;二者C-HR(HR2)區域+富含芳香族殘基區域的aa序列一致性約為98.08%,二者這兩個區域的共52個殘基僅有一個不同。
3)SARS-CoV-2全部保持了SARS-CoV-1 N-HR(HR1)、C-HR(HR2)間環結構中的4個半胱氨酸(C)殘基、9個脯氨酸殘基(P),二者兩個HR間環結構區域的aa序列一致性約為92.76%;
由此推斷,SARS-CoV-2 S2亞基應該繼承、保持了SARS-CoV-1 S2亞基與HIV-1 gp41亞基的高度構造相似性。
註:上述比對結果所用SARS-CoV-2 Spike蛋白genbank accession number:YP_009724390.1/1796318598,對應Wuhan-hu-1毒株;SARS-CoV Spike蛋白genbank accession number:AAP13441.1,對應SARS Urbani毒株。
HIV-1、SARS-CoV-1、SARS-CoV-2的膜融合機制也高度相似:都通過兩個七肽重複區域N-HR、C-HR的相互作用、重新摺疊形成六螺旋束(six-helical bundle,6-HB)結構,六螺旋束將病毒包膜與細胞膜/內體膜/溶酶體膜拉近,從而導致膜融合。不過,這一膜融合機制並非三種病毒專有,它應該為I類包膜病毒(type I enveloped viruse)所共有。I類包膜病毒包含許多高致病性逆轉錄病毒、冠狀病毒、流感病毒、副粘病毒和絲狀病毒,它們的融合蛋白為I類融合蛋白。
通過在S1/S2處(S1、S2亞基交界處)插入furin酶切位點(furin cleavage site,FCS),SARS-CoV-2優化了SARS-CoV-1的膜融合、感染、複製過程。由於存在S1/S2處的FCS,完成受體結合後,SARS-CoV-2的Spike可在細胞外被furin蛋白酶水解切割,暴露S2亞基,激活其膜融合活性,介導病毒包膜直接與細胞膜融合,第一時間將病毒包膜內的病毒RNA釋放到細胞內(細胞質中),啟動病毒複製。
SARS-CoV-2 Spike蛋白、HIV-1 gp160蛋白都具有FCS,二者的FCS都恰好位於Spike/gp160兩個亞基的交界處,SARS-CoV-2、HIV-1都可通過直接膜融合達成高效感染。
儘管膜融合蛋白構造、膜融合機制與HIV-1高度相似,但SARS-CoV-1的Spike沒有FCS,不能在細胞外被水解切割,它的病毒包膜不能與細胞膜直接發生膜融合。完成受體結合後,SARS-CoV-1將被整體內吞,其Spike將在細胞內被組織蛋白酶B或L(CatB/L)水解切割,而後,病毒包膜再與內體膜或溶酶體膜發生膜融合以釋放病毒RNA,啟動病毒複製。SARS-CoV-1內吞+細胞內膜融合的感染效率遠低於SARS-CoV-2/HIV-1細胞外直接膜融合的感染效率,SARS-CoV-2的感染效率約是SARS-CoV-1的100~1000倍。
3、SARS-CoV-2繼承了SARS-CoV的2個肉毒桿菌神經毒素樣基序,1個人類ICAM-1樣基序。
xxx樣基序(xxx-like motif),指與xxx aa序列(amino acid sequence,氨基酸序列)相似,對應的多肽鏈空間結構也相似並具有共同生物功能/能力的基序,基序,可理解為具有特定功能的一個aa序列片斷或一組鄰近的aa序列片斷。肉毒桿菌神經毒素樣基序,即與肉毒桿菌神經毒素(Botulinum neurotoxin)aa序列相似,多肽鏈空間結構相似,並具有肉毒桿菌神經毒素生物功能/能力的序列片斷。
SARS-CoV-2 Spike蛋白含有2個肉毒桿菌神經毒素樣基序(簡記為neurotoxin-like motif),S1亞基、S2亞基內各有一個。其中,位於S1亞基內,對應Spike蛋白T299 ~Y351序列片斷,與G型肉毒桿菌神經毒素前體(Botulinum neurotoxin type G precursors)相似的基序能夠強力結合TCR(T cell receptor,T細胞受體),並觸發強烈的T細胞免疫反應。非常巧合的是,SARS-CoV-2 Spike中的這2個neurotoxin-like motifs在SARS-CoV-1 Spike中的對應序列同樣也是neurotoxin-like motif,2對基序的一致度分別為75%、84%。這可以解讀為,SARS-CoV-2 繼承了SARS-CoV-1的2個neurotoxin-like motifs,並對其作了某些調整、優化。SARS-CoV-1 Spike共有3個neurotoxin-like motifs,它的另一個基序在SARS-CoV-2 Spike中的對應序列不是neurotoxin-like motif。
SARS-CoV-2 Spike蛋白S1亞基還含有一個ICAM-1樣基序(ICAM-1-like Motif),該基序同樣具有TCR結合能力,它通過結合TCRVα(Variable α-domain of TCR,TCR的可變α 域)增進、穩固了neurotoxin-like motif(T299 ~Y351)與TCR的結合。neurotoxin-like motif(T299 ~Y351)可能同時結合TCRVα和TCRVβ(Variable β-domain of TCR,TCR的可變β域)。ICAM-1(Intercellular Adhesion Molecule-1,細胞間粘附分子-1 ),也叫做CD54 (Cluster of Differentiation 54,分化簇54),是一種細胞表面跨膜糖蛋白,通常在內皮細胞和免疫系統細胞的細胞膜上表達,對於免疫和炎症反應的介導至關重要。ICAM-1也在中樞神經系統(central nervous system,CNS)中表達,如在人類前腦的白質和灰質中的小膠質細胞、星形細胞以及內皮細胞中表達。ICAM-1在血腦屏障(blood-brain barrier)中具有關鍵作用,在精神疾病的發病機制中也有重要作用。
SARS-CoV-2 Spike中的ICAM-1-like Motif在SARS-CoV-1 Spike中的對應序列也是ICAM-1-like Motif,二者一致度為74%。SARS-CoV-1 Spike含有2個ICAM-1-like Motif。
SARS-CoV-2/SARS-CoV-1 Spike中的neurotoxin-like motifs和ICAM-1-like motifs
圖a:SARS-CoV-2/SARS-CoV-1 Spike中的neurotoxin-like motifs(綠色行)、ICAM-1-like motifs(橙色行)的有關信息;
圖b:SARS-CoV-2 Spike三聚體(trimer)帶狀模型一個單體(monomer,黃色)上的兩個neurotoxin-like motifs(綠色圓圈指示)、一個 ICAM-1-like motif(橙色圓圈指示)及S1/S2處的PRRA插入region(紫色圓圈指示);
圖c:SARS-CoV-2 Spike-TCR複合體、SARS-CoV-1 Spike-TCR複合體填充模型中與TCR結合的neurotoxin-like motifs。
SARS-CoV-2 Spike蛋白新增了1個SEB樣基序(SEB-like motif),該基序同樣具有強大的TCR結合能力。SEB(Staphylococcal enterotoxin B,葡萄球菌腸毒素B,腸毒素B)是金黃色葡萄球菌的代謝、分泌產物,是一種強大的超級抗原(Superantigen,SAg)毒素,是公認的毒素類生物、化學戰劑,生物恐怖製劑。SARS-CoV-1 Spike中沒有SEB-like motif。
SARS-CoV-2 Spike蛋白中具有SAg能力的腸毒素B樣基序(SEB-like motif)和肉毒桿菌神經毒素樣基序(neurotoxin-like motifs)可能是COVID-19重症患者T細胞大規模激活、增殖,引發細胞因子風暴,造成多器官損傷的關鍵因素(之一)。
SARS-CoV-2 Spike的neurotoxin-like motifs、ICAM-1-like motif、SEB-like motif相輔相成,共同服務於以下致病鏈條:TCR結合—T細胞過度激活--誘發細胞因子風暴、免疫風暴、過度炎症反應--造成多器官損傷;上述3類基序可能也參與SARS-CoV-2 對大腦、神經系統的感染、損傷;SARS-CoV-2 還能通過結合CD4(、TCR)感染、破壞CD4+T淋巴細胞。CD4、CD8是TCR的兩種協同受體,CD4+T淋巴細胞是表面附着CD4的淋巴細胞。
SARS-CoV-2 Spike還含有一個蛇神經毒素樣區域/基序(snake-toxin like region),該區域/基序與眼鏡蛇屬和銀環蛇屬神經毒素同源(序列顯著相似)。
4、SARS-CoV-2繼承、優化了SARS-CoV nsp3蛋白的SARS-unique domain。
Nsp3(non-structural protein 3,非結構蛋白3)是冠狀病毒基因組編碼的最大蛋白質,包含至少8個功能模塊/結構域,對病毒複製、病毒毒力至關重要。SARS-CoV-2、SARS-CoV的nsp3都含有SARS獨特結構域(SARS-unique domain,SUD),擁有SUD是這兩種病毒高致病力的關鍵決定因素之一。
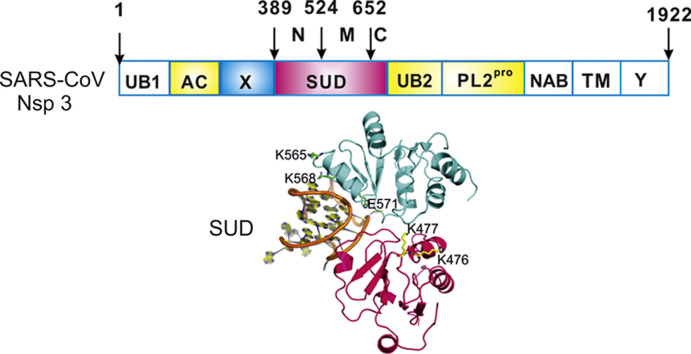
SARS-CoV nsp3組件構成及SUD 3D結構的帶狀模型
SARS-CoV nsp3的SUD包含三個子域(subdomains):SUD-N(N-terminal subdomain)、SUD-M(middle subdomain)、SUD-C(C-terminal subdomain)。這三個SUD子域在SARS-CoV-2 nsp3中同樣存在。

SARS-CoV-2 nsp3組件構成
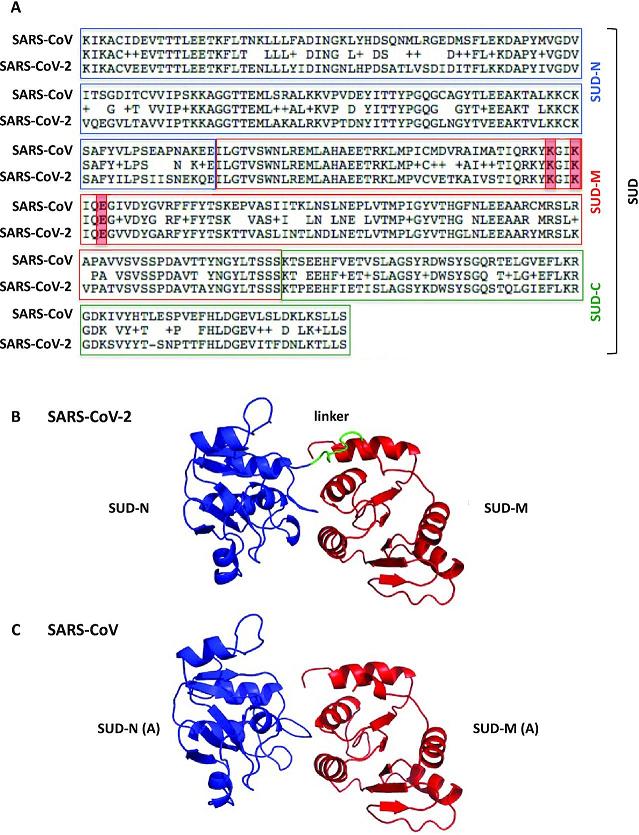
SARS-CoV-2、SARS-CoV SUD的aa序列比對及結構模型(未顯示SUN-C)對照
SUD三個子域中的SUD-N、SUD-M合稱SUD-core,這兩個SUD子域以及SUD之前的X 結構域(X domain,Mac1)都是能夠抑制宿主蛋白抗病毒活性的宏結構域(macrodomain),這三個nsp3中相鄰的宏結構域也依次被稱為Mac1、Mac2、Mac3。同時擁有三個宏結構域,可能是SARS-CoV-2、SARS-CoV在抑制、對抗宿主抗病毒反應方面比其他(冠狀)病毒更有效的重要原因。絕大多數冠狀病毒只具有1~2個宏結構域。
SARS-CoV-2、SARS-CoV SUD的aa序列一致度約為75%。二者nsp3中的SUD相似但不雷同,各有短長;相比SARS-CoV SUD,SARS-CoV-2 SUD在解決方案上具有高度靈活性。
完整的SUD是β譜系B支系(乙型冠狀病毒屬B亞屬)某些冠狀病毒的特有結構。2009年的一篇論文指出:SUD在除SARS-CoV外的所有冠狀病毒中都不存在,具有SUD可能是SARS-CoV具有極高致病性的原因;2015年的一篇論文發現,MHV(Mouse hepatitis virus,小鼠肝炎病毒)nsp3中的DPUP(Domain Preceding Ubl2 and PL2pro)結構域與SARS-CoV SUD的SUD-C子域具有密切的結構相似性。MHV是屬於β譜系A支系的一類冠狀病毒;同年另一篇論文發現,MERS-CoV及MERS-related CoV(HKU4、 HKU5)nsp3含有與SUD-M相似的殘基簇(cluster of residues),還有論文指出,MERS-CoV中也存在與SUD-C相似的結構域。MERS-CoV及MERS-related CoV屬於β譜系C支系;然而,β譜系B支系之外、β譜系之外的冠狀病毒無一擁有完整的SUD。含有SUD-N,並完整擁有SUD-N、SUD-M、SUD-C三個SUD子域的冠狀病毒只存在於β譜系B支系中,可能只有SARS-CoV和SARS-CoV-2。有些論文指出,β譜系B支系的某些SARS-like蝙蝠冠狀病毒,如WIV1、WIV16、Rs3367、RsSHC014也具有SUD,但這些論文並沒有明確指出、顯示這些蝙蝠冠狀病毒擁有完整的SUD。上述四種病毒都是具有ACE2結合能力,甚至具有人體細胞進入能力的特殊蝙蝠冠狀病毒,但是,它們都沒有人類致病能力,都不會使人體產生臨床疾病症狀。
SARS-CoV、SARS-CoV-2 SUD可結合多種宿主蛋白,以及具有G4結構的宿主細胞DNA、RNA或病毒自身RNA(SARS-CoV-2的SUD可能不能結合自身RNA中的G4)。
SARS-CoV、SARS-CoV-2 SUD(full-length SUD及子域SUD-N和SUD-M)都能結合DNA/RNA中的鳥嘌呤四鏈體(guanine quadruplexes,G-四鏈體,G4),它們通過結合含有G4的宿主細胞RNA/mRNA來調節、促進病毒複製、轉錄,並干擾、對抗宿主細胞的抗病毒免疫反應。G4是一種超螺旋(superhelix)結構,存在於DNA 或RNA 鏈中富含G 鹼基(鳥嘌呤)的區域內,是4條鳥嘌呤核酸鏈通過Hoogsteen 型氫鍵(Hoogsteen-type hydrogen bonds)配對互聯形成。G4廣泛參與人和動物的DNA 複製、轉錄、翻譯和端粒結構維持等一系列基本生物學功能。有論文指出,SARS-CoV-2 SUD-core中鬆散連接的SUD-N和SUD-M在與G4 結合時具有更大的靈活性,而SARS-CoV SUD-core中連接SUD-N、SUD-M的二硫鍵橋(disulfide bridge)限制了SUD-N、SUD-M在G4 結合過程中的構象變化。
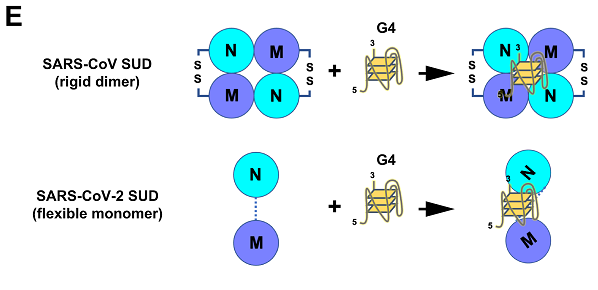
SARS-CoV-2、SARS-CoV SUD-G4作用、結合機制對比圖
SARS-CoV-2、SARS-CoV SUD都能作用、結合人類Paip1,並通過結合Paip1來利用/劫持/霸占細胞的轉錄、翻譯機制,刺激、促進、增強病毒翻譯和病毒蛋白合成,但不促進宿主細胞mRNA翻譯及宿主蛋白合成。Paip1(PABP-interacting protein 1,PABP相互作用蛋白1)是一種宿主翻譯因子-蛋白質翻譯刺激劑,人類Paip1 有三種亞型(isoforms);PABP(Poly(A)-binding protein,多聚腺苷酸結合蛋白)是一類可干預生物體/病毒轉錄、翻譯的生物體蛋白質,PABP 可與生物體自身mRNA或病毒mRNA3'端多腺苷酸尾結合,保護所結合的mRNA不被降解。人類和脊椎動物有五種PABP。PABP 和 Paip1 都是人體細胞翻譯起始複合體(translation initiation complex)的組成部分,SARS-CoV-2、SARS-CoV SUD與Paip1的結合會增強Paip1與PABP 的結合親和力,SUD可能與Paip1、PABP形成三元複合體。
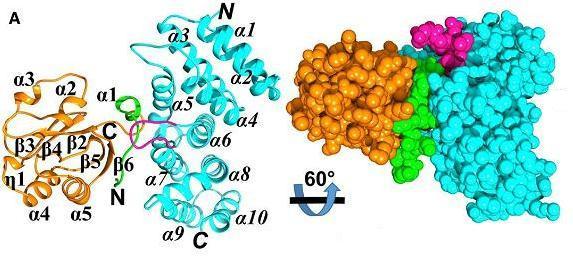
SARS-CoV-1 SUD-N與Paip1M作用、結合示意圖
圖A左:SUD-N(orange)、Paip1M(light blue)複合物晶體結構的帶狀模型;
圖A右:SUD-N(orange)、Paip1M(light blue)複合物晶體結構的空間填充模型。
Paip1M是Paip1的中間域(the middle domain of Paip1)。SARS-CoV-2、SARS-CoV SUD都以子域SUD-N與Paip1M作用結合。
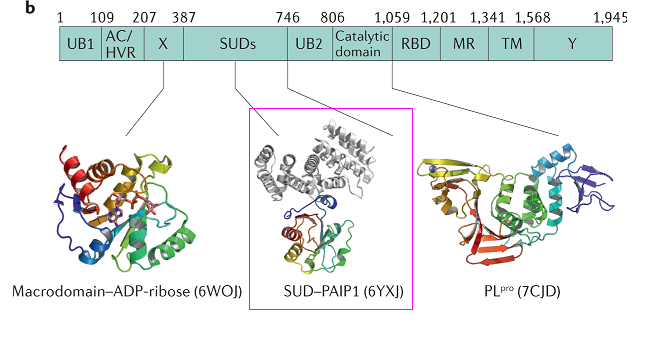
SARS-CoV-2 SUD(框中彩色條帶)、Paip1(灰色條帶)複合物的帶狀模型
SARS-CoV-1 SUD還協同nsp3的另一組件—PLpro/PL2pro(papain-like protease,木瓜蛋白酶樣蛋白酶。SARS-CoV-1、SARS-CoV-2中的PLpro是PL2pro,即木瓜蛋白酶樣蛋白酶2)結構域與E3 泛素連接酶(E3 ubiquitin ligase)--RCHY1相互作用、結合,劫持、利用RCHY1介導泛素化(ubiquitination)和人類p53蛋白降解,抑制宿主細胞/p53蛋白的抗病毒活性,從而促進病毒複製。不包含SUD或不包含完整SUD的的病毒,如MERS-CoV、HCoV-NL63,也能通過PLpro/PL2pro 域結合RCHY1,促使p53蛋白降解;相比之下,SARS-CoV-1的SUD-PLpro 融合物(SUD–PLpro fusion)與RCHY1的結合更強烈,p53蛋白降解效果更顯著(導致更多的p53蛋白被降解)。
儘管未經公開發表的論文實驗驗證,但有論文暗示,這是SARS-CoV-1與SARS-CoV-2的共有能力,即SARS-CoV-2的SUD、PLpro/PL2pro 也能強烈結合RCHY1,促使p53蛋白顯著降解。另外一篇探討SARS-CoV-2致癌性的短論文則明確認為,SARS-CoV-2兼具SARS-CoV-1 的上述能力。
RCHY1(RING finger and CHY zinc finger domain-containing protein 1,包含環指和CHY-type鋅指結構域的蛋白1)是一種具有泛素連接酶活性的人類蛋白,該蛋白可連接/結合p53蛋白並導致後者被降解(水解)。p53蛋白是一種重要的多功能人體蛋白,其功能之一是作為抗病毒因子抑制病毒複製。泛素連接酶/E3泛素連接酶,是能夠將泛素分子連接到目標蛋白質的某個賴氨酸上的酶。泛素(ubiquitin)是一種存在於大多數真核細胞中的小蛋白,它的主要功能是連接、標記需要分解的蛋白質,相應蛋白酶可識別被泛素附着、標記的蛋白質,並將被標記的蛋白質水解。
SARS-CoV-2、SARS-CoV SUD通過結合RCHY1促使p53蛋白降解這一能力不僅促進病毒複製,而且具有高度致癌性。p53蛋白也被稱為p53腫瘤蛋白/p53腫瘤抑制蛋白,是一種重要的腫瘤抑制因子,p53蛋白突變或功能喪失將導致高度的細胞癌變風險,p53蛋白的長期減少同樣是致癌的重大危險因素。
SARS-CoV-2與p53蛋白存在多重關聯。SARS-CoV-2的Spike蛋白等蛋白含有與p53蛋白相似的p53結構域(p53 domain),可能模仿、介入、干預、干擾p53蛋白的生理、病理功能;SARS-CoV-2 Spike蛋白S2亞基的HR-2(第二個七肽重複區域,即前文所說的C-HR)能夠直接地強烈作用、結合p53蛋白及另外兩種腫瘤抑制蛋白--BRCA-1/2(BReast CAncer gene-1/2,乳腺癌基因-1/2)蛋白,這意味着SARS-CoV-2 Spike具有強大的p53蛋白劫持能力。
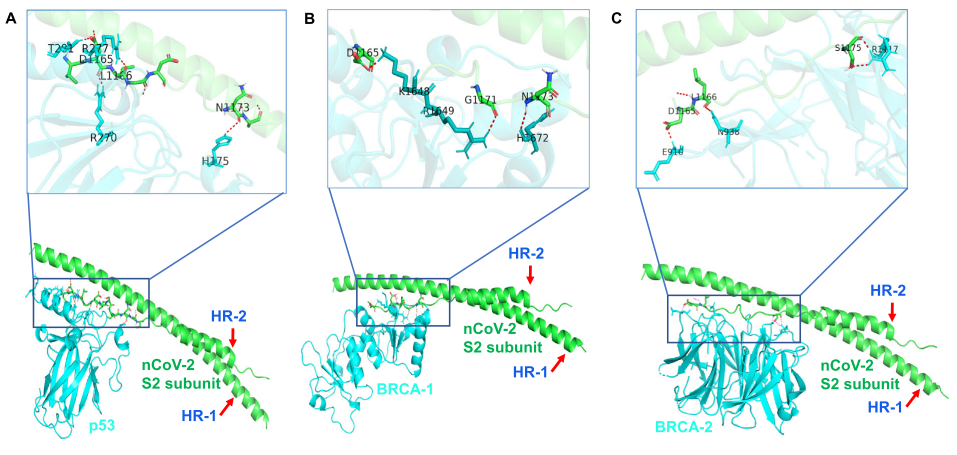
SARS-CoV-2 S2 subunit HR-2與p53、BRCA-1、BRCA-2 strongly interact示意圖
SARS-CoV-2的另一種non-structural protein--nsp2與主要位於細胞線粒體中的兩種抑制素(prohibitin)PHB1、PHB2相互作用,使活性氧(reactive oxygen species,ROS)泄漏到細胞核產生氧化損傷,導致合成p53蛋白的依賴基因被破壞。活性氧(ROS)失調、紊亂也是重要的致癌因素。
SARS-CoV-2與p53蛋白的多重關聯只是SARS-CoV-2高度致癌性的一組因素,SARS-CoV-2具有非常多樣化的致癌途徑。
SARS-CoV-2對人類p53蛋白的間接降解、模仿/干擾、直接結合/劫持,以及多途徑、系統性的人類致癌機制,是在動物宿主中發生的,無目的、隨機性自然變異/自然演化的結果與巧合嗎?
5、SARS-CoV-2繼承、拓展了SARS-CoV E蛋白、ORF3a蛋白的PDZ結合基序。
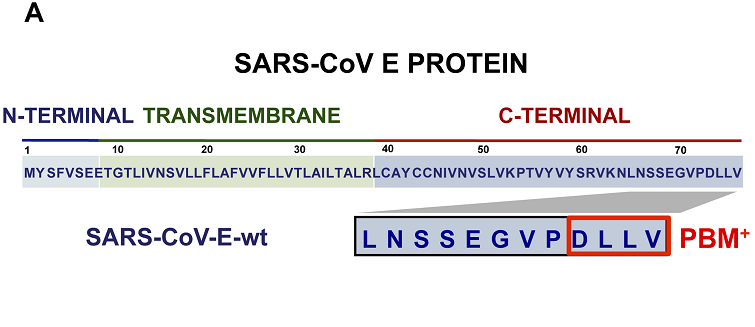
SARS-CoV-2、SARS-CoV E蛋白(Envelope protein)、ORF3a蛋白的C-末端(C-terminal,COOH端,羧基端)都含有PDZ結合基序(PDZ-binding motif,PBM)。
SARS-CoV E蛋白C末端的PBM
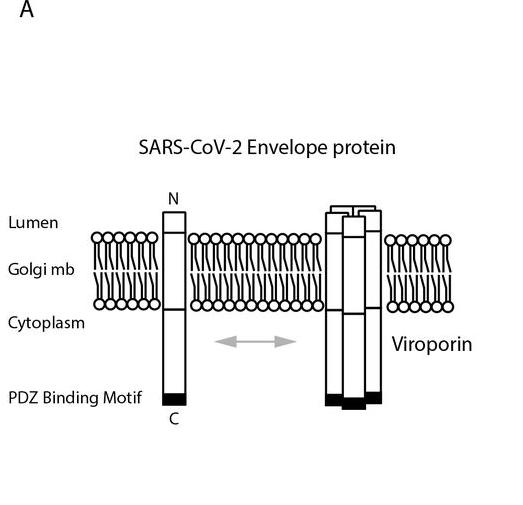
SARS-CoV-2 E蛋白C末端的PDZ-binding motif
PBM是符合特定組合模式的短基序,有三種類型。SARS-CoV-2、SARS-CoV E蛋白C末端的PBM同為DLLV(天冬氨酸-亮氨酸-亮氨酸-纈氨酸),是一個type-II PBM。
SARS-CoV-2、SARS-CoV E蛋白高度相似,二者E蛋白aa序列相似度為94.7%;二者ORF3a蛋白雖然差異較大(aa序列相似度僅為73.1%),但它們的C末端也都含有PBM。
病毒蛋白C末端的PBM是病毒毒力/致病能力的另一重要決定因素。
PDZ-binding motif(PBM)與PALS1(Protein Associated With Lin Seven 1)相互作用、結合併改變後者的亞細胞定位,拉扯PALS1,使其脫離原有的細胞內位置,導致感染者上皮形態改變,使原本緻密的組織結構撕裂、破損、滲漏,造成上皮組織(如肺上皮組織)的廣泛損傷及其它組織損傷。上皮損傷、滲漏、屏障功能喪失後SARS-CoV 病毒將滲入底層組織,並通過體循環擴散到其它組織、器官,造成更廣泛的感染、損傷、破壞。PALS1是一種銜接細胞內組件的鳥苷酸激酶蛋白,PALS1蛋白/基因存在於心臟、肝臟、腎臟、肺、腸、血管、神經系統、眼睛、肌肉、皮膚等眾多器官、組織中。PALS1內的PDZ domain是SARS-CoV-2/SARS-CoV PBM(PDZ-binding motif)的結合位點。
PBM還結合另一種含有PDZ domain的人類細胞蛋白Syntenin(內居蛋白),並以此激活p38 MAPK(p38 mitogen-activated protein kinase,p38絲裂原活化蛋白激酶),導致炎症細胞因子過度表達,誘發“細胞因子風暴”。p38 MAPK是一類細胞內信號傳導因子,參與炎症調節、氧化應激、細胞凋亡等生理、病理過程。PBM結合PALS1造成組織損傷後,免疫細胞試圖修復損傷時釋放細胞因子,也會誘發或加劇大規模炎症及“細胞因子風暴”。
PDZ即PSD-95/Dlg/ZO-1,是三種蛋白首字母的縮寫:Post synaptic density protein(突觸後密度蛋白,PSD-95)、Drosophila disc large tumor suppressor(果蠅盤大腫瘤抑制蛋白,Dlg1)和Zonula occludens-1 protein(小帶閉塞-1蛋白,zo-1)。PDZ domain當初被發現是以上三種蛋白的共有結構,因而得名,後來發現,PDZ domain存在於大量人類和動物蛋白之中,可介導眾多人類蛋白(/動物蛋白)相互作用。病毒蛋白中的PBM(PDZ-binding motif)可結合具有(相應?)PDZ domain的人體/動物蛋白。
截止2020年,共有7種已知的人類致病冠狀病毒。除SARS-CoV-2、SARS-CoV外,其它5種病毒(MERS-CoV、HCoV-OC43、HCoV-HKU1、HCoV-NL63 和HCoV-229E)E蛋白(C末端)也含有PBM,但已論文報告的,ORF3a蛋白(C末端)含有PBM的冠狀病毒可能只有SARS-CoV-2和SARS-CoV,ORF3a蛋白對SARS-CoV-2的致病能力同樣非常重要。在SARS-CoV基礎上,SARS-CoV-2還更進一步,除E蛋白、ORF3a蛋白外,它的N蛋白(Nucleocapsid protein,核衣殼蛋白)的C-末端也含有PBM。
SARS-CoV-2 PBM的結合對象遠不只PALS1、Syntenin兩種。研究表明,SARS-CoV-2 E、ORF3a和N蛋白中的PBM至少可結合16種人類PDZ結合物(human PDZ binders),其中6種結合物也可被SARS-CoV(E、ORF3a蛋白)的PBM結合。16種SARS-CoV-2人類PDZ 結合物中的大多數是參與細胞銜接/連接或維持細胞極性的人體蛋白,SARS-CoV-2可能通過結合、劫持這些細胞元件來服務於自身的感染、複製、致病和免疫逃避。
6、SARS-CoV-2的鐵調素模仿能力、鐵轉運蛋白結合能力可基於SARS-CoV簡單改造獲得。
SARS-CoV-2 Spike蛋白尾部區域能夠模仿人類鐵調素(human Hepcidin),具備鐵調素的鐵轉運蛋白結合等能力。鐵轉運蛋白(ferroportin,FPN,又稱膜鐵轉運蛋白)是已知的唯一一種細胞鐵輸出蛋白;鐵調素與鐵轉運蛋白的結合具有特異性,鐵調素可能是已知的唯一一種/類能夠結合鐵轉運蛋白的天然生物蛋白或多肽。
具有鐵調素模仿能力、鐵轉運蛋白結合能力的,是SARS-CoV-2 Spike蛋白含26個氨基酸的尾部區域,SARS-CoV-2的這一區域與SARS-CoV的對應區域高度相似。

8種冠狀病毒Spike尾部區域,及4種鐵調素的aa序列比對圖
如上圖所示,SARS-CoV-1、SARS-CoV-2對應區域內的26個氨基酸僅有兩個不同:第3位點的L(亮氨酸)~M(甲硫氨酸),第17位點的A(丙氨酸)~C(半胱氨酸)。基於SARS-CoV-1的對應區域,將區域內第3位點的L(亮氨酸)替換為M(甲硫氨酸),將第17位點的A(丙氨酸)替換為C(半胱氨酸),即可獲得SARS-CoV-2的鐵調素模仿、鐵轉運蛋白結合區域。
筆者不確定SARS-CoV(尾部區域)是否也具有人類鐵調素模仿、鐵轉運蛋白結合能力,當前沒有論文研究、檢驗、提及SARS-CoV的相應能力。本文假定SARS-CoV不具備這組能力。SARS-CoV-2可能是已論文報告的,唯一一種具有人類鐵調素模仿能力的病毒,唯一一種可結合人類鐵轉運蛋白的病毒。SARS-CoV-2的Spike還具有人類鐵調素結合能力,它可能也是已論文報告的,唯一一種可結合人類鐵調素的病毒。
相關文章:
萬能”受體適配器--新冠S蛋白 4
7、SARS-CoV-2的DPP4結合能力可基於SARS-CoV簡單改造獲得。
SARS-CoV-2兼具MERS-CoV的DPP4結合能力,並可以DPP4為受體感染某些人體細胞,如腦和脊髓中的人皮質星形膠質細胞。SARS-CoV-2 Spike蛋白RBD中決定DPP4(dipeptidyl peptidase IV,二肽基肽酶4,也叫CD26)結合能力的4個關鍵氨基酸殘基是:D405(天冬氨酸)、E484(穀氨酸)、Y489(酪氨酸)、Q498(穀氨酰胺)。

SARS-CoV-2的4個DPP4結合關鍵氨基酸及SARS-CoV中的對應氨基酸
由上圖可見,4個關鍵氨基酸中的D405、Y489在SARS-CoV中對應相同的氨基酸;而E484
、Q498在SARS-CoV中對應不同的氨基酸:E484在SARS-CoV-1中的對應位點處空缺了一個氨基酸,Q498
在SARS-CoV-1中的對應位點是一個酪氨酸(Y)。
在SARS-CoV-1的E484對應位點處插入一個穀氨酸(E),並將Q498對應位點處的酪氨酸(Y)替換為穀氨酰胺(Q),就基於SARS-CoV-1
Spike獲得了SARS-CoV-2 Spike的DPP4結合能力。SARS-CoV Spike不能有效結合DPP4。
相關文章:
萬能”受體適配器--新冠S蛋白 1
8、SARS-CoV-2改進了對HS/HSPG結合、利用。
HS/HSPG是SARS-CoV-2的眾多感染受體之一,它對SARS-CoV-2感染的介導依賴ACE2,是ACE2的輔助受體或共受體;SARS-CoV-1也有一定程度的HS/HSPG結合能力,但它應該不是SARS-CoV-1的感染受體,有研究表明,HS/HSPG干擾、阻礙而非促進SARS-CoV-1感染。
HS:heparan sulfate,硫酸乙酰肝素,是一種人類和哺乳動物組織中普遍存在的,帶高負電荷的、硫酸化的鏈狀糖胺聚糖;
HSPG:heparan sulfate proteoglycans,硫酸乙酰肝素蛋白聚糖,是1~3個HS多糖鏈與某個蛋白通過共價鍵連接形成的複合體。
SARS-CoV-2的HS/HSPG結合能力強於SARS-CoV。
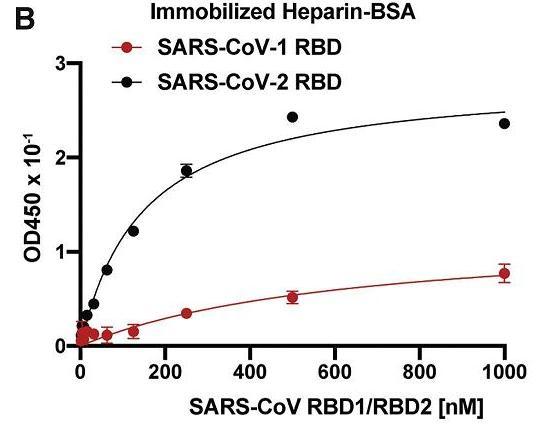
SARS-CoV-2、SARS-CoV-1 RBD的HS/Heparin結合能力對比
相對SARS-CoV-1,SARS-CoV-2 HS/HSPG結合能力的顯著提升,大致可通過兩個氨基酸替換(Glu354Asn、Thr444Lys)/(E354N、T444K)獲得。
SARS-CoV-2 Spike中對結合HS/HSPG貢獻較大的氨基酸殘基有8個,這8個氨基酸及它們在SARS-CoV-1中的對應位點氨基酸在下圖中用紅色方框標出。
SARS-1、SARS-2中決定HS/HSPG結合能力的重要氨基酸殘基
8個HS/HSPG結合重要氨基酸中的4個在SARS-CoV-1 中對應相同的氨基酸,另外4個對應不同的氨基酸,4對差異氨基酸(殘基)是:K346R、K357R、E354N、T444K。氨基酸單字母縮寫中間的數字是後一個氨基酸殘基在SARS-CoV-2 Spike aa序列中的序號。
4對差異氨基酸中的前兩組K346R、K357R都是賴氨酸K到精氨酸R的保守替換。賴氨酸、精氨酸都是鹼性殘基,二者物理、化學性質接近,它們之間的替換是保守替換,對HS/HSPG結合能力的影響不大;對HS/HSPG結合能力提升起關鍵作用的是另外兩組差異氨基酸:E354N、T444K,用三字母縮寫表示即:Glu354Asn、Thr444Lys。
E、Glu是穀氨酸的單字母縮寫、三字母縮寫;
N、Asn是天冬酰胺的單字母縮寫、三字母縮寫;
T、Thr是蘇氨酸的單字母縮寫、三字母縮寫;
K、Lys是賴氨酸的單字母縮寫、三字母縮寫。
SARS-CoV-2 Spike蛋白的第354位點對應SARS-CoV-1 Spike蛋白的第341位點,SARS-CoV-2 Spike第444位點對應SARS-CoV-1 Spike的第431位點。至此可知,以天冬酰胺(Asn,N)替換SARS-CoV-1 Spike第341位點的穀氨酸(Glu,E),同時,以賴氨酸(Lys,K)替換SARS-CoV Spike第431位點的蘇氨酸(Thr,T),簡單改造後的SARS-CoV-1 Spike就獲得了與SARS-CoV-2 Spike大體相當的HS/HSPG結合能力。
相關文章:
萬能”受體適配器--新冠S蛋白 2
9、其它受體關聯
除了都以ACE2為(首要)感染受體外,SARS-CoV-2、SARS-CoV-1還至少共有另外4種感染受體:CD147/Basigin(基礎免疫球蛋白)、vimentin(波形蛋白)、CD209L/L-SIGN、CD209/DC-SIGN。
CD147/Basigin
可以不依賴ACE2獨立介導SARS-CoV-2感染,如介導SARS-CoV-2對T細胞(T淋巴細胞)的感染,也可與ACE2共同介導SARS-CoV-2感染,如介導對腎臟足細胞(腎小球上皮細胞)的感染。vimentin、CD209L/L-SIGN、CD209/DC-SIGN對SARS-CoV-2/SARS-CoV-1感染的介導應該都依賴於ACE2,是ACE2的輔助受體/共受體。
問題
巧合太多了就不再是巧合了。
2005年之後,SARS-CoV就在實驗室外銷聲匿跡了。如果SARS-CoV-2是自然產生的,那麼,它從何種祖先身上獲得(繼承或重組)了如此之多的SARS-CoV基因結構?如果SARS-CoV-2來自動物,那麼,未經任何適應性突變的SARS-CoV-2,何以剛剛接觸人類就以人類為最佳感染對象?就擁有如此深思熟慮、周祥完備、精雕細琢、遊刃有餘的人類感染、致病機制?這些、這樣的人類感染、致病機制可能在蝙蝠、穿山甲或其它動物宿主體內演化產生嗎?它們都是無目的、隨機性自然變異、自然進化、自然重組、自然演化的結果、巧合嗎?
相關文章:
“萬能”受體適配器--新冠S蛋白 5 上
誰設計、製造了新冠病毒(四)匪夷所思
(未完待續)